多溴联苯醚对海洋环境和海洋生物的影响
2014-11-05唐学玺孙开明
唐学玺 张 璟 刘 泳 孙开明 王 悠
(1. 中国海洋大学海洋生命学院, 青岛 266003; 2. 青岛市海泊河污水处理厂, 青岛 266021)
多溴联苯醚(Polybrominated diphenyl ethers, PBDEs),是一类新型的持久性有机污染物(Persistent organic pollutants, POPs)[1], 自20世纪70年代起主要作为阻燃剂被广泛应用于电子电器等数千种产品的生产制造[2,3]。PBDEs在给人类带来众多益处的同时, 不可避免的带来一系列环境问题。在生产、再加工含有PBDEs产品的过程种以及在对此类产品的清理、回收过程中, 都有释放PBDEs到环境中的可能[2,4], 其中废弃的电子产品(电子垃圾, eWaste)是产生PBDEs污染的最主要的途径之一。PBDEs在环境中具有长距离迁移的能力, 因此它的影响不再局限于人类居住的区域, 目前在北极[5]、深海等环境中均检测到该类污染物, 它已经以各种途径进入到全球范围内的各种环境介质如大气、土壤、水体中[6]。目前欧盟以及美国、加拿大等国已先后拟定相关法案限制或禁止PBDEs在电子电气产品中的使用, 但是目前全球大部分国家仍在使用PBDEs, 大量的PBDEs仍在持续的排入环境, 且以大约每2—5年增加1倍的速度不断增加[7]; 并且PBDEs的化学稳定性较强, 环境中现存的PBDEs仍然可能产生长期的生态效应。因此, PBDEs污染已经成为全球性的环境问题而引起人们的广泛重视。
1 PBDEs的物化特性
PBDEs是一类以溴为基础的有机卤素化合物, 一般是在夫里得—夸夫特(Friedel-Craft)催化剂作用下通过联苯醚溴化生成, 化学通式为C12HxBryO(x+y=10), 其化学结构如图1所示[5]。
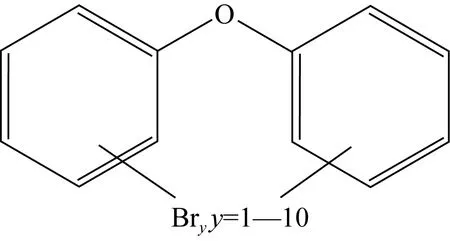
图1 PBDEs的化学结构式Fig. 1 Chemical structure of PBDEs
根据溴原子在苯环上数目和取代位置的不同,PBDEs理论上存在209种同系物[7], 可分为10个同系组,分子量在 249.0—959.2, 沸点在 310—425℃。室温下,PBDEs蒸汽压低、脂溶性强, 其在水中的溶解度随溴原子个数的增加而减小。表1对PBDEs10个同系组的部分物理性质进行了比较[7—9]。
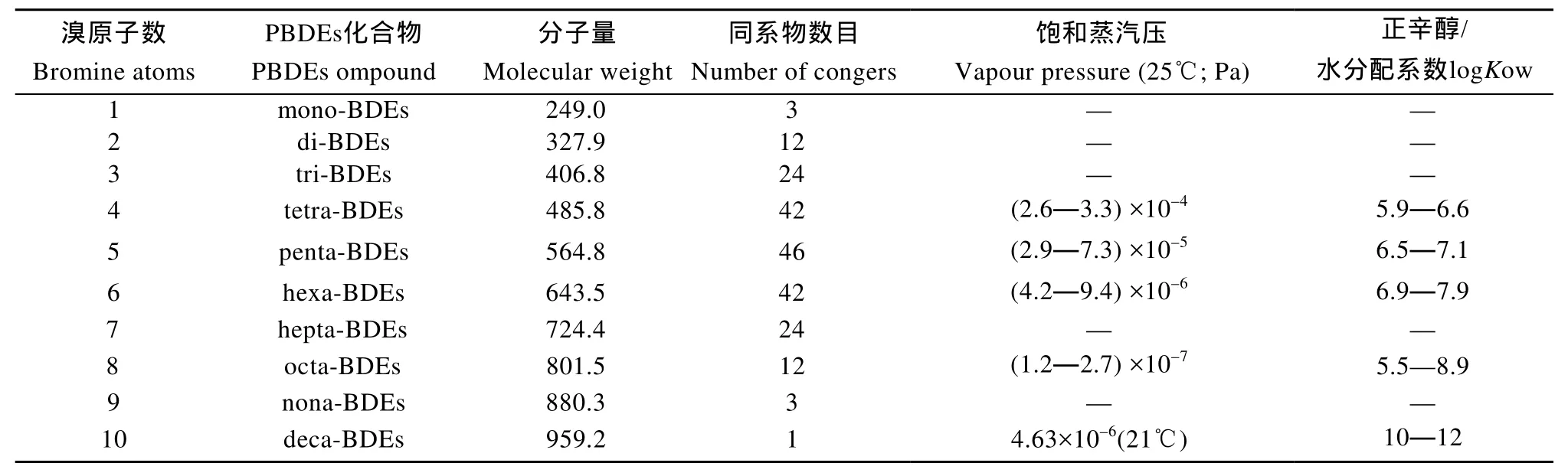
表1 PBDEs同系物的物理性质[7—9]Tab. 1 Physical properties of PBDEs[7—9]
PBDEs属于非离子型化合物, 化学性质稳定[10], 在自然界很难发生化学降解和光降解, 也难以被微生物降解, 可以长期存在于环境中造成持续污染。在实验室条件下, 高溴代的联苯醚溶解于己烷中, 邻位溴的光解活性变大, 经光照 (紫外光或太阳光) 可形成低溴代PBDEs[9]。另外, 在PBDEs制备、燃烧及高温分解的过程中, 还会释放溴原子生成剧毒致癌物多溴二苯并二 噁英(Prediction of the retentions of polybrominated dibenzop-dioxins, PBDDs)及多溴二苯并呋喃(Polybrominated dibenzofuran, PBDFs)[12]。而且, PBDEs的降解产物(OH-BDE)在紫外线辐射的条件下, 也可以生成PBDDs[13]。
2 PBDEs对海洋生态系统的污染现状
海洋是地球上各种污染物的最终归宿。虽然 PBDEs具有高亲脂性, 在水中的溶解度仅为 10—40 μg/L[9], 但它们仍然可以通过大气沉降[14]或地表径流[15]等多种途径进入海洋环境。目前在世界大部分地区的海水、海洋沉积物和多种海洋生物体内均已检测到较高浓度的 PBDEs,且海洋环境中PBDEs的水平一直在持续增加[10]。
2.1 PBDEs在海洋水体与沉积物中的分布
世界各地的海洋水体均受到 PBDEs不同程度的污染。其中, 北美海洋表层水体受到污染最为严重, PBDEs高达0.158 ng/L[16]。在欧洲国家中, 瑞典和荷兰近海水体表层中 PBDEs分别为 0.1—1 pg/L(1993年)[15]和 0.1—5 pg/L(1999年)[17], 远低于北美海域的污染水平。在亚洲, 2005年中国香港沿岸海域报道表层水体中溶解态PBDEs含量为31.1—118.7 pg/L[18], 其污染水平介于北美与欧洲海域之间。据BSEF(Bromine Science and Environment Fonum)统计, 2001年PBDEs的使用量居全球前三位的分别为美国、亚洲和欧洲。该使用量与各地区海域表层水体PBDEs含量呈现部分一致趋势, 表明对PBDEs使用量的增大可能是导致海洋表层水PBDEs浓度升高的重要原因。
PBDEs易被水体中的悬浮颗粒吸附而随其沉降到沉积物中[19], 因此沉积物中PBDEs的含量往往较水体含量高 1—2个数量级[20], 且高溴代 PBDEs比低溴代 PBDEs更容易被水中颗粒物质吸附而沉降于海底[21,22]。PBDEs在全球各海域沉积物中的分布是极不均衡的, 如: 葡萄牙近海沉积物中总 PBDEs含量为 0.5—18 ng/g(2003年)[23], 韩国附近海域沉积物中总 PBDEs含量为1.1—33.8 ng/g (2002年)[24], 我国香港附近海域沉积物中总PBDEs含量为1.7—53.6 ng/g (2005年)[25]; 而我国渤海以及南海近海沉积物中总 PBDEs含量较低, 渤海湾沉积物中总PBDEs含量为0.35—1.1 ng/g(2007年)[26], 南海北部沉积物中总PBDEs含量为0.04—4.5 ng/g(2005年)[21]。
2.2 PBDEs在海洋生物体内的蓄积
PBDEs具有较强的亲脂性和生物蓄积性, 还能通过生物转化形成亲脂性代谢物[27], 进入海洋后极易在海洋生物体的肌肉和脂肪组织中积累[28], 并可以通过食物链逐级传递放大[3,6], 具有明显的生物放大作用, 对食物链的高级结构如鱼类和海洋哺乳类动物产生严重危害[29]。目前, 在海洋浮游生物、底栖生物、游泳生物中均发现了较高浓度的PBDEs, 而且PBDEs的含量正逐步上升[21,30]。目前检测到的海洋生物体内的PBDEs同系物主要是BDE-47、BDE-99、BDE-100、BDE-153、BDE-183和BDE-209[31—33], 其中含量最高的是BDE-47, 一般占总PBDEs的50%以上[34,35]。
总体来说, 全球不同海域中脊椎动物对PBDEs的富集能力普遍高于无脊椎动物[36], 这可能与脊椎动物所处的营养级较高有关[29], PBDEs可以在食物链(网)富集、生物放大的现象已被国内外许多学者研究所证实。如: 中国大亚湾海域生物体内PBDEs的含量与生物营养级高低成正比[37]; 大西洋鲱体内BDE-47、BDE-99 和BDE-100的含量比在桡足类中相应成分的含量高2倍[38]; Ikonomou, et al.[30]报道, 在海洋食物链中处于较低营养级的太平洋大蟹(Dungeness Crab)组织中PBDEs的含量为200—480 ng/g(脂重), 而处于高营养级的海豚中PBDEs的含量为350—2300 ng/g(脂重); Losada, et al.[39]对澳大利亚悉尼港典型食物链的研究表明, PBDEs (BDE-47、BDE-49、BDE-66、BDE-99、BDE-100、BDE-153、BDE-154)呈现较强的生物放大效应, 营养级放大因子(TMFs)的范围为2.6—9.6。
溴原子数量和取代位置的不同会影响PBDEs在食物链中的富集能力[40]。PBDEs的生物积累程度取决于分子通过生物膜能力的大小[41], 随着溴原子数量的增多, 其在海洋食物链中的生物积累程度逐渐下降[42]。如在大西洋波罗地海, BDE-47是浮游动物—鱼类食物链中主要的PBDEs组分, 在浮游动物中含量为2.3 ng/g(脂重), 在鱼类中含为3—22 ng/g(脂重); 相同食物链中BDE-209在浮游动物中含量为2.1 ng/g(脂重), 与BDE-47相当, 但BDE-209在鱼类中的含量较BDE-47低2—3个数量级(0.082—0.41 ng/g 脂重)[43]。Hakk和Letcher[44]的研究也发现在高营养级物种体内的四溴联苯醚(BDE-47)的含量明显高于五溴联苯醚 (BDE-99)的含量。此外, Herbstman[45]检测南极磷虾成体中PBDEs的含量为0.1—10 ng/g(脂重),而幼体中PBDEs的含量高达100—1000 ng/g(脂重), 说明南极磷虾幼体较于成体对PBDEs的蓄积能力更强。
3 PBDEs对海洋生物的毒性效应
Burreau, et al.的研究表明, 鱼类对PBDEs吸收能力与 PBDEs溴原子数目成反比[41,46]。因为低溴代 PBDEs含有的溴原子数量少、空间位阻小, 所以较于高溴代PBDEs更容易进入生物体内部, 从而对有机体产生的毒性作用更为显著[47]。而高溴代 PBDEs被有机体摄入后,可降解为毒性较高的低溴代PBDEs同系物[48]。此外, 由于 PBDEs具有较高的生物蓄积特点, 即使是较低浓度的胁迫也会对生物体产生生理毒性[5]。并且, PBDEs在生物体内通过代谢可以转化为多种毒性物质, 如通过羟基化生成 OH-PBDEs代谢产物, 进而通过甲基化生成MeO-PBDEs代谢产物[49]。现已在多种水生动物体内都检测到了PBDEs的羟基化和甲基化代谢产物[50]。
目前众多关于PBDEs毒性的研究表明, PBDEs对有机体的影响主要集中于对其神经、生殖、免疫等方面的毒性效应。此外, PBDEs还可以影响生物的基因组成或造成动物细胞染色体的明显损伤, 使得种群内基因的杂合率降低、基因型的组成也发生了变化[51]; PBDEs胁迫造成生物体细胞畸变, 导致微核率增加及异常细胞核的出现等[52]。
3.1 神经毒性效应
大量实验结果表明, PBDEs暴露会对受试动物产生运动、行为功能及认知能力等方面的损伤[53—55]。PBDEs可以直接对神经元细胞以及胶质细胞等产生细胞毒性。此外, PBDEs暴露还能够降低谷氨酸信号受体关键蛋白的表达, 干扰谷氨酸-NO-cGMP通路, 影响脑源性神经生长因子以及各种烯醇酶的表达[54]。
在对海洋生物的研究发现, DE-71(一种商用PBDEs产品, 由四溴、五溴、六溴和七溴联苯醚组成的PBDEs混合物)会 严重影响大西洋 鳉鱼(Fundulus heteroclitus)的运动能力与行为反应。一方面 DE-71 会导致 鳉鱼肢体活动的减少、惊吓反应(Fright responses)迟缓并且出现昏睡现象(Lethargic behavior), 另一方面却增加了鳉鱼的捕食活动[56]。PBDEs对斑马鱼(Danio rerio)的研究表明, 32 μmol/L的BDE-49可显著降低斑马鱼的接触–回避反应(Touchescape responses)[57], BDE-28和BDE-47可显著减低斑马鱼的游泳速率[58]。目前, PBDEs产生神经毒性的潜在机制还不十分明确, 但现有的研究表明[59], PBDEs的神经毒性主要表现为影响神经递质信号转导系统、干扰甲状腺激素系统等方面。例如, PBDEs可通过干扰神经系统影响大西洋鳕鱼(Atlantic tomcod)的运动、行为和记忆等生理功能[60];BDE-47通过影响青虾(Palaemonetes pugio)神经递质系统中乙酰胆碱酯酶(Acetylcholine esterase, AchE)的活性而影响其运动行为[61]。与甲状腺激素相关的研究表明,BDE-47能降低黑头呆鱼(Fathead minnows)血液中甲状腺激素的水平, 进而改变脑内甲状腺激素受体信号的传递[62]; PBDEs可以改变灰海豹甲状腺激素的代谢和传递途径[63], 进一步影响血钙水平及脑部发育。实验证实, 甲状腺激素有调节血液中Ca2+的作用, 在脊椎动物脑的正常发育中起主要作用[64,65]。
3.2 生殖、发育毒性效应
PBDEs能与雌激素受体以及雄激素受体等产生拮抗或竞争作用[54,66], 干扰生物的内分泌系统, 因而具有亚慢性和慢性生殖、发育毒害作用[67]。此外, PBDEs通过环境因素降解生成的二级产物, 如PBDDs、PBDFs, 可诱导芳烃烃羟化酶(Arylhydrocarbonhydroxylase, AHH)和乙氧基–异酚恶唑脱乙基酶(7-ethoxyresorufin-o-deethylase,EROD)的活性, 它们同样具有生殖毒性作用[68]。
PBDEs对有机体生殖与发育的影响取决于不同的PBDEs同系物及不同的生物物种[69,70]。对浮游和底栖生物的研究表明, BDE-47、BDE-99和BDE-100能显著抑制桡足类(Nitocra spinipes)的发育、增殖和种群增长速率[71,72];BDE-47会降低短刀小长臂虾(Palaemonetes pugio)的孵化率[73], 对甲壳类动物(Daphnia magna)的生殖亦有抑制作用[74]。本实验室最新的研究结果也证实BDE-47和BDE-209具有升值与发育毒性: 与未受胁迫的对照组相比, 50 μg/L的BDE-47能导致褶皱臂尾轮虫(Branchionus plicatilis)滞育卵的比例显著上升; 而50 μg/L的BDE-209能显著影响轮虫的胚胎发育时间; 当BDE-47、BDE-209浓度为200 μg/L时, 则能显著缩短轮虫的生殖期, 并抑制其种群增长。PBDEs对鱼类生殖影响的研究表明, 雌性三刺鱼(Gasterosteus aculeateus)在PBDEs中暴露3.5个月后,实验组的孵化率只有20%, 远低于对照组80%的孵化率[75];BDE-47 可导致雄性青 鳉鱼(Oryzias latipes)精液减少[76]且会影响子代雌雄比例[77]。此外最新的研究显示, PBDEs还具有潜在的外源性雌激素的作用[78,79]。
3.3 免疫毒性效应
PBDEs对海洋生物免疫毒性的研究极少, 仅有的研究主要集中于对海洋哺乳动物的研究。Beineke, et al.[80]对欧洲海域搁浅的和海捕的鼠海豚(Phocoena phocoena)进行的研究显示, PBDEs会导致鼠海豚体内胸腺萎缩、脾脏衰竭, 且胸腺的萎缩与体内总PBDEs含量之间存在正相关性, 表明PBDEs对免疫器官的病变可能具有原初毒性诱导[40]。Frouin, et al.[81]将港海豹外周血的粒细胞以及11B7501B-淋巴瘤细胞系的3种免疫细胞暴露于不同浓度PBDEs(BDE-47、BDE-99和BDE-153)中发现, 随着PBDEs浓度的升高, 3种免疫细胞的噬菌活性以及细胞内硫醇含量显著下降; 港海豹中性粒细胞内H2O2水平与PBDEs的处理浓度呈正比, 说明PBDEs胁迫导致氧化胁迫的产生,从而产生毒性作用。
甲状腺激素(Thyroidhormone, TH)与细胞代谢速率密切相关, 是影响机体许多组织、器官生理生化机能的重要激素。研究指出, PBDEs不仅会对甲状腺的组织形态产生损伤[82], 还能通过改变海洋脊椎动物血液中TH的动态平衡[54]从而影响有机体免疫等生理机能的变化[44,83]。TH包括三碘甲状腺原氨酸(T3)和甲状腺素(T4), 影响甲状腺激素功能的主要是T3, T4作为 T3的前体及储备形式参与TH的调控。虽然在小鼠子代暴露BDE-209的实验中发现,幼鼠体内T3含量降低, 而T4含量不变[84], 但大部分的实验认为PBDEs对TH系统的损伤主要体现在其对T4的影响[62,85,86]。一方面, PBDEs可降低T4的含量而影响TH的生成[55,87]。另一方面, PBDEs尤其是其代谢产物OH-PBDEs与 T4的构象非常相似, 其可以通过置换 T4与甲状腺素运载蛋白(transthyretin, TTR)结合, 从而改变TH的代谢和传递[88,89]。
4 PBDEs对海洋生物的毒性作用机制研究
有关PBDEs在海洋生物体内的代谢、作用途径及毒理机制等方面的研究并不如在陆地生物中的研究那么透彻,从现有的研究来看, 该类污染物对海洋生物可能的作用途径和毒理机制主要集中于以下两方面:
4.1 基于钙离子信号转导学说的作用机制
钙离子(Calcium ion, Ca2+)作为生物体内耦联胞外信号与胞内生理反应的第二信使, 几乎与所有细胞内的生化过程息息相关, 外部刺激导致的应激胁迫多数会引起Ca2+的响应[90,91]。
Kodavanti, et al.[92]研究发现在三刺鱼(Gasterosteus aculeateus)体内, PBDEs可能促进花生四烯酸 (arachidonic acid) 的释放、增加蛋白激酶C(Protein kinase C,PKC)的运输、导致Ca2+动态平衡变化可形成特异性的钙信号, 从而产生氧化应激反应。本实验室最新研究显示,PBDEs可引起褶皱臂尾轮虫体内Ca2+浓度升高, 且会诱导钙调蛋白(Calmodulin, CaM)基因表达异常。当Ca2+与高度亲和Ca2+的酶或蛋白质(如: CaM)结合, 会形成特异性的钙信号, 激活细胞内的一系列应激或防御性生理反应[93],抵御氧化胁迫的伤害。由Ca2+介导的信号转导在应激反应、胞外分泌过程以及细胞凋亡等过程中发挥重要作用[90]。细胞色素P450 (Cytochrome P450, CYP450)即是受Ca2+信号调控的, 主要参与外源性物质代谢的关键酶, 在针对与多溴联苯醚结构相似的外源有害物质如二 噁英和多环芳烃的排毒机制响应的初始阶段中发挥主要作用[94]。Lebeuf, et al.[67]研究表明: PBDEs可通过引发特异性的钙信号以诱导大西洋小鳕(Atlantic tomcod)肝脏中CYP450解毒系统的活性, 并可能在PBDEs的排毒系统的响应过程中发挥主要的作用[95]。
4.2 基于活性氧学说的作用机制
ROS有利于抵御病原体对细胞的侵入, 调节抗病基因的表达, 但过量的ROS会引起机体一系列的氧化损伤[96]。本实验室最新的研究也证实, 高浓度的BDE-47和BDE-209会诱导褶皱臂尾轮虫细胞内ROS水平的升高,并引发氧化应激(oxidative stress)系统的响应。体外实验同样发现, 剂量为5 μmol/L的BDE-47便会导致Jurkat细胞内ROS的含量显著升高[97]; HepG2细胞受到0.1 μmol/L的BDE-47胁迫时便会引起ROS含量升高、细胞凋亡、DNA片段化[98]等一系列氧化损伤。
机体内ROS的清除可以分为酶促及非酶促两大类,前者主要包括超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase, CAT)等; 后者则包括胡萝卜素(Carotene)、类黄酮(Flavonoid)等小分子物质。此外, 抗坏血酸-谷胱甘肽循环(AsA-GSH cycle)[99,100]以及谷胱甘肽循环(GSH-GSSG cycle)[49]等氧化还原系统的响应在清除ROS、保持细胞内氧化还原状态等方面也起到关键作用。
目前, PBDEs对海洋生物抗氧化防御系统影响的研究正在展开。有学者提出, PBDEs对海洋微藻的抗氧化防御系统有明显影响, 但不同微藻的抗氧化酶系对PBDEs的响应存在差异[101]。其中, SOD和CAT是保护藻体免受氧自由基破坏的两种重要抗氧化酶[102], 通常在ROS升高的第一时间就被激活[103], 在清除O2−⋅和H2O2、阻止或减少·OH形成、保护机体免受自由基损害等方面发挥着重要作用[104]。同时, 大量的研究均表明PBDEs能激活细胞内的一系列氧化应激或抗氧化防御性生理反应, 抵御其对机体产生的氧化胁迫损伤。如: BDE-47可在造血细胞以及神经细胞内产生氧化应激[55,105]。He, et al.[98]的研究也指出, BDE-47胁迫会导致原代培养的大鼠海马神经元谷胱甘肽(Glutathiose, GSH)含量增加、SOD活力升高; 在更高浓度胁迫的条件下, 还会引起谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)和丙二醛(Malonaldehyde, MDA) 含量的升高。Tjarnlund, et al.[106]观察到通过饲喂、接触BDE-47和BDE-99, 可导致虹鳟鱼(Oncorhyncus mykiss)血细胞比容及血糖受损, 并可抑制其肝脏中7-乙氧基异吩恶唑酮脱乙基酶(Ethoxyresorufin-O-deethylase, EROD)和谷胱甘肽还原酶(Glutathione reductase, GR)的活性。
5 展望
现有的研究报道主要集中于低溴代PBDEs在海洋环境中的分布以及在海洋生物体内的富集等方面的调查分析。随着全球高溴代 PBDEs消耗量的不断增多, 海洋环境及生物体内PBDEs的组成成分也随之发生变化。因此在今后的研究中, 应加强高溴代 PBDEs在海水、沉积物中分布、迁移、降解过程以及在生物体内的富集、转化等行为的研究, 以便完整地评价PBDEs的海洋生态风险性。
作为一类持久性有机污染物, PBDEs的海洋毒性效应研究的对象多是高营养级海洋生物, 然而低营养级的浮游生物在海洋生态系统物质循环和能量流动中起着重要作用, 是有机污染物进入海洋食物网的重要途径, 但迄今为止, 对海洋低营养级生物的研究极少, 相关的系统的机理机制和作用途径的研究更是未见报道。在今后的研究中, 可尝试从宏观、微观等不同生物组织层次上系统分析PBDEs对海洋生物的影响及毒理机制, 以期能全面、综合评价PBDEs所产生的生态学效应。
