浅水应激后黄斑蓝子鱼生理指标变化及牛磺酸的抗应激作用
2014-11-05卢玉标游翠红王树启李远友
卢玉标 游翠红 王树启 李远友
(汕头大学海洋生物研究所, 广东省海洋生物技术重点实验室, 汕头515063)
鱼类是低等脊椎动物, 与高等脊椎动物相比,鱼类对生存环境的依赖性较强, 但仍具有对环境胁迫产生应激反应的能力。在自然条件下, 鱼类可以通过应激反应来适应环境的变化。然而, 在养殖生产中, 鱼体不能逃避或克服人为的应激胁迫。此时,应激反应对鱼体是有害的, 且应激反应越强, 伤害越大。因此, 正确认识鱼类应激并采取适当措施减少应激的危害, 在水产养殖中具有重要的理论和现实意义。
鱼类应激反应从神经内分泌反应开始, 主要表现在两个系统: 一个是交感神经-嗜铬组织系统(SC系统), 另一个是下丘脑-垂体-肾间组织轴(HPI轴), 分别释放肾上腺素和皮质醇到血液中[1]。肾上腺素主要通过促进糖原分解在短期内提供能量[2],皮质醇主要通过促进葡萄糖异生以及脂肪和蛋白质的分解代谢在长期内提供能量[3,4]。细胞应激反应的一个共同特征是在应激时产生热休克蛋白(HSPs)。热休克蛋白70 (HSP70)是机体在应激情况下细胞内迅速合成的一种蛋白质, 具有高度保守性, 对应激可产生保护、耐受作用, 且具有交叉耐受性[5]; 可以清除应激所造成细胞内的异常或变性蛋白质, 具有活化其他细胞基因的作用[6]; 能够抑制由于 ATP损耗引起的细胞凋亡[7]。鱼类HSP70 在各种应激条件下的表达情况一直是鱼类热休克蛋白发现以来的研究热点。
黄斑蓝子鱼(Siganus canaliculatus)为暖水近海小型鱼类, 常栖息于岩礁和珊瑚丛中, 具集群游动和觅食特性, 有一定的维护领地和排他性攻击行为,各鳍棘有毒腺[8]。本课题组发现该鱼具有合成高度不饱和脂肪酸(HUFA)的能力[9], 这是首次报道具有HUFA合成能力的海水鱼类。该鱼富含HUFA, 肉质细嫩, 味道鲜美, 骨刺较少, 营养价值高[10]; 种苗来源较广, 饲养周期较短, 已成为海水养殖专家积极推荐的规模化养殖新品种[11]。但该鱼受到刺激时容易受到惊吓, 产生较强烈的应激反应, 如鳍条张开伸直, 惊恐乱窜, 体色急剧变为深黑色, 甚至沿着水面向上跳跃[8]; 在拉网、捕捞、分鱼和药浴等操作过程中容易受伤甚至死亡, 带来较严重的经济损失。因此, 研究蓝子鱼应激反应特点和机制, 探讨弱化其应激反应的方法将具有重要的理论和现实意义,也是开展规模化养殖与繁殖的关键之一[12]。然而,目前未见这方面的研究报道。
牛磺酸, 化学名为 2-氨基乙磺酸, 可溶于水, 化学性质稳定, 是一种非蛋白条件性必需氨基酸[13]。它具有较广泛的生物学功能, 如参与神经和视觉发育,渗透压调控, 胆汁酸合成和脂肪代谢; 具有保护细胞膜, 解毒抗氧化, 调节钙离子通道, 影响激素释放等作用; 作为一种抑制性神经递质, 能调节中枢神经系统神经元的活动, 发挥安定镇静、抗惊厥的作用, 可以降低机体对应激的反应性, 起预防应激的作用[14,15]。在养殖生产中, 为了缓解应激所造成的负面影响, 通常在饲料或水体中添加一定的抗应激物质。目前, 关于牛磺酸作为鱼类抗应激物的研究报道很少。结合蓝子鱼应激敏感性高的特点, 本试验探讨牛磺酸对黄斑蓝子鱼的抗应激作用。
由于浅水应激是拉网、捕捞、分鱼和药浴等操作过程中常面临的应激类型, 且容易精确控制和重复, 也不受鱼体大小和实验环境的影响[16,17], 所以本研究拟选取急性浅水应激作为实验应激处理方式。主要通过测定血清肾上腺素、皮质醇、胆固醇和葡萄糖等生理生化指标以及脑 HSP70 mRNA的变化情况, 研究黄斑蓝子鱼的急性应激反应特点和评估牛磺酸的抗应激效果。
1 材料与方法
1.1 实验鱼与驯养管理
实验所用黄斑蓝子鱼捕自汕头大学海洋生物实验室南澳临海实验站附近海域, 选取规格基本一致(30 g左右)的鱼于室内圆柱形养殖缸(70 cm×60 cm,200 L)内驯养, 共12个缸, 每缸20尾, 采用微流水养殖。养殖用水为沙滤后的天然海水, 盐度(30±2) ‰, 水温为(28±1)℃, pH 7.5 左右; 适量连续充气,水体溶氧≥5 mg/L; 日光灯调整光照时间每日12h。每天用本实验室配制的人工配合颗粒饲料饱食投喂2次(8:30, 16:30)。每天清晨用虹吸法去除水族缸底部的粪便。尽量减少人为干扰, 保持安静, 防止额外应激。
1.2 实验设计
实验鱼驯养 15d后用于应激实验。鱼禁食 24h后, 将其中 1个缸的水缓慢放掉大部分(不惊扰鱼)后, 往缸里加入麻醉剂 2-苯氧基乙醇(0.5 mL/L)使鱼被迅速麻醉, 然后随机取 9尾鱼的样品, 作为应激前取样点。另外 5个缸用于浅水应激处理, 即将缸中水缓慢放掉至鱼体露出背部, 鱼产生强烈的应激反应(鳍条张开伸直、惊恐乱窜); 4min后向其中一个缸内快速加入 2-苯氧基乙醇(0.5 mL/L)将鱼麻醉,作为应激后0min取样点; 向其余4个缸内重新注入适量海水, 分别于 20、40、60、80min后从各缸随机取9尾鱼的样品, 作为应激后20、40、60、80min取样点。它们也作为牛磺酸浸泡的对照组。另外 6个缸在应激处理前用0.02‰的牛磺酸浸泡2d, 进行与上述相同的应激处理与取样。
1.3 样品采集和处理
在每个取样点, 用 1 mL一次性医用注射器于尾静脉快速取血, 每条鱼取0.5 mL左右。血样于4℃静置4h以后, 在4℃、4000 r/ min下离心10min, 收集血清保存于–20℃下用于生化指标测定。另外将鱼解剖, 取鳃和脑入液氮速冻后, 保存于-80℃备用。
1.4 血清生化指标测定
血清皮质醇和肾上腺素浓度使用美国 RB公司的ELISA试剂盒测定, 葡萄糖和胆固醇浓度使用南京建成生物工程研究所的试剂盒测定。
1.5 脑HSP70 mRNA 测定
利用Trizol试剂(Invitrogen, USA)从蓝子鱼脑样品中提取总RNA, 然后使用PrimeScript RT reagent Kit (Perfect Real Time)(Takara Code: DRR037)进行反转录获得单链 cDNA。根据黄斑蓝子鱼 HSP70 mRNA 部分序列(GenBank Accession No.: EU 107279.1), 利用primer premier5.0软件设计HSP70特异性引物 F1(5'-TGGATAAAGGCAAACGAGGA GA-3')和R1(5'-GCTCTCTTGTTTTGGCTGATGTC-3')。管家基因 β-actin 的引物为 F2(5'-ATCGGC AATGAGAGGTTCC-3')和 R2(5'-GACAGCACAG TGTTGGCGT-3')[18]。使用 SYBR Premix ExTaqTM(Tli RNaseH Plus)试剂盒(Takara Code: DRR420A)和ABI 730 system real-time PCR仪进行real-time PCR扩增反应。PCR 反应体系: SYBR Premix Ex TaqⅡ(2×)10 µL;正向引物(10 µmol/L) 0.4 µL; 反向引物(10 µmol/L) 0.4 µL; ROX Reference Dye (50×)0.4 µL; 模板 2 µL; 双蒸水 6.8 µL; 总体积为 20 µL。PCR 扩增条件为: 预变性, 95℃ 30s; PCR反应,95℃ 5s、60℃ 31s, 40个循环; 溶解条件为: 95℃15s、60℃ 1min、95℃ 15s。随机取样品 cDNA, 通过梯度稀释法, 制作 HSP70和 β-actin的标准曲线,由两标准曲线方程的斜率求得HSP70 和β-actin 的扩增效率基本相同在 0.9—1, 符合 2–ΔΔCt方法计算的前提条件。以黄斑蓝子鱼β-actin为内参, 以对照组应激前HSP70 mRNA为基准, 对得到的各样品Ct值进行均一化处理, 应用 2–ΔΔCt计算方法[19]确定各样品HSP70 mRNA相对水平。
1.6 数据分析
数据用 Origin 7.0软件进行单因素方差分析(ANOVA)和Tukey多重比较法分析, 当 P < 0.05 时认为差异显著。所有结果均以平均值±标准误(Mean± SEM, n=9)表示。
2 结果
2.1 在急性浅水应激后黄斑蓝子鱼血清肾上腺素和葡萄糖浓度的变化情况
在急性浅水应激后, 黄斑蓝子鱼的血清肾上腺素和葡萄糖浓度的变化情况见图1。在4min浅水应激后, 血清肾上腺素浓度迅速升高, 在0min时从应激前的(2.00±0.22) ng/mL 达到应激后的(15.12±1.04) ng/mL(P<0.05), 之后逐渐恢复到应激前水平; 血清葡萄糖浓度在应激后逐渐升高, 20min时达到最大值(7.10±0.38) mmol/L, 是应激前(2.15±0.02) mmol/L的约3.5倍(P<0.05), 60min后恢复到应激前水平。这说明, 血清肾上腺素和葡萄糖浓度可以作为黄斑蓝子鱼急性应激反应的指标。
2.2 在急性浅水应激后黄斑蓝子鱼血清胆固醇和皮质醇水平的变化情况
在急性浅水应激后, 黄斑蓝子鱼的血清胆固醇和皮质醇水平的变化情况见表1。在4min浅水应激后, 血清皮质醇和胆固醇浓度没有发生显著变化(P>0.05)。这说明血清皮质醇和胆固醇浓度不适合作为黄斑蓝子鱼急性应激反应的指标。
2.3 在急性浅水应激后黄斑蓝子鱼脑 HSP70 mRNA水平的变化情况
在急性浅水应激后, 黄斑蓝子鱼脑 HSP70 mRNA的变化情况见图2。在4min浅水应激后, 脑HSP70 mRNA的表达水平逐渐增加, 在应激后60min达到最大值, 约为应激前的11.54倍(P<0.05),然后下降到接近应急前水平。这说明HSP70 mRNA的表达水平也可以作为黄斑蓝子鱼急性应激反应的有效指标。
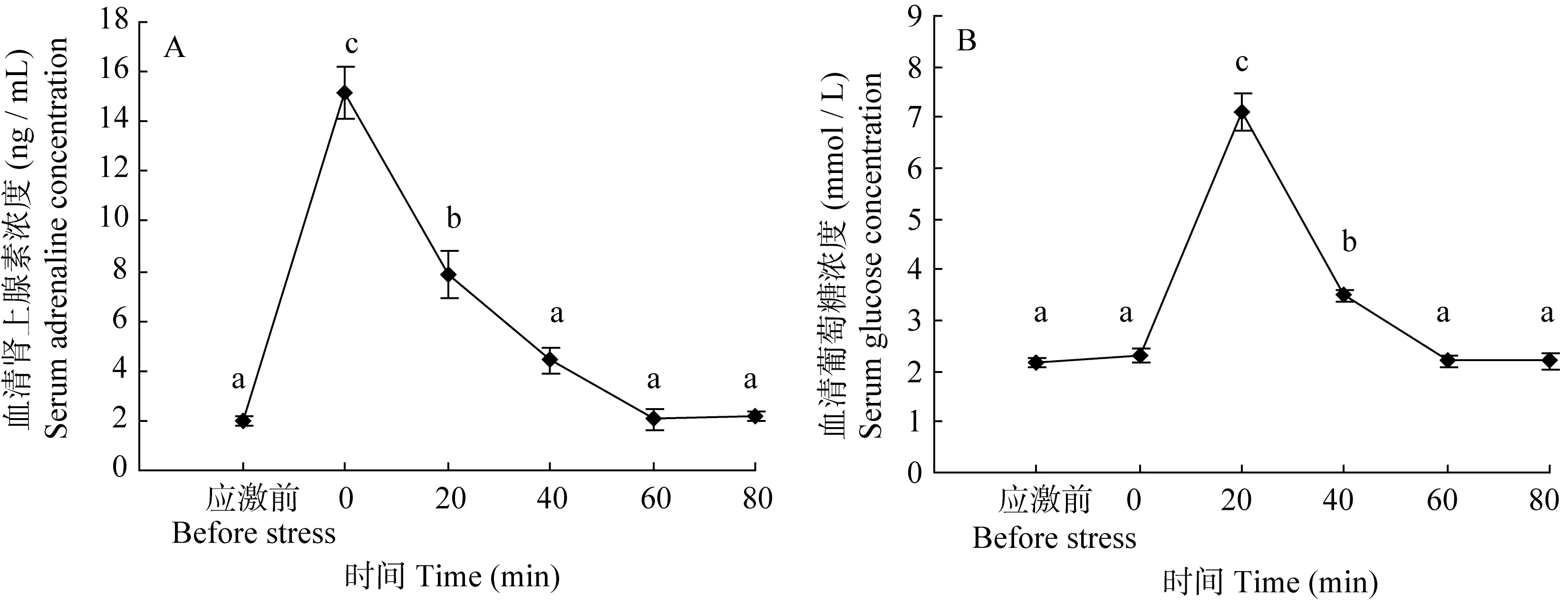
图1 急性浅水应激后黄斑蓝子鱼血清肾上腺素(A)和葡萄糖(B)的变化情况Fig. 1 The changes of serum adrenaline (A) and glucose (B) levels in Siganus canaliculatus post the acute stress
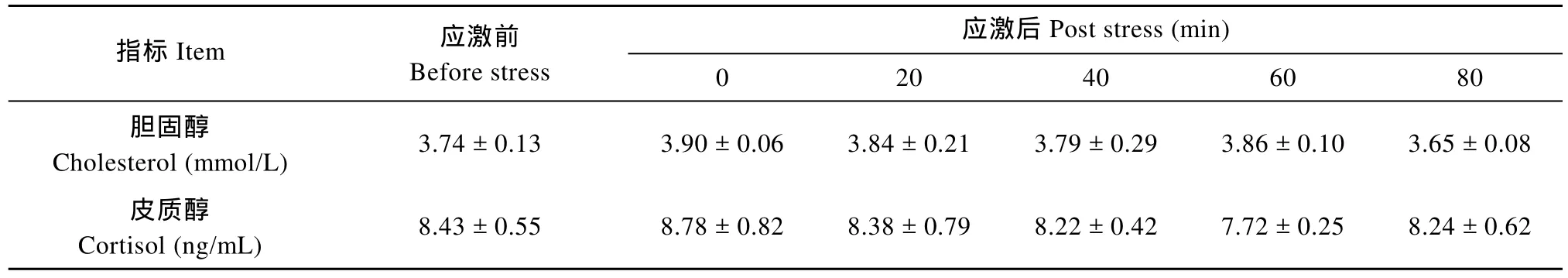
表1 急性浅水应激后黄斑蓝子鱼血清皮质醇和胆固醇的变化情况Tab. 1 The changes of cortisol and cholesterol in serum of Siganus canaliculatus post the acute stress
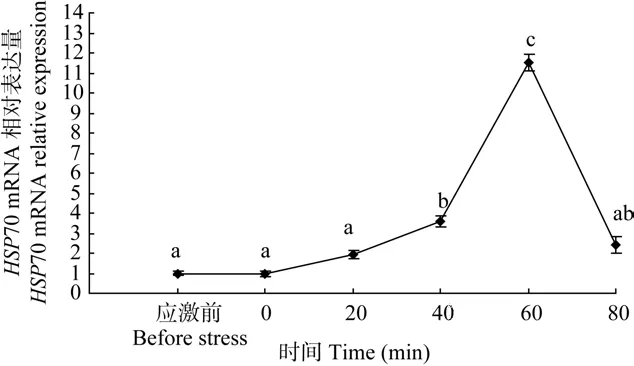
图2 急性浅水应激后黄斑蓝子鱼脑HSP70 mRNA的变化情况Fig. 2 Changes of HSP70 mRNA level in the brain of Siganus canaliculatus post the acute stress
2.4 牛磺酸浸泡对黄斑蓝子鱼急性应激反应的影响
牛磺酸浸泡组与对照组的结果比较见图 3。根据上述结果, 在应激后0、20、60min时, 血清肾上腺素、葡萄糖和脑HSP70 mRNA的水平分别达到最大值且显著高于其他时间点。为此, 本部分分别比较此 3个时间点的血清肾上腺素、葡萄糖和脑HSP70 mRNA水平。结果显示, 牛磺酸浸泡对应激前蓝子鱼的血清肾上腺素、葡萄糖浓度和脑HSP70 mRNA水平没有影响, 但显著降低了急性应激后的上述3个生理生化指标的水平(P<0.05)。这说明牛磺酸浸泡对黄斑蓝子鱼具有明显的抗急性应激效果。
3 讨论
一般认为, 鱼类在应激因子刺激后, 第一阶段出现交感-嗜铬组织系统反应, 表现为血液中肾上腺素浓度升高; 第二阶段(应激刺激几十分钟后)出现下丘脑-垂体-肾间组织轴反应, 表现为血液中皮质醇浓度的升高。在本研究中, 黄斑蓝子鱼受到短暂浅水应激后, 血清肾上腺素浓度立即显著升高,而血清皮质醇浓度没有显著变化, 与之相符。肾上腺素可以作用于中枢神经系统, 提高其兴奋性, 使机体处于警觉状态[20]。这与黄斑蓝子鱼警觉性高、容易受惊的特性相符。血液肾上腺素的变化常发生在捕捞活动中渔具对鱼体的刺激及鱼类在逃逸过程中的生理应激反应中。例如, 裸盖鱼(Anoplopoma fimbria)在被渔具钩住或者在网中拖拽后, 其血液肾上腺素浓度产生明显变化[21]; 大菱鲆在暴露于空气和围网封闭拥挤两种胁迫下, 鱼体都表现出肾上腺素含量升高[22]; 在捕获胁迫中从渔具中逃逸的真鲷的血浆肾上腺素含量显著高于滞留在网具中的鱼[23]; 野生绿背菱鲽(Rhombosolea tapirina)在捕获、装载及运输后, 血液肾上腺素浓度显著升高[24]。此外,其他一些环境因素也会影响鱼体的肾上腺素水平。例如, 把大菱鲆(Scophthalmus maximus L.) 和真鲷(Pagrus major)养殖在一定浓度的氨氮水体中, 其血液肾上腺素含量可以反映出鱼体所受胁迫的程度[25];鱼体血液肾上腺素的含量也会在体外寄生虫等生物因子的作用下发生变化[26]。
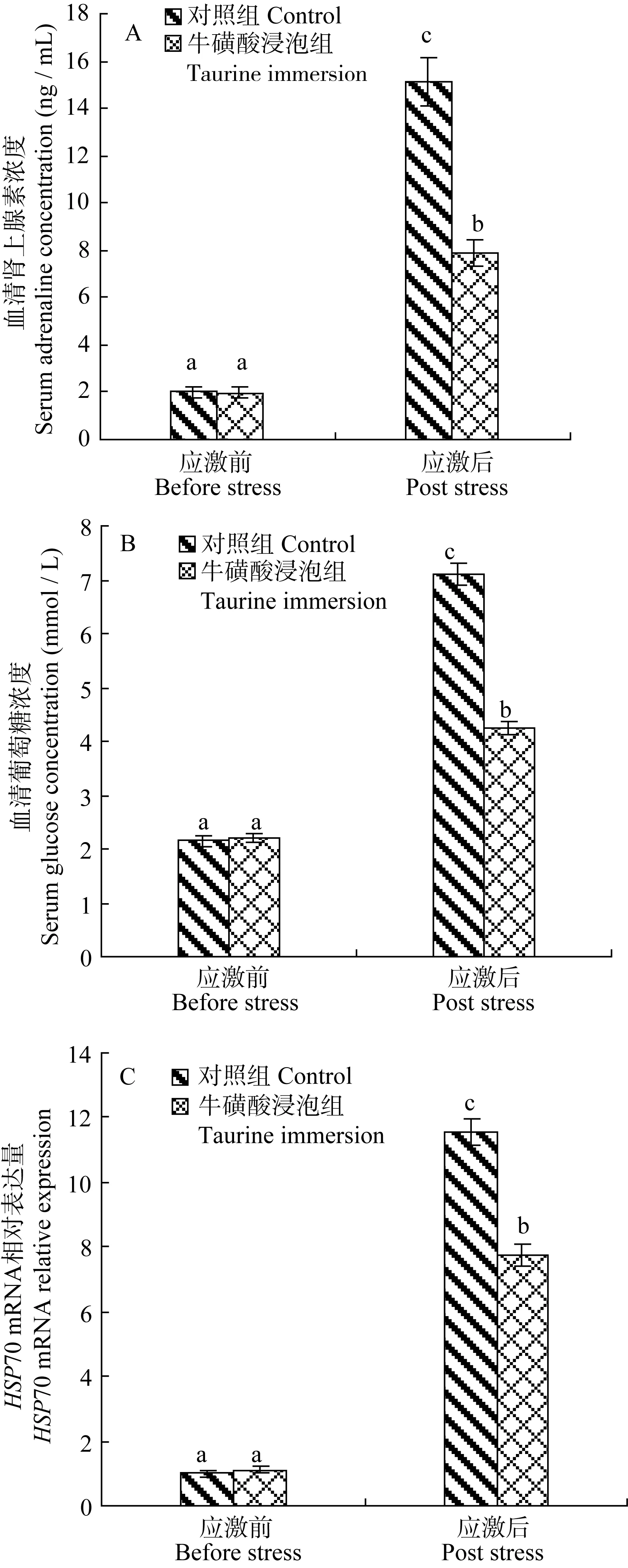
图3 牛磺酸浸泡对急性浅水应激后黄斑蓝子鱼血清肾上腺素(A)、葡萄糖浓度(B)和脑HSP70 mRNA(C)水平变化的影响Fig. 3 Effects of taurine immersion on serum adrenaline(A),glucose(B) and brain HSP70 mRNA(C) levels of Siganus canaliculatus post the acute stress
血液皮质醇水平的升高常被看作是鱼类应激的灵敏信号[27]。在本研究中, 黄斑蓝子鱼血清皮质醇浓度在应激后没有显著变化, 这可能是应激时间(4min)不够长的原因。Haddy[28]也报道捕捞行为等并没有引起布氏棘鲷(Acanthopagrus butcheri)皮质醇浓度的变化。然而, 振荡可以使鲫(Carassius Auratus)的皮质醇浓度在几分钟内显著升高[29]。Fevolden, et al.[30]认为, 应激后血液皮质醇浓度存在差异可能是由鱼自身相关基因决定的。作为皮质醇合成的前体物质, 胆固醇在本研究中也没有发生显著性变化。与此相似, 斑点叉尾(Ictalurus punctatus)受到急性应激后, 其血中胆固醇水平也没有显著变化[31]。
血糖是机体内主要的供能物质, 常态下其含量比较恒定; 随着环境和机体活动的变化, 血糖含量也会发生变化。应激反应是一种耗能过程, 会导致血糖水平的变化, 因此血糖水平常被作为可靠的生理应激指标之一[32]。在本研究中, 随着血清肾上腺素浓度的升高, 血清葡萄糖浓度在应激后20min显著升高到最大值, 之后又随着肾上腺素水平的下降逐渐降低到应激前水平。由于皮质醇浓度没有发生变化, 说明黄斑蓝子鱼急性应激后血清葡萄糖浓度的升高可能主要是通过肾上腺素促进糖原分解实现的。相似的结果在两种珊瑚鳟(Plectropomus leopardus 和 P.maculatus)的生理应激反应中也有报道[33]。
养殖动物应激时会发生一系列的生理变化, 除神经内分泌激素、血糖浓度发生变化外, 与细胞反应相关的热休克蛋白也发生变化。在一定的胁迫范围内, 热休克蛋白常被诱导, 从而形成保护性机制,抵消胁迫对养殖动物的影响[34]。黄斑蓝子鱼受到急性浅水应激后, HSP70 mRNA表达量显著升高, 说明 HSP70对鱼体应激时可能具有保护作用。然而,低温、拥挤和捕捉等胁迫因子并没有显著影响大西洋鲑体内的热休克蛋白水平[35]; 注射操作也不会影响剑尾鱼HSP70变化[36]。黄斑蓝子鱼受到4min浅水应激后HSP70 mRNA水平显著升高, 正好印证了蓝子鱼应激反应强的特点。
在养殖生产中, 药浴、分鱼、运输等操作过程常引起鱼类较强烈的应激反应, 人们通常在操作前通过加入麻醉镇静剂来降低应激反应给鱼体带来的危害[37]。考虑到麻醉剂的安全性及剂量控制等问题[38],本研究选用具有安定镇静、抗惊厥作用等多种生物学功能的牛磺酸作为降低蓝子鱼急性应激反应的物质。结果表明, 牛磺酸浸泡可显著降低黄斑蓝子鱼急性应激后的血清肾上腺素、葡萄糖浓度和脑HSP70 mRNA水平, 说明牛磺酸的抗应激作用明显。这与Kumar, et al.[39]报道牛磺酸浸泡可以降低胡鲶(Clarias batrachus)由镉诱导的氧化应激相似。抗应激剂也可通过添加到饲料中的方式进行应用。例如, 用含 0.1%葡聚糖的饲料投喂虹鳟(Oncorhynchus mykiss)可以降低运输应激带来的危害[40]; 棉子糖的添加能够提高花鲈(Lateolabrax japonicus)抗空气暴露应激能力[41]。牛磺酸添加到饲料中后的抗应激效果有待研究。牛磺酸可通过化学合成的方法大批量生产, 价格约2.5—3万元/吨, 且预期未来不会上涨。目前, 牛磺酸已作为诱食剂和促生长剂普遍应用于鱼类养殖中[42], 考虑到其安全性好且剂量容易控制, 相信其作为抗应激添加剂具有良好的应用前景。
4 总结
应对急性应激, 黄斑蓝子鱼的血清肾上腺素浓度迅速上升, 促进糖原分解, 使血糖浓度升高来满足应激对能量的需求; 同时, 通过诱导细胞热休克蛋白的表达增强对机体的保护。所以, 血清肾上腺素和葡萄糖浓度以及细胞 HSP70 mRNA水平可以作为反映黄斑蓝子鱼应激状况的有效指标。牛磺酸具有一定的抗应激作用。
