莱茵衣藻磷脂二脂酰甘油酰基转移酶3在三酰甘油合成中的功能研究
2014-11-05邓晓东蔡佳佳费小雯
邓晓东 蔡佳佳 费小雯
(1. 中国热带农业科学院热带生物技术研究所, 农业部热带作物生物技术重点开放实验室, 海口 571101;2. 海南医学院理学院, 海口 571101)
随着全球经济飞速发展, 人类对石油等化石燃料的消耗日益增加, 并且使用化石燃料带来了严重环境污染问题, 世界各国都在寻找安全的可再生能源。生物能源可以间接或者直接利用植物或微生物的光合作用, 将太阳能固定为化学能, 是可再生能源的首选。生物柴油和燃料乙醇是目前可以作为汽油添加剂进入市场的生物能源, 其中生物柴油的成分更接近汽油, 并且来源广泛, 是最有可能解决石油危机的可再生能源之一[1]。生物柴油的制备主要是通过三酰甘油(TAG)与甲醇(乙醇)通过酯交换工艺制成。目前生物柴油的原料有餐饮废弃油、动植物油脂和微藻。利用微藻生产生物柴油具有无可比拟的优势, 已成为制备生物柴油的主要途径[2]。
利用微藻来生产生物柴油有很多工艺步骤, 其中优良藻种的选育是关键。最理想的生物柴油生产藻株要求生长迅速、含油量高且脂肪酸组成适宜制备生物柴油。目前的研究工作主要集中在藻种的分离以及微藻大规模培养上。与高等植物相比, 微藻的油脂生物合成的分子机制研究还很薄弱, 关于油脂代谢网络中相关基因功能研究报告更为稀少。莱茵衣藻(Chlamydomonas reinhardtii)是模式单细胞生物, 基因组测序已经完成, 在缺氮条件下油脂可以积累达到胞质的 60%, 是研究油脂代谢基因的理想藻株[2]。
最近研究表明, 植物中从二酰甘油到最终合成三酰甘油存在2条途径[3]。其一, 以酰基辅酶A为酰基供体, 二酰甘油为受体, 由酰基-CoA-二酯酰甘油酰基转移酶催化合成三酰甘油。其二, 在一些植物如向日葵(Helianthus annuus)、拟南芥(Arabidopsis thaliana)和蓖麻(Ricinus communis)以及酵母中以磷脂作为酰基供体, 二酰甘油作为受体, 经磷脂二脂酰甘油酰基转移酶(PDAT)催化合成三酰甘油[4—6]。不同植物中 PDAT的底物特异性不同: 在拟南芥和酵母中, 卵磷脂(Phosphatidylcholine, PC)上的脂酰基被转移到二酰甘油[7]; 在蓖麻种子中, 磷脂上的蓖麻油酸(Ricinoleic acid)则被PDAT整合到三酰甘油中[8]。Stahl, et al.研究发现拟南芥 PDAT基因(At5g13640)与酵母PDAT的同源率为28%。可以利用C10到C22的磷脂作为酰基供体, 并且催化结合到甘油骨架上 sn位上的效率是 sn2位的 3倍。AtPDAT突变体的根部的微粒体(Microsomes)丧失了将磷脂的脂酰基转移到二酰甘油上的能力[9]; 同时他们通过在出芽酵母和裂殖酵母中过量表达 PDAT基因, 结果显示酵母细胞中三酰甘油的含量显著增加。在微藻研究方面, Merchant, et al.预测了莱茵衣藻中存在多个PDAT的同源基因[10]。Boyle, et al.报道了莱茵衣藻中PDAT同源基因PDAT1基因。通过插入突变得到的pdat1-1、pdat1-2细胞中的三酰甘油含量相对于非转基因藻株CC425减少25%。这说明PDAT1在莱茵衣藻的油脂合成中起到重要作用[11]。本研究对在莱茵衣藻 PDAT另一个同源基因CrPDAT3进行研究, 通过RNAi干涉的方法将该基因沉默, 研究其在三酰甘油合成中的功能, 为微藻油脂的遗传改良提供技术支持。
1 材料与方法
1.1 材料
莱茵衣藻CC425购自中国科学院水生生物研究所, 为细胞壁缺失的藻株。藻株被接种在HSM固体培养基上进行继代培养, 而当进行实验时则被接种到HSM液体培养基中, 在恒温摇床上培养, 培养条件为 220 r/min, 温度26℃, 全日光照, 光照强度为110 μmol/(m2×s)。大肠杆菌 DH5a 菌株购置于上海生工生物工程有限公司, RNAi干涉载体pMaa7/XIR由购于 Duke大学莱茵衣藻中心保存的质粒。中间载体T282由本实验室构建。
1.2 莱茵衣藻总RNA的提取及cDNA合成
莱茵衣藻 CC425 在 24℃ 110 μmol/(m2×s)全光照条件下震荡培养, 待生长至对数生长期, 取藻液50 mL, 10000 r/min 离心1min收集藻体, 液氮速冻后碾磨成粉末, 按照Trizol的方法提取总RNA。取1 μL 提取的总 RNA, 加入 9 μL去离子甲酰胺, 70℃变性 10 min, 加 3 μL 6×Loading Buffer, 1×TBE 电泳缓冲液, 1%琼脂糖凝胶电泳, 检测所提取RNA样品的质量。按照 TAKARA公司 cDNA合成说明书将RNA反转录为cDNA[12]。
1.3 CrPDAT3基因干涉片段的克隆
根据 JGI Chlamydomonas database上公布的CrPDAT3部分编码区序列为模板, 设计如下特异性引物, 5¢-ATGTGTGAGGCTGAGGCAGT-3¢, 5¢-TCA GCTGATGACCAGCGGTCG-3¢进行PCR扩增。产物连接到 pMD18-T载体上, 转化大肠杆菌 E.coli DH5α, 挑取单菌落, 提取质粒, 进行酶切分析, 确认有目标插入片段的阳性克隆送上海生工测序, 得到载体pMD-CrPDAT3。
1.4 CrPDAT3 RNAi干涉载体的构建
以HindⅢ和BamHⅡ分别酶切质粒pMDCrP DAT3和中间载体T282, 回收CrPDAT3正向片段与T282连接,连接产物转化大肠杆菌DH5α, 37℃培养12—16h。挑取单菌落提取质粒, 用HindⅢ和BamHⅡ双酶切鉴定重组质粒。继而, 以XbaⅠ和SalⅠ酶切质粒pMDCrPDAT3和CrPDAT3正向片段-T282重组质粒, 回收并连接上述片段, 转化大肠杆菌, XbaⅠ和 SalⅠ双酶切鉴定, 得到含 CrPDAT3正反方向插入的中间载体, 并最终插入表达载体pMaa7IR/XIR中, 得到CrPDAT3 RNA干涉载体pMaa7IR/ CrPDAT3IR。
1.5 莱茵衣藻转化
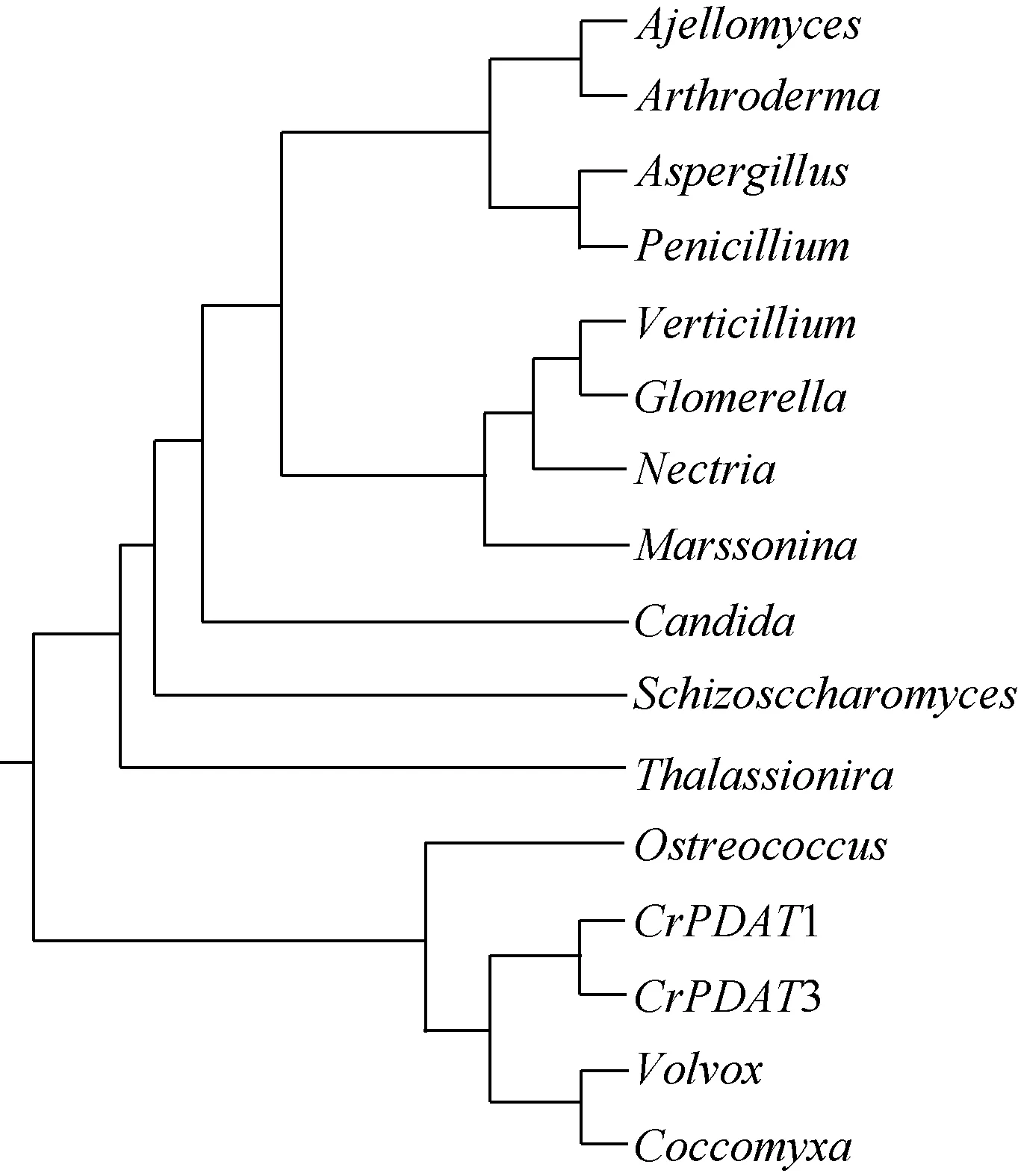
图1 CrPDAT3与其他物种中的同源基因聚类分析结果Fig. 1 Clustering analysis of CrPDAT orthologous genes in C.reinhardtii and other species
采用 Glass Beads方法[13], 将 500 µL藻液、400 mg玻璃珠, 100 μL 20%PEG8000和1 µg干涉载体pMaa7IR/CrPDAT3IR共混, 涡旋振荡器上振荡 20s。藻细胞随后转移至50 mL无菌离心管中, 温育过夜。收集藻细胞, 涂布于TAP固体培养基(1.5 mmol/L L-色氨酸、5 μg/mL paromomycin)上培养(7—8)d。挑取单克隆, 进行生物量、油脂含量和目标基因表达丰度检测。
1.6 油脂含量的测定
中性脂含量的测定采用的是酸水解法[14](国家标准GB_T 5009.6-2003)。取适量藻液置于50 mL带盖离心管中, 加入灭菌蒸馏水, 混匀后小心加入盐酸, 置于 80℃水浴中 25min, 然后向管内加入 95%的乙醇混匀。冷却后加入乙醚, 加盖振摇 1min, 之后开盖放出气体。离心3min(4000 r /min), 将上清液移至恒重的锥形瓶中, 重复洗涤离心管中的残渣,然后将上清液转移至原先的锥形瓶中。将锥形瓶置于水浴上蒸干, 再转移至 100℃烘箱中干燥 2h, 取出冷却后称重。
2 结果
2.1 CrPDAT3基因的聚类分析及干涉片段克隆
本研究涉及的莱茵衣藻磷脂二脂酰甘油酰基转移酶同源基因CrPDAT3 JGI数据库的蛋白ID:186846;Genbank 序列号: XP_001699748。与已报道的CrPDAT1(Genbank序列号 AFB73928)同源率为41.7%。通过与其他物种的 PDAT聚类分析显示:CrPDAT3与微藻的PDAT聚为一类, 与酵母和真菌PDAT的关系较近(图1)。
2.2 CrPDAT3 RNAi干涉载体的构建
RNAi正向和反向片段的获得 以莱茵衣藻总 RNA反转录成的 cDNA为模板, 扩增 CrPDAT3 RNAi干涉片段序列(图2A), 结果可以扩增出一条约250 bp 的条带, 与预计大小一致。经克隆进pMD18-T后, 得到pMD-CrPDAT3。测序结果显示, 所克隆的CrPDAT3基因片段与JGI数据库中CrPDAT3基因序列同源性为100%。通过HindⅢ、BamHⅠ双酶切, 将该 250 bp CrPDAT3基因干涉片段从质粒pMD-CrPDAT3上切下来(图2B), 然后再进行胶回收纯化目的片段, 得到CrPDAT3基因正向片段。同理,通过XbaⅠ和SalⅠ将CrPDAT3基因干涉片段从质粒pMD-CrPDAT3上切下来(图2B), 得到反向片段。

图2 CrPDAT3 RNAi干涉载体构建Fig. 2 The construction of CrPDAT3 RNAi interference vector
CrPDAT3基因正向和反向片段与 T282连接利用HindⅢ和BamHⅡ酶切载体T282, 电泳回收大片段, 将其与CrPDAT3基因正向片段连接, 连接产物转化大肠杆菌 DH5α, 挑取单克隆进行酶切鉴定,结果如(图2C)所示。CrPDAT3基因正向片段连接到T282上后。接下来是在此基础上连接反向片段, 对连接有正向片段的重组质粒进行XbaI和SalI双酶切,电泳回收目的片段, 将其与CrPDAT3基因反向片段连接, 转化大肠杆菌, 挑取单菌落, 利用 EcoRⅠ酶切鉴定(图2D)。得到中间载体T282-CrPDAT3。
反向重复片段插入干涉载体 用 EcoRⅠ对干涉载体pMaa7 IR/XIR和中间载体T282-CrPDAT3进行酶切, 回收目的片段并连接, 连接产物转化大肠杆菌,挑取单克隆, 用EcoRⅠ对重组质粒酶切鉴定(图2E)。构建成功的干涉载体命名为pMaa7 IR/PDAT3IR。
2.3 CrPDAT3 RNAi干涉载体转化莱茵衣藻CC425及转基因藻株检测
各转基因藻株的生物量随着时间的增加而增加,其峰值出现在第5天, 与pMaa7 IR/XIR转基因藻株相比较, pMaa7 IR/PDAT3IR转基因藻株生物量从第3天开始明显减少, 其最大降幅出现在第4天, 分别为46.71%(图3)。这说明对CrPDAT3基因的沉默会造成莱茵衣藻生长减缓。
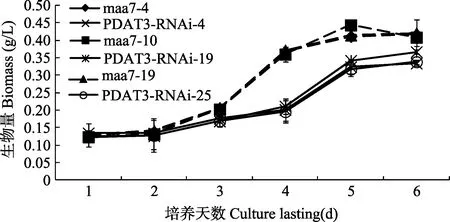
图3 CrPDAT3 RNAi干涉载体转基因藻株连续培养6d其生物量的变化Fig. 3 The biomass of CrPDAT3 RNAi transgenic C. reinhardtii after 6 days cultivation
CrPDAT3 RNAi干涉载体转基因藻株油脂含量的检测显示(图4): 相对于对照pMaa7 IR/XIR转基因藻株, CrPDAT3 RNAi干涉载体转基因藻株油脂含量显著下降, 降幅范围为 14.65%—45.15%, 说明CrPDAT3对油脂合成起到重要的作用。显微镜检结果也显示(图5): CrPDAT3 RNAi干涉载体转基因藻株油脂含量下降。

图4 CrPDAT3 RNAi干涉载体转基因藻株油脂含量的变化Fig. 4 Lipid content detected through Nile Red staining method in CrPDAT3 RNAi transgenic C. reinhardtii
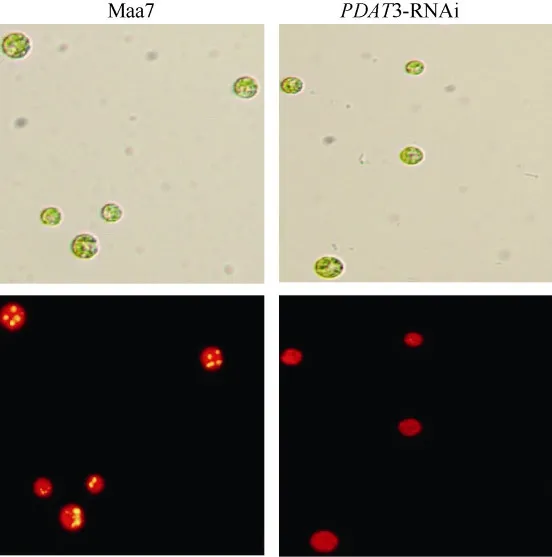
图 5 CrPDAT3 RNAi干涉载体转基因藻株在培养至第4天的显微观察结果(×250倍)Fig. 5 Microscopic observations of CrPDAT3 RNAi transgenic C.reinhardtii after 4 days of cultivation in HSM medium, more oil droplets of CrPDAT3 RNAi transgenic algae had been found
为了检测CrPDAT3 RNAi干涉载体干涉载体对目标基因的沉默效果, 本实验采用Realtime PCR方法检测培养至第4天的转基因藻株中CrPDAT3基因的丰度[15](图6)。CrPDAT3 RNAi干涉载体转基因藻株 CrPDAT3基因 mRNA丰度与对照 CC425和pMaa7 IR/XIR转基因藻株比较, 丰度下降, 降幅为71.28%—97.92%, 说明CrPDAT3基因被有效沉默。
3 讨论

图6 CrPDAT3 RNAi干涉载体转基因藻株CrPDAT3 mRNA丰度Fig. 6 Comparison of the mRNA abundance of CrPDAT3 in transgenic C. reinhardtii
微藻三酰甘油的合成途径相关基因及其同源基因的功能是近期研究的热点。目前, 已经报道的有二酰甘油酰基转移酶(DGAT)[16],磷脂酸磷酸酶(PAP)[17]等。它们在微藻油脂合成中起着重要的作用。磷脂二脂酰甘油酰基转移酶(PDAT)以磷脂作为酰基供体, 二酰甘油作为受体, 催化形成三酰甘油。与二脂酰甘油酰基转移酶酶(DGAT)一样, 在莱茵衣藻油脂合成中发挥重要作用。本研究通过对莱茵衣藻CrPDAT3基因的沉默, 检测到转基因藻株中油脂含量的降低, 说明对莱茵衣藻磷脂二脂酰甘油酰基转移酶同源基因CrPDAT3的表达量的改变, 影响了藻细胞油脂的积累, 从而推断该基因在莱茵衣藻三酰甘油的代谢中发挥重要的作用。Boyle, et al.利用插入突变技术, 筛选得到CrPDAT1基因缺陷的突变体[11]。对突变藻株油脂含量检查显示: 相对于对照油脂含量减少 25%。本研究通过 RNAi的方法, 对莱茵衣藻CrPDAT3进行沉默。我们分析3个knock down的转基因藻株, 得到了转基因藻株中油脂含量降低 14.65%—45.15%的结果。这说明 PDAT1 和PDAT3 基因在油脂合成中均发挥作用。目前, 在莱茵衣藻JGI数据库中标注的有CrPDAT1、CrPDAT2、CrPDAT3三个同源基因。而同源基因是否都在油脂代谢中发挥功能, 需要实验加以证明。今后我们将克隆全长CrPDAT3基因, 进一步确认该基因的重要功能, 为该基因在微藻油脂改良、转基因良种培育实践应用中打下基础。
