高CO2和UVR对叉节藻和刚毛藻生长及光化学效率的影响
2014-11-05苏海虹关万春
李 平 苏海虹 关万春
(1. 汕头大学海洋生物研究所, 汕头 515063; 2. 温州医科大学生命科学学院海洋科学系, 温州 325035)
海洋为我们提供了丰富的生物资源, 通过生物泵从大气中吸收了大量二氧化碳, 从而减缓了温室效应。但是随着现代化石燃料的大量使用, 大气中二氧化碳总量不断增加。已有数据显示, 高浓度的二氧化碳不断溶入海水中, 最终将导致表层海水的pH下降, 改变海水化学性质, 引起海水酸化[1,2], 改变海水碳酸盐系统, pCO2、H+和浓度增加,浓度下降。海水中不同类型无机碳(CO2、、)浓度的比例及总溶解无机碳浓度发生变化, 从而造成CaCO3的饱和度下降, 进而影响海洋生态系统。2005年, 詹姆斯·内休斯描绘出“海洋酸化”潜在的威胁, 他通过研究发现, 距今5500万年前, 海洋里曾经出现过一次生物灭绝事件。罪魁祸首就是溶解到海水中的CO2, 估计总量达到45000亿吨, 此后海洋至少用了约10万年时间才恢复正常得以度过难关[2]。现有的大量科学证据表明, 人类现在一年中产生释放的碳量约为71亿吨, 其中25%— 30% (约20亿吨)被海洋吸收, 33亿吨在大气中积累。据政府间气候变化专门委员会(IPCC) 预测, 到2100年, 海水pH平均值将因此下降约0.3—0.4, 至7.9或7.8。到那时, 海水酸度将比工业革命开始时约大100%—150%[3]。
CO2浓度变化对藻体生长的影响表现出极大的种间差异性。Gao, et al.报道CO2浓度升高可以促进红藻条斑紫菜(Porphyra yezoensis)和红藻江蓠(Gracilaria chilensis)的生长[4,5], 但是对绿藻石莼(Ulva lactuca)的生长则没有影响[6,7]。Mercado, et al.的研究也表明 CO2浓度升高抑制了红藻紫菜属(P.leucostica和P. linearis)的生长[8]。而最新的研究结果表明 CO2浓度升高还对珊瑚藻类(Corallina sessilis)的生长产生抑制[9]。高 CO2浓度还可以降低江蓠属(Gracilaria sp.)和细基江蓠(G. tenuistipitata)叶绿素a和藻胆蛋白的含量[10]。不仅如此, Mercado, et al.还报道了CO2浓度升高引起紫菜(P. leucostica)叶绿素a、藻胆蛋白含量下降以及二者比值的增加[11]。而全球环境变化的另一个因素: 阳光紫外辐射的增强, 同样可以影响藻体的生长和光合生理过程, 如UVR使龙须菜(G. lemaneiformis)的相对生长速率从4.3 %/d降低为 2.7 %/d[12], 并且降低了无柄珊瑚藻(C. sessilis)光化学效率[11]。诸多研究表明, 高 CO2和UVR对藻类确有影响。为了更进一步了解其影响,本实验选择了具钙化功能的叉节藻(Amphiroa sp.)和不具钙化功能的刚毛藻(Cladophora sp.)为研究对象,探讨高 CO2对其生长和光化学效率的影响, 并分析高CO2和UVR的耦合效应。
1 材料与方法
1.1 实验材料
叉节藻和刚毛藻于2011年9月份采集于浙江省温州市洞头养殖区鱼排周边。将采集的藻体用海水洗净, 去除附在表面的杂藻与沙蚕、勾虾等动物。每种藻体各取等量的两份, 置于体积为 4 L的玻璃培养器中, 标为 LC和 HC, 采用过滤海水, 在温度为 25℃, 光强为 70 μmol/(m2·s), 光周期为 12L︰12D, 通气量为36 L/h条件下室内培养。实验结束时,从培养器中取出藻体, 用吸水纸吸干表面水分, 称量鲜重(FW, fresh weight), n=3。
1.2 酸化调节
正常空气: CO2浓度约为380 µmol/mol (0.65 mg/m3),水体 pH 约为 8.2; 高 CO2水平: CO2浓度约为1000 µmol/mol(1.80 mg/m3), 水体 pH 约为 7.8。将每种藻分成两组, 一组标为LC(即Low Carbon), 直接用气泵抽取室外的空气即可。另一组标为 HC(即High Carbon), 将40 L的气囊充满纯CO2, 然后控制放气量为4 L/h, 每隔4h放一次气, 再用气泵抽取室内的空气。经监测发现, 培养液pH为7.8—7.9, 推算此时室内 CO2浓度约为 1000 µmol/mol (1.80 mg/m3)。采用PHS-25CW pH计(上海产)每天8:00、12:00和20:00检测水体pH。
1.3 紫外辐射光源以及紫外辐射处理
太阳辐射的监测采用太阳辐射模拟器(德国产)。该光谱辐射仪可监测UVR (280—400 nm) 波段的辐射强度与辐射量。可见光辐射通量为150 W/m2,紫外线辐射通量为39 W/m2。
于2011年12月1日, 将培养了73d的藻体分别分装于石英管(直径59 mm , 长度350 mm)中, 置于流水水槽, 温度控制在25℃, 水面距藻体的深度为3 cm。通过使用紫外滤膜使藻细胞接受不同的太阳辐射处理: (1) PAR+UVA+UVB (PAB处理, 295—700 nm) , 石英管Ultraphan Film 295 (德国产) 包裹;(2) PAR (P处理, 395—700 nm) , 石英管用Ultraphan Film 395 (德国产) 包裹。将藻体置于太阳辐射模拟器下, 持续照射60min 后, 立即测定藻体的光化学效率, 太阳辐射模拟器辐射强度为: 可见光(PAR)为150 W/m2, 紫外辐射A(UV-A)为37 W/m2: , 紫外辐射B(UV-B)为1.2 W/m2。
1.4 光化学效率的测定及UVR抑制率的计算
采用调制叶绿素荧光成像系统M系列Imaging-PAM(德国产)测定光化学效率的变化。
有效光化学效率(Effective quantum yield) Yield(Y′)= Fv′/ Fm′, 其中Fm′: 在光适应状态下的最大荧光值; Fv′: 任意光适应状态下的最大可变荧光值。Fv′ =Fm′–Ft, 其中Ft: 适光状态下的初始荧光值。UVR 的抑制率(%) = 100 ×(PPAR–PPAB) / PPAR, 其中PPAR: 可见光(P)条件下的有效光化学效率; PPAB: PAB 处理条件下的有效光化学效率。
1.5 高CO2(海水酸化)对紫外辐射抑制率的调节率
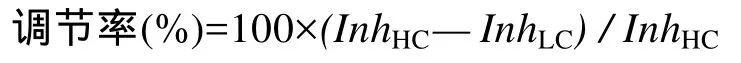
InhLC: 非酸化(LC)紫外辐射抑制率; InhHC: 酸化(HC)紫外辐射抑制率
1.6 统计分析
采用One-way ANOVA对实验结果进行统计分析, 显著水平设为P<0.5。
2 结果
从2011年9月9日至2011年11月29日, 藻体持续在空调控温的温室内培养。在73d的培养过程中, 温度基本可以维持在25℃左右。依据pH调控方法的描述, 对藻体进行培养, 并检测培养液pH。结果发现,LC条件下叉节藻培养的pHLC约为8.0左右, HC条件下(pHHC)约为7.7左右(图 1A), △pHLC-HC基本保持在0.1—0.4波动(图 1B); 而刚毛藻LC条件下的培养液pHLC为8.2左右, pHHC为7.9左右(图1C), △pHLC-HC基本保持在0.2—0.5波动(图 1D)。两种藻培养液中pH的差异, 体现了种间差异。
经高CO2培养73d后, 两种藻的响应出现了显著差异。高浓度CO2(1000 µmol/mol)抑制了叉节藻的生长, 与通空气培养的藻体相比(鲜重增加了4.06%),其鲜重下降了40.01%。但高浓度CO2对刚毛藻是有利的, 其鲜重增加了40.08%, 增长率是通入正常空气培养的1.8倍(正常条件下鲜重增加了22.25%)(图2)。
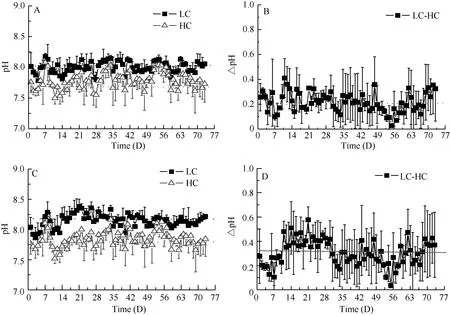
图 1 叉节藻 (A) 和刚毛藻(C)培养液pH变化图; 叉节藻 (B)和刚毛藻(D)HC和LC培养液的△pHFig. 1 The pH change of culture medium with Amphiroa sp. (A) and Cladophora sp.(C); △pH difference of culture medium with Amphiroa sp. (B) and Cladophora sp. (D) between HC and LC
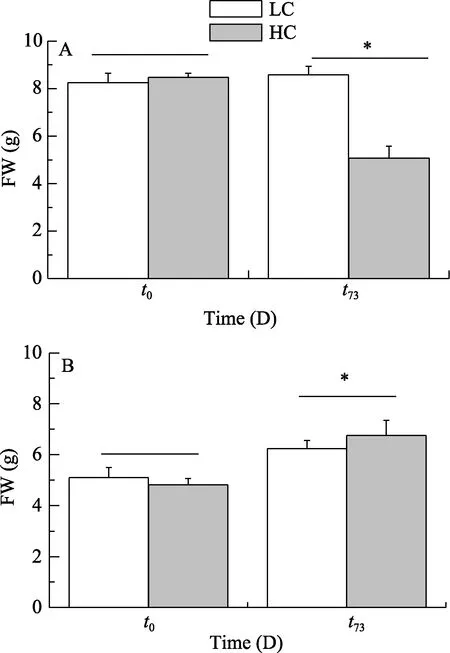
图 2 不同CO2浓度培养73d后叉节藻(A)和刚毛藻(B)鲜重Fig. 2 The fresh weight of Amphiroa sp. (A) and Cladophora sp.(B) at different CO2 concentrations for a 73-day culture
经调制叶绿素荧光成像系统检测, 在可见光(PAR)照射条件下照射 1h, 高 CO2对藻体有效光化学效率的影响不显著, 即HC和LC之间没有明显差异(P>0.05), 且不存在种间差异(图 3)。然而当藻体接受紫外辐射处理后(PAB), HC对两种藻体的影响出现了明显的差异, 具有钙化能力的叉节藻对紫外辐射敏感性显著增加(P<0.05), 其有效光化学效率(0.169)比LC的低了42.56%(图3E), 且UVR 对HC条件下叉节藻的抑制率为51.76%, 是LC条件下的4.5倍(正常空气水平下为11.51%)。然而高浓度CO2培养的刚毛藻, 其有效光化学效率并没有受到影响,与LC之间没有显著差异(图3F), 且HC和LC之间的紫外辐射抑制率约相差不大(图4A), 约为25%左右。
因此, 针对具有钙化能力的叉节藻来说, 海水酸化加剧了藻体对紫外辐射的敏感性, 紫外辐射的抑制率增加了 77.76%, 然而刚毛藻仅仅增加了17.02%(图 4B)。
3 讨论
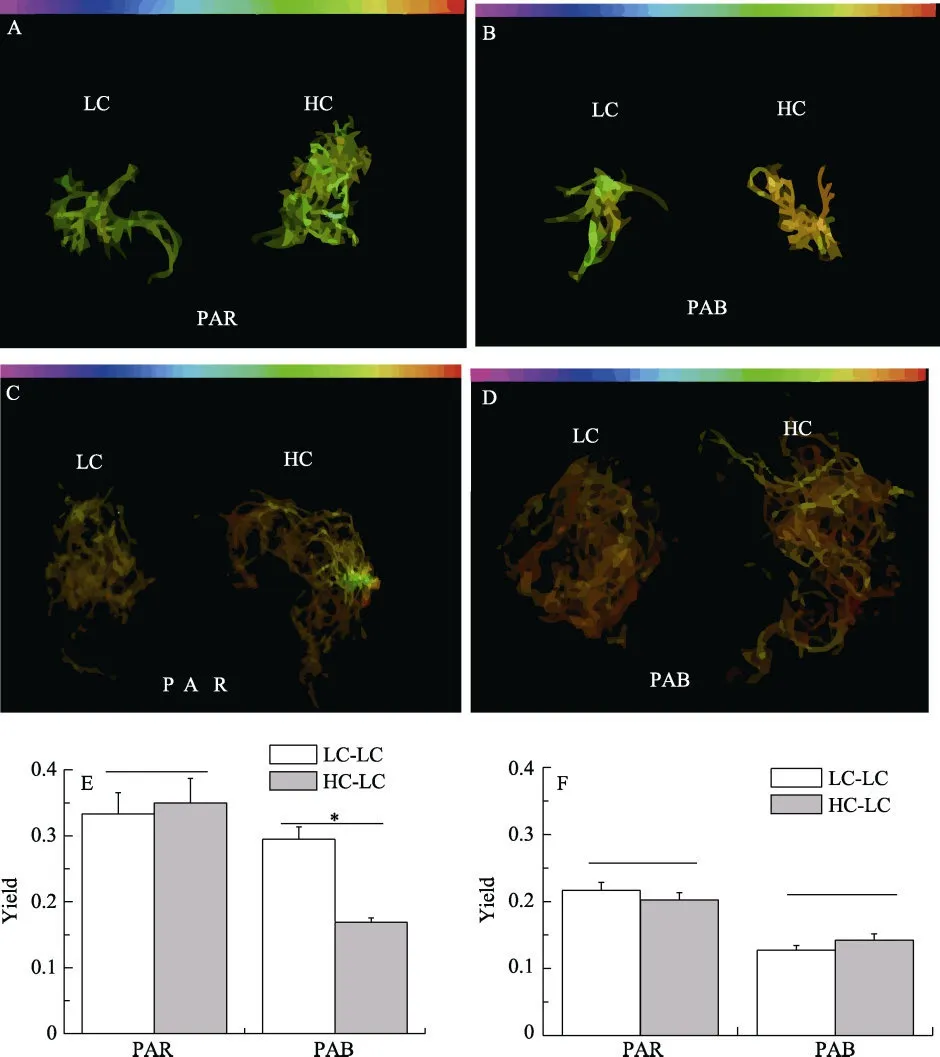
图3 为了探讨不同藻体对不同光辐射处理(60min)的响应, 在 P(395—700 nm)和 PAB(295—700 nm)辐射处理下的光化学效率Fig. 3 The experiment investigated the different response of solar UVR. The effective quantum yield, exposed to solar radiation for 60min under P (395—700 nm) and PAB (295—700 nm) treatments
大量的研究结果表明, 大气 CO2浓度升高会对海洋生物的钙化过程产生一定的影响[12—19]。这是因为海水 pH的变化会改变水体中 CaCO3的饱和度,进而影响钙化生物, 如已有报道指出由 CO2浓度升高导致的浓度降低会使钙化藻类的钙化速率降低, 从而抑制生长[20]。本实验选择的叉节藻为具有钙化功能的红藻, 当海水pH由8.2下降到7.8左右,藻体的生长明显下降了40.01%, 这是因为在酸化的条件下, 藻体通过钙化过程形成的碳酸钙结构加速溶解, 而藻体为了保证自身的正常生长和生理代谢活动, 从而将体内能量重新分配, 以牺牲生长来保证藻体的钙化程度(图2)。有最新的研究也表明CO2浓度升高对珊瑚藻类(C. sessilis)的生长产生抑制[9]。但不具有钙化能力的刚毛藻(绿藻), 当处于pH为7.8的酸化环境时, 由于水体中CO2分压(pCO2)增加542 µmol/mol[21]),藻体光合作用可利用的碳源增加2.19倍, 从而节省了藻体利用水体中 HCO3-时所消耗的ATP, 因此, 与非酸化培养的藻体相比较, 酸化使得刚毛藻的生长提高了40.08%。Hein,et al.[22]的研究结果也表明,当大气中CO2浓度升高到855 µmol/mol时, 水体CO2分压为463 µmol/mol, 海洋初级生产力可相应提高大约15%左右。正常海水中溶解的CO2浓度仅占总DIC的1%[23], 大约为(5—25) μmol/L, 该浓度低于细胞内Rubisco酶对底物CO2的Km(20—70 μmol/L)[24]。所以, 当绿藻在酸化条件下生长时, 水体中可利用CO2浓度可达到40 μmol/L(pH=7.8), 因此生长增加。而对于具有钙化功能的珊瑚藻来说, 虽然酸化条件下其光合底物CO2也增加了, 光合作用加快, 但由于其钙化程度受到酸化的影响(钙质随着水体碳酸钙饱和度的下降而溶解), 受到胁迫作用,因此, 将胞内能量重新分配,以牺牲生长来维持自身的正常生理活动。
在较强的可见光条件下(辐射通量为150 W/m2),两种藻体的光化学效率都受到明显抑制作用, 这是因为两种藻在室内 14 W/m2[70 μmol/(m2·s)]光强条件下培养 73d, 适应了低光环境, 因此当转移到高光强下(辐射通量为 150 W/m2), 强光导致藻体产生活性氧, 对细胞类囊体膜和光系统造成损伤[25], 从而叉节藻光化学效率分别下降 28.9%(LC), 29.4%(HC)(图3E); 刚毛藻则下降29.77%(LC), 33.57%(HC)(图3F), 表现为抑制。当藻体同时接受可见光和UVR(280—400 nm)后, 光化学效率进一步损伤加剧, 抑制更加明显, 前者分别为43.5%(LC), 29.5%(HC)(图4E), 后者分别为35.77%(LC), 33.57%(HC)(图3F)。这是因为UVR可以造成光系统II(PS II)中的D1蛋白失活, 因为它在300 nm处有明显的吸收峰而很容易受UVR的影响。所以UVR如果对活性位点中氨基酸残基、芳香族氨基酸或二硫键造成损伤, 就会引起蛋白质或酶的失活[26], 从而加剧了光系统 II(PSII) D1蛋白损伤程度, 光化学效率下降。
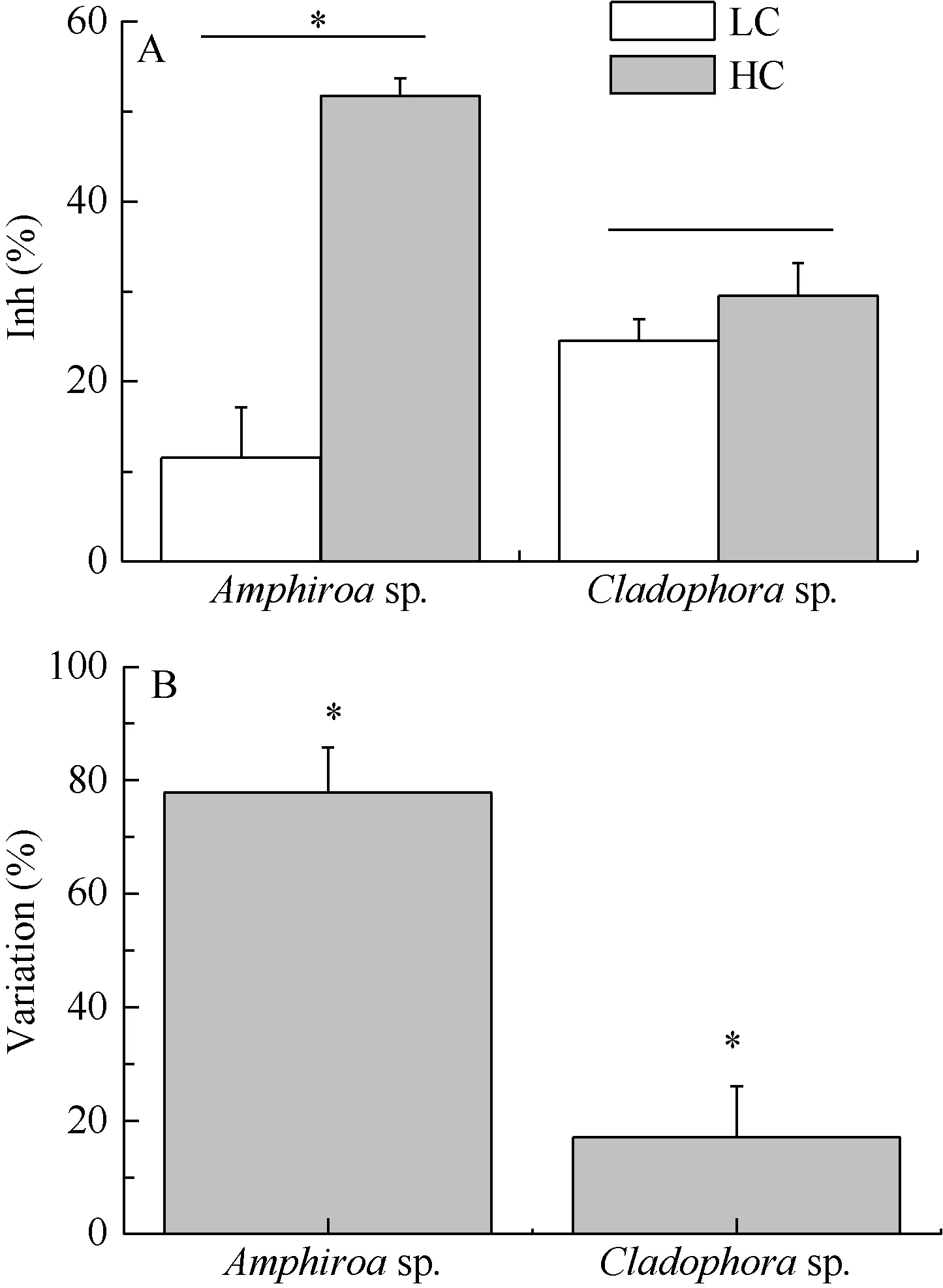
图4 叉节藻和刚毛藻的紫外辐射抑制率(A)及海水酸化对紫外辐射抑制率的调节率(B)Fig. 4 The inhibition of Amphiroa sp. and Cladophora sp. (A) and the variation of ocean acidification to the inhibition of UVR(B)
经酸化培养 73d后, 与非酸化培养的藻体进行对比, 叉节藻和刚毛藻对UVR的敏感性都增加, 前者升高了77.76%, 而后者升高了17.02%(图4B)。这说明海水酸化加剧了紫外辐射对藻体的负面效应。随着海水酸化越来越严重, 叉节藻的钙化程度也越来越低, 其光合作用受到 UVR的影响也越来越明显。这是因为UVR可以对光系统、酶和DNA等造成损伤, 为了修复这些损伤, 藻体需要更多的能量,而这就导致了生长速率的降低。钙化作用的发生一般认为依赖于光合作用提供的能量。高CO2浓度使得海水中CaCO3饱和度降低, UVR则可以对光系统造成损伤, 在二者的耦合作用下藻体的钙化受到较大的抑制[11], 碳酸钙减少, 相当于藻体的保护层减少, 因此受到的损伤加大; 而刚毛藻不具钙化作用,无碳酸钙, 受到的损伤也加剧。但两种藻体的调节率不同, 这体现了藻体对海水酸化和UVR响应的种间差异性。
