白及多糖体外抗肿瘤实验研究
2014-11-04罗仕华郑传胜黎维勇卫乐乐夏向文周国锋冯敢生
罗仕华,郑传胜*,黎维勇,卫乐乐,王 勇,夏向文,周国锋,冯敢生
(1.华中科技大学同济医学院附属协和医院放射科,湖北武汉 430022;2.华中科技大学同济医学院附属协和医院药剂科,湖北武汉 430022)
白及作为传统中药可以用来治疗消化道黏膜损伤、溃疡、出血、挫伤和烧伤,因而在东亚国家广泛使用。白及多糖主要成分为由4分子甘露糖和1分子葡萄糖组成的葡配甘露糖[1],属高分子化合物,在水中溶解时受分子间氢键作用的影响,易形成亲水性凝胶[2],白及多糖的这一特性使其在临床上有很好的治疗作用。本课题组自上世纪以来对祖国传统中药白及进行了系列的研究,证实白及提取物可作为各种血管栓塞剂的优良载体,制作的白及微球及载药微球还能通过抑制肿瘤新生血管生成及侧支循环的建立发挥抗肿瘤作用[3]。有文献报道白及具有一定直接抗肿瘤作用并应用于抗肿瘤研究[4],但白及多糖对肿瘤细胞的具体作用未见报道,其作用机制尚不明确。本实验随机选取人胃癌细胞 (sgc)、人卵巢癌细胞 (A2780)、肝癌细胞(HepG2),通过MTT法观察和检测纯化的白及多糖对这3种肿瘤细胞生长的影响,并采用流式细胞仪检测肿瘤细胞的细胞周期变化,旨在探讨白及多糖对肿瘤细胞生长的作用,为研究其抗肿瘤作用提供分子生物学方面的实验依据。
1 材料与仪器
1.1 材料 Sgc、A2780、HepG2由华中科技大学同济医学院附属协和医院介入放射科熊付博士惠赠;白及茎块购于湖北省医药公司,经华中科技大学同济医学院附属协和医院中药室鉴定,符合2010年版《中国药典》的相关要求。三氯甲烷、正丁醇、无水乙二胺、环氧氯丙烷、液体石蜡、司盘85、吐温80、异丙醇、丙酮、石油醚 (国药集团化学试剂有限公司武汉分公司,分析纯),DEAE-纤维素 (DE-52)100和Sephadex G-100(美国Whatman公司),T-系列标准多糖 (美国Pharmacia公司),考马斯亮蓝 G-250为(美 国 Sigma 公 司);DMEM/HIGH GLUCOSE(SH30022.01B,美国Hyclone公司),1640培养基 (美国Hyclone公司),改良型RPMI-1640培养基 (SH30809.01B,美国Hyclone公司),胎牛血清 (110311,杭州四季青公司),胰酶 (0458,美国Amresco公司),双抗 (武汉谷歌生物公司),D'hanks(1009,武汉谷歌生物公司),MTT(Ns8180,北京索莱宝公司)和DMSO(0231,索北京莱宝公司)。核糖核酸酶RNase A(g2-R8021,武汉谷歌生物科技有限公司),碘化丙啶PI染液 (g4-pi10,武汉谷歌生物科技有限公司)。
1.2 仪器 HH-4型恒温水浴锅 (江苏金坛市宏华仪器厂),RE-52型减压旋转蒸发仪 (上海亚荣生化仪器厂),DZF-6021型真空干燥箱 (上海精密实验设备有限公司),LGJ冷冻干燥机 (北京四环科学仪器厂),AUW220D电子天平 (日本岛津公司),离心机 (北京医用离心机厂);CO2恒温培养箱 (MCO-15AC,日本SANYO公司),洁净工作台 (SW-CJ-1FD,苏净安泰),生物倒置显微镜(XDS-18,重庆水电仪器总公司),倒置荧光显微镜(TE2000,日本Nikon公司),酶标检测仪 (Rt2100c,美国Rayto),离心机 (TD2SO-2H,上海飞鸽),不锈钢灭菌锅(DSX-280A,上海申安医疗设备),照相机 (fe5010,日本奥林巴斯),流式细胞仪 (BD,FACsort,美国 Becton-Dicknson公司)。
2 方法
2.1 白及多糖提取 白及茎块加20倍体积蒸馏水,60℃回流提取4 h,重复提取1次,合并2次提取液,过滤,离心 (5000×g,10 min),取上清液,加入相同体积石油醚,振荡,取下层提取液,再加入2%活性碳,调节pH至3.5,40℃水浴30 min,过滤除去残渣,70℃减压浓缩至较小体积,加3倍体积无水乙醇沉淀,离心 (5000×g,10 min),取沉淀,溶于最小体积蒸馏水中,Savage法脱蛋白至无中间层析出为止,离心 (5000×g,10 min),取上层清液。采用考马斯亮蓝G-250法检测至无蛋白质被测出。所得溶液对流水透析3 d,蒸馏水透析2 d,真空冷冻干燥。冷冻干燥后的白及多糖溶于蒸馏水,配成1%溶液,在阴离子交换纤维素DE-52柱上层析。先以多于一个柱体积的蒸馏水洗脱,而后分别用0.05、0.1、0.5 mol/L NaCl各500 mL进行阶段性洗脱,用自动收集器每管10 mL收集,体积流量为2 mL/min,蒽酮-硫酸法检测,得到一水洗组分,收集该组分,对流水透析,冷冻干燥。冷冻干燥后的白及多糖溶于蒸馏水中,离心 (5000×g,10 min),取上清,上Sephadex G-100柱,以0.02 mol/L NaCl洗脱,体积流量0.5 mL/min,3 mL收1管,蒽酮-硫酸法检测,得一多糖洗脱峰,收集该洗脱峰,对流水透析,冷冻干燥得纯化白及多糖,计算多糖平均得率 [(纯化白及多糖质量/样品总质量)×100%]。
2.2 肿瘤细胞培养 Sgc采用1640培养基,A2780和HepG2采用DMEM高糖培养基,在5%CO2、37℃细胞培养箱培养,细胞呈贴壁生长,用0.25%的胰酶消化传代,用于实验的细胞均处于对数生长期。
2.3 白及多糖对肿瘤细胞的生长抑制作用 将对数生长期的肿瘤细胞用胰蛋白酶消化后配制成密度为1×104个/mL的细胞悬液,按10000细胞/孔接种于96孔板,每孔加200 μL。然后将平板置37℃、5%CO2湿度培养箱中24 h后,于24、48、72 h分别加入各个细胞样品对应的白及多糖(50、100、200、400 μg/mL)的培养基,每个样本质量浓度设定平行的3个孔,对照组加不含白及多糖的培养液200 μL,再放入培养箱中孵育。每孔加入用按5 mg/mL新鲜配制的MTT溶液50 μL,孵育4 h,使MTT还原为甲瓒,当在倒置显微镜下看到孔板内的细胞周围出现丝状紫色结晶体时去除上清液,每孔加二甲基亚砜200 μL,当平板摇床摇匀后,再使用酶标仪测定光密度值 (检测波长570 nm),以溶剂对照处理细胞为对照组,按公式计算白及多糖对细胞的抑制率。抑制率 =(1-实验组/空白组)×100%。
2.4 肿瘤细胞周期分布 收集作用到72 h,白及多糖处理质量浓度为200 μg/mL的肿瘤细胞,每种细胞设为2组,即空白对照组与实验组,用70%乙醇4℃固定过夜,PBS洗两遍,加入100 μg/mL RNA酶,37℃消化30 min,酶切RNA;加50 μg/mL碘化丙啶,避光4℃染色30 min后,用流式细胞仪检测,计算出肿瘤细胞周期分布。
3 数据处理
4 结果
4.1 白及多糖对3种肿瘤细胞增殖抑制作用 提取的白及多糖为乳白色无嗅无味粉末,常温下微溶于水,溶于热水,不溶于有机溶剂,其水溶液几乎为无色透明状。DE-52柱层析得到一水洗脱多糖组成成分,再经Sephadex G-100柱层析均呈单一的对称峰,表明样品为均一组成成分,白及多糖的平均得率为 (1.9±0.2)%。白及多糖对3种肿瘤细胞的增殖抑制率具有时间及剂量依赖性,不同质量浓度的白及多糖与肿瘤细胞一起培养后,白及多糖对3种肿瘤细胞的生长均有抑制 (图1~3)。随着与白及多糖培养时间的延长,白及多糖质量浓度的增高,对肿瘤细胞的抑制率越高,但白及多糖质量浓度过高时,抑制率并不能继续增高。经计算,72 h后白及多糖对 sgc、A2780、HepG2的IC50分别为:26.5 μg/mL、65.7 μg/mL、3.7 ×1012μg/mL,由此可知,在3种肿瘤细胞中,白及多糖对sgc的抑制作用最强,对HepG2的抑制作用较小。

图1 白及多糖对胃癌细胞抑制率曲线
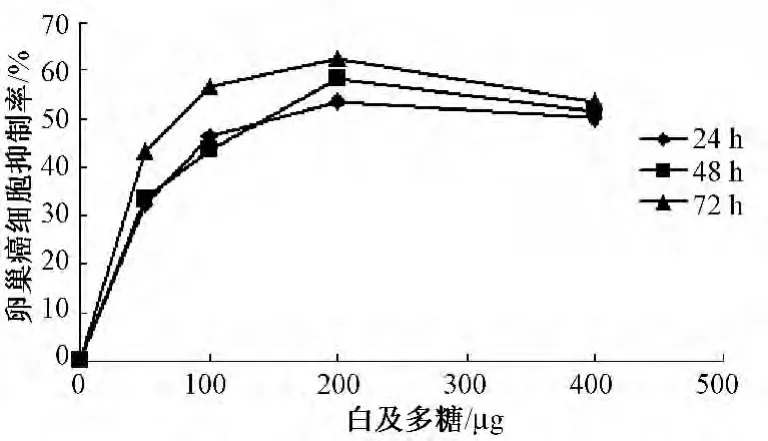
图2 白及多糖对卵巢癌细胞抑制率曲线
4.2 白及多糖对3种肿瘤细胞周期分布的影响 流式细胞检测显示白及多糖培养sgc后,G0/G1期细胞增多,S期细胞无明显变化,G2/M期细胞减少;白及多糖培养A2780后,S期细胞增多,G2/M期细胞减少,G0/G1期细胞无明显变化;白及多糖培养HepG2后,G0/G1期细胞增多,S期细胞无明显变化,G2/M期细胞减少 (见表1)。由此可知,白及多糖将sgc细胞和HepG2细胞阻滞在G0/G1期,将A2780细胞阻滞在S期。
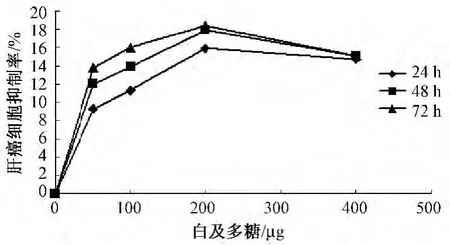
图3 白及多糖对肝癌细胞抑制率曲线
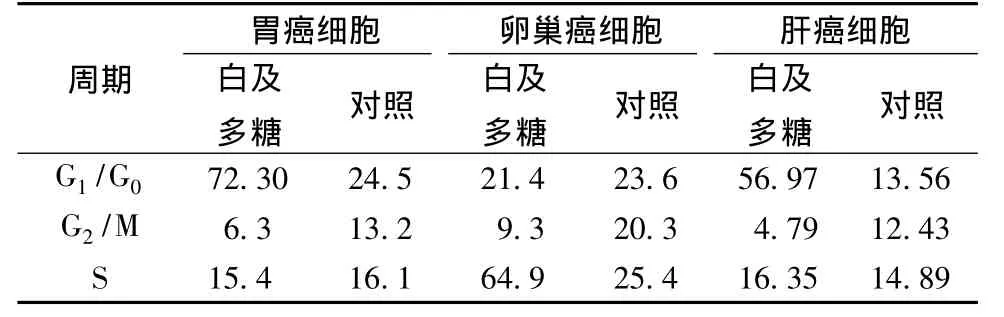
表1 白及多糖对3种肿瘤细胞周期分布的影响
5 讨论
多糖是自然界普遍存在的一类生物大分子,具有广泛的生物学活性,作为免疫调节剂可激活多种免疫细胞,促进细胞因子生成,活化补体而发挥抗肿瘤、抗病毒、抗菌、抗炎、抗氧化等作用[5]。目前研究认为多糖抗肿瘤作用:一是对肿瘤细胞的直接作用,即多糖直接杀死肿瘤细胞,包括对肿瘤细胞膜的特异性作用、抗自由基作用、诱导分化与诱导凋亡、对肿瘤基因的改变及对肿瘤细胞超微结构的影响等[6];二是作为免疫反应调节剂,通过增强机体的免疫功能而间接抑制或者杀灭肿瘤细胞[7]。本实验结果显示,白及多糖在体外对3种肿瘤细胞的生长均有抑制作用,且抑制效应随白及多糖质量浓度的不同而明显不同 (P<0.05),说明白及多糖具有抑制sgc、A2780和Hep-G2增殖的作用,并且,IC50值提示对sgc的抑制作用最明显。
以往的研究表明多糖抑制肿瘤细胞增殖的效果与剂量虽然存在依赖关系,但这种关系并不十分严格[8]。当多糖质量浓度过高时,多糖对肿瘤细胞的抑制增殖作用反而有所减弱[9]。出现这种现象,可能与多糖是混合多糖的特征有关[10]。多糖成分复杂,可能也是造成对多糖抑制肿瘤细胞增殖效果和机理研究结果难于统一的原因之一,这无疑也是将多糖真正用于肿瘤临床治疗的障碍之一[11]。本实验结果显示随着白及多糖质量浓度的逐渐增加,对3种肿瘤细胞的抑制率也逐渐上升,但增加到最高质量浓度后反而抑制率有所下降。提高多糖的纯化率可能是有效的实现多糖真正发挥抑制肿瘤增殖作用的关键环节,其必将依赖多糖提取与纯化技术的进一步提高。
在本实验中经流式细胞仪检测肿瘤细胞周期的结果显示,经白及多糖处理后,3种肿瘤细胞的细胞周期均发生了停滞,sgc细胞和HepG2细胞停滞在G0/G1期,A2780细胞停滞在S期。细胞周期在肿瘤的生长调控中具有非常重要的作用,细胞周期有G1期关键点和G2期关键点,G1期检验点决定细胞能否通过G1期进入S期,它是细胞周期的始动机制;G2期向M期的转变涉及到细胞的有丝分裂,包括胞质分裂和核DNA分裂,完成由1个细胞向2个细胞的转化[12-14]。许多抗肿瘤药对肿瘤细胞的分裂周期具有选择性,本实验结果显示经白及多糖处理后,3种肿瘤细胞于不同的细胞周期发生增殖抑制,可能与此有关。细胞凋亡又称为细胞程序性死亡[15],目前认为,许多肿瘤的发生就是由于该肿瘤细胞凋亡通道受阻而引起的。白及多糖对肿瘤细胞周期的阻滞作用,为其具有抗肿瘤作用提供了实验证据,也为以后更进一步地进行抗肿瘤实验提供初步的实验依据,但是白及多糖具体通过哪些通道而发生抗肿瘤作用,是否通过凋亡途径,仍然是今后进一步研究的课题。
天然多糖临床不良反应小,目前不少多糖已应用于临床治疗,在多个领域内显示出良好的应用前景。本实验所用的白及多糖是经过层析柱分离纯化的多糖组分,而非单糖结构,因此其显著抑制肿瘤细胞生长的作用很可能是多种单糖聚合在一起的协同作用。白及多糖可抑制肿瘤细胞的生长,影响肿瘤细胞的生长周期,但是否与多糖诱发细胞凋亡、影响细胞间信号分子表达、改变肿瘤基因等因素有关,值得进一步深入研究。
[1]Dong L,Xia S,Luo Y,et al.Targeting delivery oligonucleotide into macrophages by cationic polysaccharide from Bletilla striata successfully inhibited the expression of TNF-alpha[J].J Control Release,2009,134(3):214-220.
[2]Luo Y,Diao H,Xia S,et al.A physiologically active polysaccharide hydrogel promotes wound healing[J].J Biomed Mater Res A,2010,94(1):193-204.
[3]Zheng C,Feng G,Liang H.Bletilla striata as a vascular embolizing agent in interventional treatment of primary hepatic carcinoma[J].Chin Med J(Engl),1998,111(12):1060-1063.
[4]Qian J,Vossoughi D,Woitaschek D,et al.Combined transarterial chemoembolization and arterial administration of Bletilla striata in treatment of liver tumor in rats[J].World J Gastroenterol,2003,9(12):2676-2680.
[5]Wasser S P.Current findings,future trends,and unsolved problems in studies of medicinal mushrooms[J].Appl Microbiol Biotechnol,2011,89(5):1323-1332.
[6]Cheng K C,Huang H C,Chen J H,et al.Ganoderma lucidum polysaccharides in human monocytic leukemia cells:from gene expression to network construction[J].BMC Genomics,2007,8:411-428.
[7]Zhou X,Lin J,Yin Y,et al.Ganodermataceae:natural products and their related pharmacological functions[J].Am J Chin Med,2007,35(4):559-574.
[8]Ale M T,Maruyama H,Tamauchi H,et al.Fucoidan from Sargassum sp.and Fucus vesiculosus reduces cell viability of lung carcinoma and melanoma cells in vitro and activates natural killer cells in mice in vivo[J].Int J Biol Macromol,2011,49(3):331-336.
[9]Zhu X L,Lin Z B.Effects of Ganoderma lucidum polysaccha-rides on proliferation and cytotoxicity of cytokine-induced killer cells[J].Acta Pharmacol Sin,2005,26(9):1130-1137.
[10]Lee J S,Kwon J S,Won D P,et al.Study of macrophage activation and structural characteristics of purified polysaccharide from the fruiting body of Cordyceps militaris[J].J Microbiol Biotechnol,2010,20(7):1053-1060.
[11]何彦丽,应 逸,许艳丽,等.枸杞多糖对荷瘤小鼠肿瘤微环境T淋巴细胞亚群及树突状细胞的影响[J].中西医结合学报,2005,3(5):374-377.
[12]Kronja I,Orr-Weaver T L.Translational regulation of the cell cycle:when,where,how and why?[J].Philos Trans R Soc Lond B Biol Sci,2011,366(1584):3638-3652.
[13]Qiao D,Meyer K,Friedl A.Glypican-1 stimulates skp2 autoinduction loop and g1/s transition in endothelial cells[J].J Biol Chem,2012,287(8):5898-5909.
[14]Rieder C L.Mitosis in vertebrates:the G2/M and M/A transitions and their associated checkpoints[J].Chromosome Res,2011,19(3):291-306.
[15]Anh T D,Ahn M Y,Kim S A,et al.The histone deacetylase inhibitor,Trichostatin A,induces G2/M phase arrest and apoptosis in YD-10B oral squamous carcinoma cells[J].Oncol Rep,2012,27(2):455-460.
