挤出滚圆法制备山楂叶总黄酮微丸
2014-11-04黄竹珺蒲雪兵王慧娟
黄竹珺,蒲雪兵,周 英,3,林 冰,王慧娟*
(1.贵州大学生命科学学院,贵州贵阳 550025;2.贵州省中药民族药创制工程中心,贵州贵阳 550025;3.贵州省中药材繁殖与种植工程实验室,贵州贵阳 550025)
山楂叶总黄酮是山楂叶提取物中的主要活性成分,主要含有槲皮素、芦丁、金丝桃苷、牡荆素鼠李糖苷、荭草素等黄酮类化合物[1-2]。近年来,研究发现这些黄酮类成分可治疗心血管疾病,有降压、增加冠脉血流量、降血脂、耐缺氧、强心、抗心律失常等作用[3-6]。
微丸属于多单元型给药系统,与其他一单元型给药系统相比,具有生物利用度高、不受胃排空因素的影响、血药浓度平稳等不可比拟的优点[7-8]。挤出滚圆法是当今国际上应用较为广泛的一种制丸方法[9],具有产品收率高、微丸大小均匀、圆整度好、易于进一步包衣等优点[10],但其成型受到物料性质和工艺条件的影响[11-12]。本研究以山楂叶提取物为原料,采用挤出滚圆法制备微丸,对微丸的处方和制备工艺进行优化,以使药物能够充分发挥药效。
1 仪器与材料
1.1 仪器 UV-1801紫外-可见分光光度计 (北京北分瑞利分析仪器 (集团)有限责任公司);FA1004电子天平(上海天平仪器厂);GZX-9140MBE电热恒温鼓风干燥箱(上海博达实业有限公司医疗设备厂);KH-500DE型数控超声波清洗仪 (昆山禾创超声仪器有限公司);ZKT-7F真空脱气仪 (天津市天大天发科技有限公司);JBZ-300型多功能微丸包衣造粒机 (辽宁医联新药技术研究所);RCZ-6B3型药物溶出仪 (上海黄海药检仪器有限公司);SZ-93A自动双重纯水蒸馏器 (上海亚荣生化仪器厂);PTGS4粉末性能测试仪 (PHARMA TEST);国家统一标准检验筛。
1.2 材料 山楂叶提取物 (山楂叶总黄酮纯度≥90%,临沂爱康药业有限公司);芦丁对照品 (纯度≥98%,中国固体制剂制造技术国家工程研究中心);无水乙醇 (AR级,成都金山化学试剂有限公司);氢氧化钠 (AR级,重庆川江化学试剂厂);亚硝酸钠 (AR级,南昌华鑫化学试剂有限公司);硝酸铝 (AR级,广东汕头市西陇化工厂);乳糖 (上海昌为医药辅料技术有限公司);微晶纤维素 (常熟市药用辅料有限公司);可溶性淀粉 (天津市致远化学试剂有限公司);甘露醇(天津市科密欧化学试剂有限公司);十二烷基硫酸钠 (SDS,国药集团化学试剂有限公司);羟丙基-β-环糊精 (山东新大精细化工有限公司);双蒸水 (自制)。
2 方法与结果
2.1 指标成分体外溶出度测定方法的建立
2.1.1 测定波长的选择 取适量空白辅料、山楂叶提取物和山楂叶总黄酮微丸,按照溶出度实验方法,取60 min溶出液,经显色后分别在400~600 nm波长范围内进行扫描。结果表明,山楂叶提取物和山楂叶总黄酮微丸溶出液在500 nm处均有最大吸收,而空白辅料此处无吸收,因此选择500 nm作为测定波长。
2.1.2 标准曲线的绘制 精密称定12.5 mg经120℃干燥至恒重的芦丁对照品,置50 mL量瓶中,加适量95%乙醇,超声处理 (功率300 W,频率50 Hz)45 min使之溶解,放冷,用95%乙醇定容至刻度,摇匀备用。精密吸取芦丁对照品溶液1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,分别置于25 mL量瓶中,各加蒸馏水至7 mL,加5%亚硝酸钠1.0 mL,摇匀,放置6 min,加10%硝酸铝1.0 mL,摇匀,放置6 min,加氢氧化钠10.0 mL,加水至刻度,摇匀,放置15 min,在500 nm波长处测定吸光度值。以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线为Y=0.0115x-0.0147(r2=0.9995)。
2.1.3 精密度试验 精密吸取对照品溶液4.0 mL,置25 mL量瓶中,按照“2.1.2”项下方法显色后,在500 nm波长处连续测定吸光度6次。结果吸光度RSD值为0.15%,表明仪器精密度良好。
2.1.4 稳定性试验 精密吸取对照品溶液4.0 mL,置25 mL量瓶中,按照“2.1.2”项下方法显色后,在500 nm波长处每隔10 min测1次吸光度。结果吸光度 RSD值为1.47%,表明溶液显色后在60 min内稳定。
2.1.5 加样回收率试验 取山楂叶总黄酮微丸,研细,精密称取6份样品,置于25 mL量瓶中,分别加入芦丁对照品15 mg,以蒸馏水溶解并稀释至刻度,按“2.1.2”项下方法测定。计算平均回收率为99.70%,RSD值为0.46%。结果见表1。
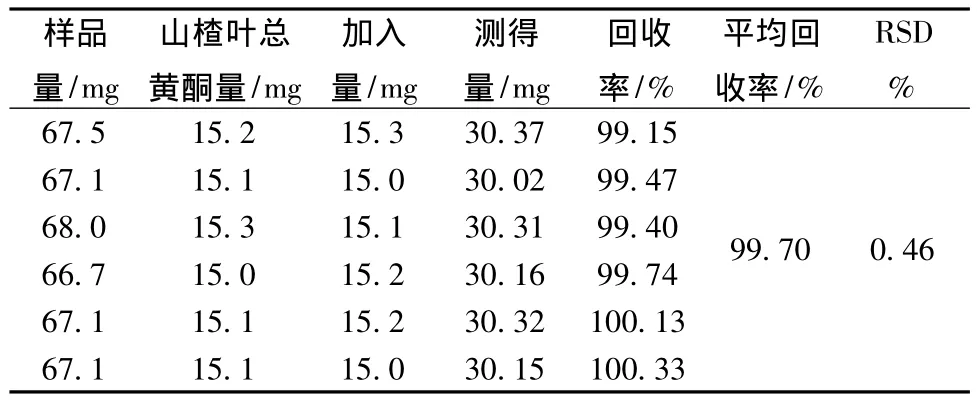
表1 加样回收率试验结果
2.1.6 微丸的体外溶出度测定方法 按照《中国药典》2010年版二部附录ⅩC溶出度测定法中第二法操作[13]。以900 mL脱气蒸馏水为溶出介质,温度为 (37±0.5)℃,转速为75 r/min,取自制的山楂叶总黄酮微丸,分别投入6个溶出杯内,在第5、10、15、30、45、60 min时分别进行取样,每次取10 mL溶出液 (同时补液10 mL),以0.45 μm的微孔滤膜过滤后精密量取5 mL,置25 mL量瓶中,按照“2.1.2”项下方法,自“加水至7 mL”起依法测定吸光度,代入标准曲线求算溶出度,并计算各个时间点的累积溶出度值。
2.2 山楂叶总黄酮微丸的制备 分别称取山楂叶提取物和微晶纤维素 (MCC)等原、辅料,过100目筛,混匀,加入适当润湿剂制成软材。经挤出机筛板 (孔径1 mm)挤成光滑致密的条状物,置于滚圆机中,直至颗粒滚制成丸。取出微丸,适度干燥,筛分,以24~50目的微丸进行分析和评价。
2.3 休止角的测定 休止角 (α)反映了微丸的流动性,同时也反映其圆整度。按照粉末性能测定仪的操作方法,称取大于100 g的微丸,固定搅拌桨的高度,转速设定为20 r/min,微丸倾倒入漏斗中进行试验,并记录结果。所测微丸的休止角小于30°,说明流动性较好,圆整度较好。
2.4 处方单因素考察
2.4.1 润湿剂的选择 称取25%山楂叶提取物,微晶纤维素 (MCC)为微丸成型的辅料补足100%,混合均匀,分别以蒸馏水、55%、65%、75%、85%、95%乙醇作润湿剂,制备微丸。按微丸的成型情况,筛选出合适的润湿剂,见表2。结果表明,以65%乙醇作为润湿剂时微丸的成型较好,故选取65%乙醇作为润湿剂。

表2 润湿剂筛选结果
2.4.2 载药量的考察 以65%乙醇作为润湿剂制备微丸,进行微丸载药量的考察。通过预试验发现,载药量在很大程度上影响微丸的成型及其质量,当载药量小于20%时,微丸圆整度好,得率高;当载药量大于30%时,微丸成球性能差,粒度不均。综合考虑其临床使用剂量和微丸的圆整度,将载药量定为25%。
2.4.3 微丸的体外溶出度考察 制备载药量为25%山楂叶总黄酮微丸。按照“2.1.2”项下方法,测定吸光度,代入标准曲线求算溶出度,并计算各个时间点的累积溶出度,见图1。结果表明,60 min时,微丸的累积溶出度仅达到73%左右,说明所研制的微丸体外溶出效果不好,需要对处方进行优化,增强微丸的溶出效果。
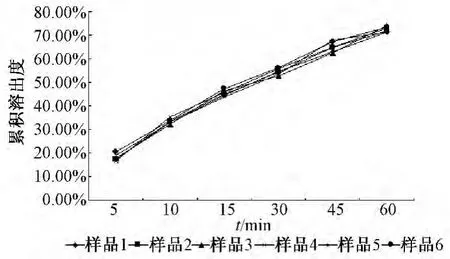
图1 25%含药微丸的累积溶出度
2.4.4 水溶性辅料对溶出效率的影响及用量选择 分别选用10%乳糖、10%甘露醇、10%羟丙基-β-环糊精作为水溶性辅料,加入上述处方中制备载药量为25%山楂叶总黄酮微丸,测定各个时间点的累积溶出度。结果表明,水溶性辅料的加入可以不同程度地增加指标成分的溶出度,其影响程度:乳糖>羟丙基β-环糊精>甘露醇。结果表明,乳糖作为水溶性辅料时,微丸的成型较好,60 min时微丸的累积溶出度达到93%,溶出效果较好,故选择乳糖作为水溶性辅料,见图2。随乳糖用量增加,指标成分的累积溶出度增加,结果见图3。当乳糖的用量超过15%后,微丸成型不理想,故将乳糖的用量定为15%。
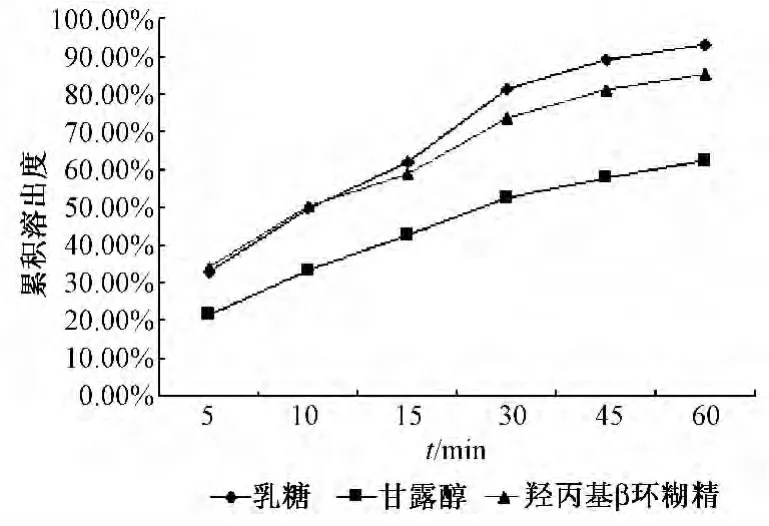
图2 加入水溶性辅料微丸的累积溶出度
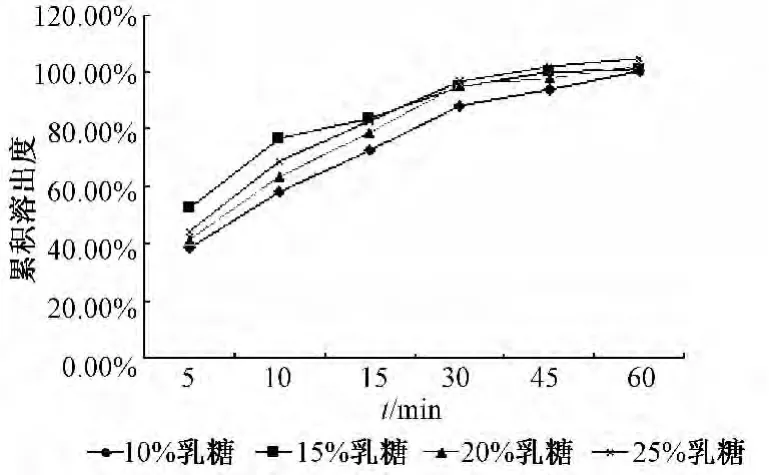
图3 乳糖不同用量微丸的累积溶出度
2.4.5 SDS的加入及用量选择 在上述处方中分别加入0.5%、1.0%、1.5%、2.0%的SDS。制备载药量为25%的山楂叶总黄酮微丸,测定各个时间点的累积溶出度,结果见图4。表明随SDS用量增加,微丸的溶出效率增加。1%SDS在60 min时的累积溶出度可达到100%左右,故将其用量定为1%。
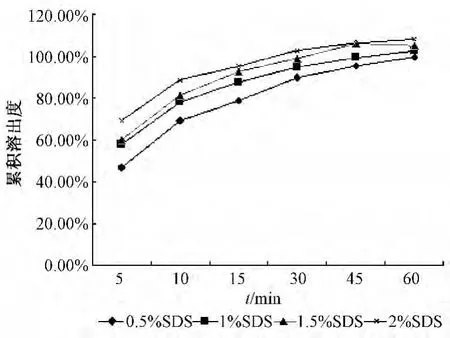
图4 SDS不同用量微丸的累积溶出度
2.5 制备工艺的优化 通过多次预试验,确定影响挤出滚圆工艺的3个主要因素分别为:挤出频率 (A)、滚圆频率(B)和滚圆时间 (C)。本研究选用L9(34)正交表,因素、水平见表3。以60 min的累积溶出度为评价指标,对微丸的工艺条件进行优化,结果见表4。

表3 正交试验因素水平
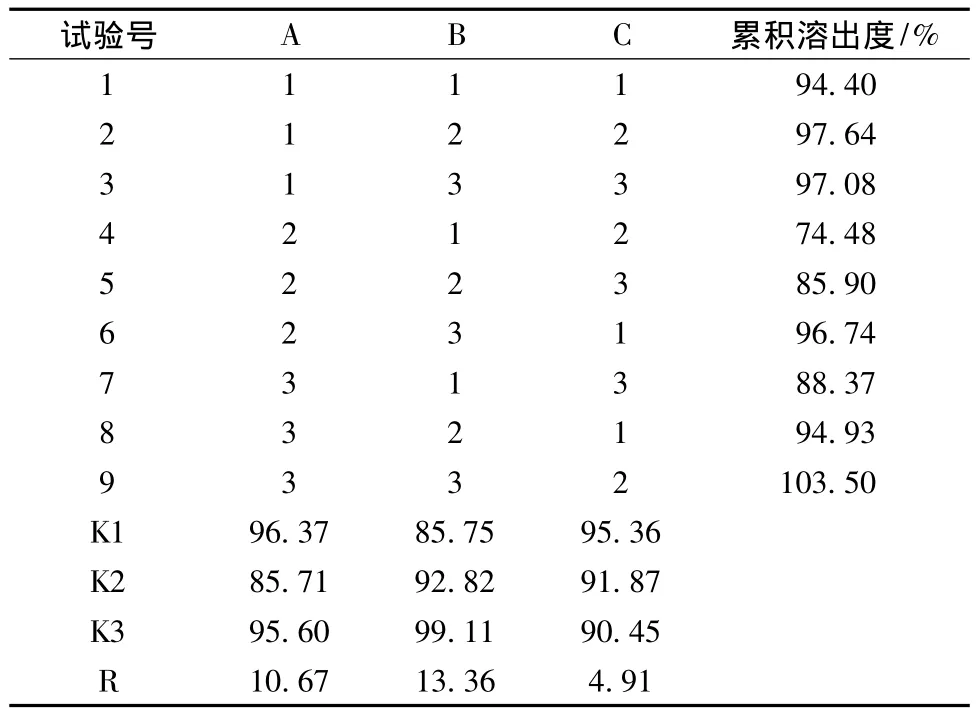
表4 正交试验结果分析
由表4的分析结果可看出:三因素对成丸影响的大小顺序为B>A>C,从正交结果看,最优组合为A1B3C1,即挤出频率为30 Hz,滚圆频率为40 Hz,滚圆时间为6 min。
2.6 微丸的质量评价 按优化的处方和最佳工艺制备3批载药量均为25%的微丸,结果平均收率达71.97%。对3批样品的休止角、脆碎度进行测定,平均值分别为26.73°和0.05%。照“2.1.6”项下方法对3批样品的溶出度进行测定,结果见图5。
结果表明,优化所得工艺制备的微丸圆整度好,大小均匀,硬度适宜,且收率较高。微丸中山楂叶总黄酮在60 min的累积溶出度均达95%以上,可直接装入胶囊应用,亦可进一步通过包衣制备其缓释微丸。
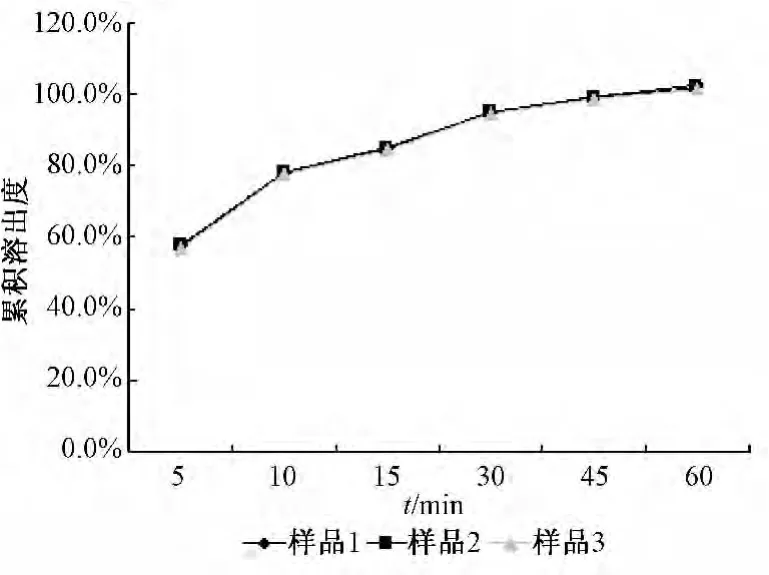
图5 3批微丸的累积溶出度
3 讨论
软材制备的好坏直接影响软材的挤出以及微丸成型,合格的软材应该具备以下特点:湿度、黏度适宜,有一定的塑性,软材挤出后滚圆过程中呈现出小圆球状 (即起模)并处于分散态,小圆球表面光亮圆整,处于未渗出水分和渗出水分的临界处。
滚圆频率在微丸制备中起着关键作用,这是由于当滚圆频率较低时,剪切力不够,不能将挤出的条状物完全打断,达到在滚动中将微丸滚圆并修整成均一的圆球的目的[14]。当滚圆频率较大时,会产生细粉,降低收率。因此,选用适宜的滚圆频率进行微丸的制备。
本实验在进行山楂叶总黄酮微丸的体外溶出度研究过程中,比较了《中国药典》2010年版二部附录ⅩC溶出度测定法中第一法 (转篮法)与第二法 (桨法)。结果发现,在转篮法操作过程中,胶囊壳溶解后微丸易漂浮在转篮的上部,影响溶出效果,造成实验误差。而采用桨法时,可避免此种现象的发生,降低实验误差。因此,本研究选择桨法进行微丸的体外溶出度测定。
[1]刘荣华,邵 峰,邓雅琼,等.山楂化学成分研究进展[J].中药材,2007,31(7):1102.
[2]宋少江,陈 佳,冠 翔,等.山楂叶的化学成分[J].沈阳药科大学学报,2006,23(2):88-90.
[3]刘荣华,余伯阳.山楂叶HPLC指纹图谱研究[J].中成药,2007,29(1):7-11.
[4]李贵海,孙敬勇,张希林,等.山楂降血脂有效成分的实验研究[J].中草药,2002,33(1):50-52.
[5]杨宇杰,林 静.山楂叶总黄酮对大鼠高脂血症早期干预的实验研究[J].中草药,2008,39(12):1848-1850.
[6]宋玉超,连超杰,雷海民,等.山楂叶及其制剂对心血管作用的研究进展[J].现代药物与临床,2011,26(1):25-28.
[7]刘 耀,刘松青,戴 青,等.挤出滚圆法制备单硝酸异山梨酯微丸及其性质考察[J].第三军医大学学报,2007,29(11):1069-1071.
[8]汪 云,姜洪芳,汪国华.微丸的成型性研究进展[J].江西中医学院学报,2002,14(1):59-60.
[9]陈红霞,贾晓斌,陈 彦,等.挤出滚圆法制备复方杞芪微丸的处方及工艺优化[J].中国中药杂志,2006,31(22):1862-1865.
[10]王文刚,崔光华.挤出-滚圆制微丸工艺的进展[J].中国新药杂志,2001,10(9):661-664.
[11]成旭东,陈 彦,贾晓斌,等.挤出滚圆法制备葛根黄酮微丸及其性质的研究[J].中成药,2006,28(2):179-181.
[12]洪燕龙,冯 怡,徐德生,等.挤出滚圆法制备大川芎方速释微丸的处方工艺研究[J].中药材,2007,30(12):1596-1600.
[13]国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:附录85-87.
[14]卢 芳,赖春花,潘俊杰,等.挤出滚圆法制备三七总皂苷微丸及其性质考察[J].江西中医学院学报,2010,22(3):46-48.
