补骨脂对小鼠肝细胞形态、肝功能及线粒体膜电位的影响
2014-11-04张秀娟曹慧琪邢志华季宇彬
张秀娟,曹慧琪,邢志华,季宇彬*
(1.哈尔滨商业大学生命科学与环境科学研究中心生物安全评价研究所,黑龙江哈尔滨 150076;2.国家教育部抗肿瘤天然药物教育部工程研究中心,黑龙江哈尔滨 150076;3.哈尔滨商业大学药学院,黑龙江哈尔滨 150076)
补骨脂是中医临床治疗脾肾阳虚的常用补虚药物[1]。传统医学认为补骨脂具有补肾助阳,固精缩尿,暖脾止泻,纳气平喘等功效,主治肾虚冷泄,遗尿尿频,阳痿,遗精,虚寒喘咳,腰膝冷痛等病症[2];现代药理学研究表明该药具有扩张冠状动脉,抗菌,抗衰老的作用,对平滑肌有双向调节作用,以及抗肿瘤等药理活性[3-4]。补骨脂药材、炮制、化学、药理作用及临床应用等在国内外都有了多方面的研究报道,但是长期使用补骨脂对机体损伤方面的研究甚少。故本课题旨在通过观察肝脏病理组织、血清学、细胞学变化规律,分析补骨脂对小鼠肝损伤作用,并探讨其安全用量范围,为今后安全、合理、有效用药提供理论基础。
1 材料
1.1 药物 补骨脂购自哈尔滨人民同泰药店,经哈尔滨商业大学药学院金哲雄教授鉴定为豆科补骨脂属植物补骨脂Psoralea corylifolia的干燥成熟果实。
1.2 动物 昆明种小鼠 (20±2)g,雌雄各半,合格证为黑动字第POO101006号,由黑龙江中医药大学实验动物中心提供。
1.3 试剂与仪器 谷丙转氨酶 (ALT)、谷草转氨酶(AST)、肿瘤坏死因子-α(TNF-α)试剂盒、白细胞介素-6(IL-6)试剂盒,南京建成生物工程研究所;Adventurer万分之一电子天平,OHAUS公司;高速离心机,Beckman Coulter;超细匀浆器,德国FLUKU F6/10;低速离心机,北京医用离心机厂 LD4-2A;SUNRISE酶标仪,瑞士TECAN公司;流式细胞仪,美国BECK-COULTER公司;OLYMPUS IX70倒置显微镜,Olympus公司。
2 方法
2.1 实验动物分组及给药 小鼠40只,随机分成4组,分别为对照组、补骨脂组 (6.0、3.0、1.5 g/kg),灌胃,28 d。
2.2 补骨脂对小鼠肝脏组织形态学的影响 取小鼠肝脏适量切成小块,PBS冲洗,石蜡包埋,H.E.染色。
2.3 补骨脂对小鼠血清ALT、AST的影响 眼球取血,3000 r/min离心10 min,分离血清,紫外分光光度法测定ALT、AST活性。
2.4 补骨脂对小鼠血清TNF-α、IL-6活性的影响 眼球取血,3000 r/min离心10 min,分离血清,酶联免疫吸附试验测定TNF-α、IL-6活性。
2.5 补骨脂对小鼠肝细胞线粒体膜电位的影响
2.5.1 肝细胞的分离纯化 小鼠肝脏适量切成小块,PBS冲洗,胰酶37℃消化15 min,小牛血清中止,300目尼龙网过滤,1000 r/min,10 min,弃上清,收集沉淀细胞,1000 r/min离心10 min,弃上清,调整细胞密度约为1×106个/mL。
2.5.2 线粒体膜电位的测定 取500 μL细胞悬液,加染色液500 μL,使其终质量浓度为10 μg/mL,37℃孵育30 min,加1 mL PBS,1000 r/min离心10 min,弃上清,加1 mL PBS,300目尼龙网过滤到流式管中,流式细胞仪检测。激发波长488 nm,发射波长630 nm。
2.6 数据处理 所有数据用SPSS 19.0软件进行方差分析。所有数据用表示,数据分析用方差检验。
3 结果
3.1 补骨脂对小鼠肝脏组织形态学的影响 如图1所见,对照组肝小叶结构清晰,汇管区无扩大,肝索排列整齐,肝细胞结构完整,无肿大、脂变、坏死及明显炎细胞浸润;补骨脂各组则出现肝细胞轻度病变,1.5 g/kg组发现少量小坏死病灶;3.0 g/kg组不仅出现小坏死灶,且有肝细胞肿胀现象;6.0 g/kg组组织切片显示为小坏死灶增多。
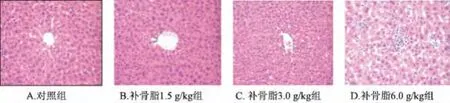
图1 补骨脂对小鼠肝脏组织形态学的影响 (40×10)
3.2 补骨脂对小鼠血清ALT、AST的影响 6.0、3.0 g/kg组ALT和AST活性与对照组相比均有显著的上升,说明补骨脂对小鼠肝功能具有明显的损伤作用。见表1。
表1 补骨脂对小鼠血清ALT和AST活性的影响 )
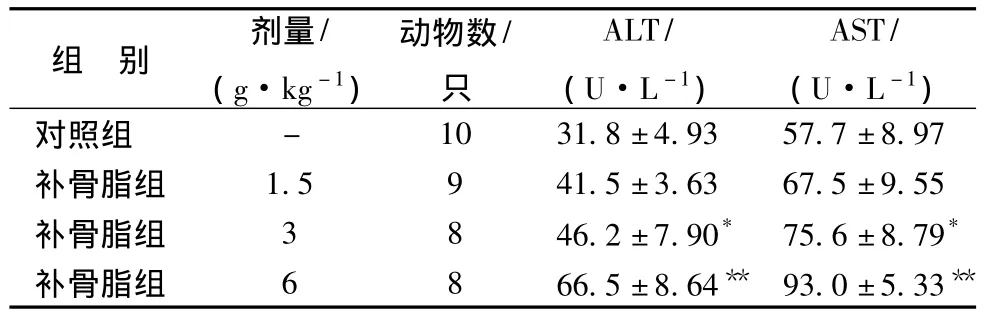
表1 补骨脂对小鼠血清ALT和AST活性的影响 )
注:与对照组比较,*P <0.05,**P <0.01
组 别 剂量/(g·kg-1)动物数/只ALT/(U·L-1)AST/(U·L-1)- 10 31.8±4.93 57.7±8.97补骨脂组 1.5 9 41.5±3.63 67.5±9.55补骨脂组 3 8 46.2±7.90* 75.6±8.79*补骨脂组 6 8 66.5±8.64** 93.0±5.33对照组**
3.3 补骨脂对小鼠血清TNF-α、IL-6活性的影响 与对照组比较,TNF-α活性6.0 g/kg组显著升高;6.0、3.0 g/kg组IL-6活性与对照组相比均显著升高,说明补骨脂对小鼠肝功能具有明显的损伤作用。见表2。
表2 补骨脂对小鼠血清 TNF-α和 IL-6活性的影响
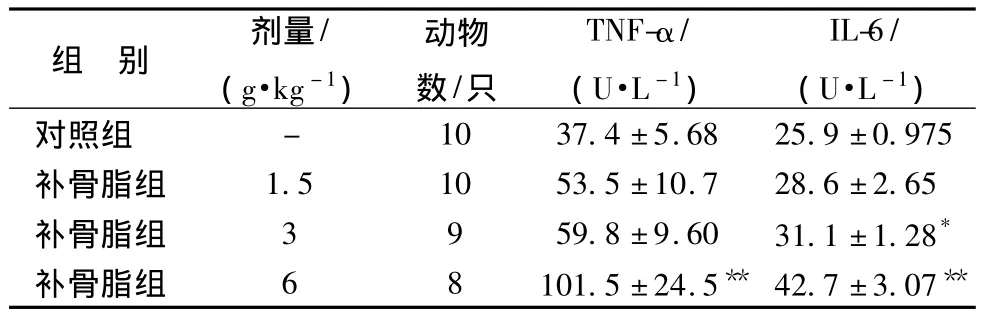
表2 补骨脂对小鼠血清 TNF-α和 IL-6活性的影响
注:与对照组比较,*P <0.05,**P <0.01
组 别 剂量/(g·kg -1)动物数/只TNF-α/(U·L -1)IL-6/(U·L -1)对照组 - 10 37.4±5.68 25.9±0.975补骨脂组 1.5 10 53.5±10.7 28.6±2.65补骨脂组 3 9 59.8±9.60 31.1±1.28*补骨脂组 6 8 101.5 ±24.5** 42.7±3.07**
3.4 补骨脂对小鼠肝细胞线粒体膜电位的影响 如图2所示。肝细胞中强荧光部分细胞所占百分比逐渐减少,随着药物剂量的升高其比例的减少更加显著,并呈一定的剂量依赖关系,说明补骨脂可使小鼠肝细胞内线粒体膜电位明显下降,致肝细胞损伤。
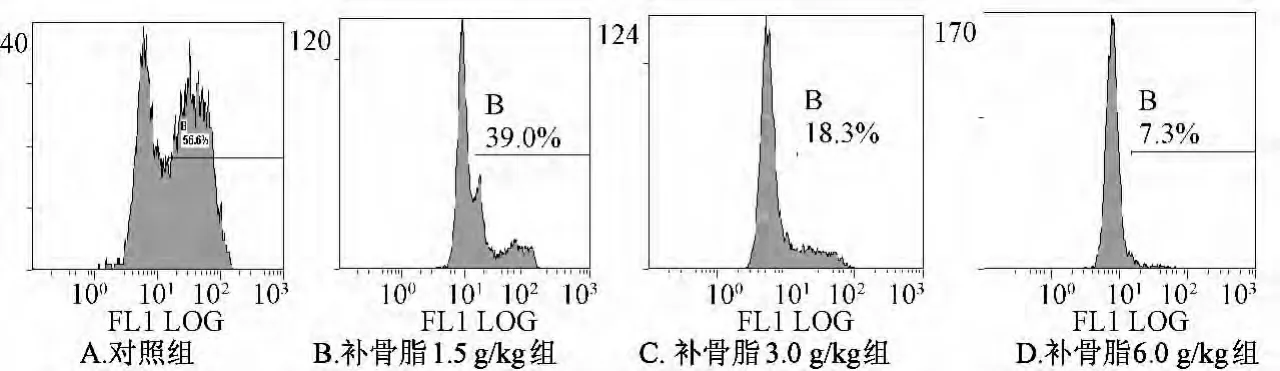
图2 补骨脂对小鼠肝细胞线粒体Δψm的影响
4 讨论
中药肝毒性研究已成为中医药界关注热点问题,正确合理的评价中药毒性已成为当今中药研究领域亟待解决的关键问题之一。进入机体的各种外源物质最终都会在肝脏内代谢、转化、贮留,可直接或通过代谢作用间接损害肝脏,诱导肝细胞坏死、炎症等病理改变,造成急性、慢性等不同程度的肝脏疾病[5-6]。外源性刺激引起动物肝脏发生损伤时均可引起血清转氨酶活性的升高[7-8],其中血清 ALT及AST水平可在一定程度上反应肝脏的功能状态。细胞因子是机体防御系统的主要部分,外界条件刺激会对各种细胞因子基因转录产生促进作用,进而导致细胞因子和炎症介质 (TNF-α、IL-6)释放[9-11],产生过多亦可损伤肝细胞。正常情况下,线粒体跨膜电位是维持线粒体进行氧化磷酸化、产生三磷酸腺苷的先决条件,是线粒体发挥正常功能的基础。线粒体不仅可以通过氧化磷酸化产生三磷酸腺苷 (ATP)为机体供能外,还具有很多其他重要功能,如参与细胞内钙自稳平衡、pH值的调节等,特别在细胞生存和坏死的调控中起决定性功能,细胞坏死时线粒体的形态和功能发生一系列变化[12-13]。研究结果显示补骨脂能引起小鼠肝细胞肿胀、坏死,血清学结果显示,ALT、AST活性低剂量组较空白组有增加趋势但没有统计学意义,高、中剂量组显著增加;TNF-α、IL-6活性低剂量组较空白组有增加趋势但没有统计学意义,高、中剂量组显著增加;肝细胞线粒体膜电位 (ΔΨm)随着给药剂量的增加显著降低。说明补骨脂对小鼠肝脏具有明显的损伤作用。
综上所述,补骨脂经长期大剂量给药对小鼠体质量、肝组织、肝功能酶都有明显的影响,而且对肝细胞有损伤作用,表现为引起肝细胞线粒体膜电位显著下降,肝细胞坏死。提示补骨脂大剂量使用可对小鼠肝脏造成一定的损害。
[1]吴 疆,魏 巍,袁永兵.补骨脂的化学成分和药理作用研究进展[J].药物评价研究,2011,34(3):217-219.
[2]刘自力,施 静.补骨脂临床研究进展[J].临床分析与研究,2009,18(5):101-102.
[3]曹金一,刘京晶,黄文华,等.补骨脂药理作用与临床应用研究进展[J].中药药理与临床,2008,24(6):89-91.
[4]刘 桦,白焱晶,陈亚云,等.中药补骨脂化学成分的研究[J].中国中药杂志,2008,33(12):1410-1412.
[5]王京丽,周超凡.中草药及其制剂对肝损伤的研究概述[J].中国中药杂志,2011,36(23):3371-3373.
[6]刘树民.中药药物性肝损害[M].北京:中国中医药出版社,2007:53-59.
[7]贾毅捷,王育琴,常红军,等.77例中药不良反应报告与分析[J].药物不良反应杂志,2003,5(4):231-234.
[8]陈一凡,蔡皓东.中药引起肝损害的调查分析[J].药物不良反应杂志,1999(1):27-32.
[9]陈 晨,王 蓓,余 黎,等.中药肝毒性成分研究进展[J].药学与临床研究,2012,20(2):148-151.
[10]Neuman M G.Cytokines-central factors in alcoholic liver disease[J].Alcohol Res Health,2003,27(4):307-316.
[11]Gobejishvili L,Barve S,Joshi-Barve S,et al.Chronic ethanolmediated decrease in cAMP primes macrophages to enhanced LPS-inducible NF-kappa B activity and TNF expression:relevance to alcoholic liver disease[J].Am J Physiol Gastrointest Liver Physiol,2006,291(4):681-688.
[12]王君明,崔 瑛,申玲玲,等.中药致药源性肝损伤的氧化应激机制研究进展[J].中国实验方剂学杂志,2011,17(5):247-249
[13]Ichas F,Mazat J P.From calcium signling to cell death:two conformations for the mitochondrial permeability transition pore,switching from low-to high-conductance state[J].Biochim Biophys Acta,1998,1366(1/2):33-50.
