皮肤鳞状细胞癌中Survivin, Caspase-3, COX-2的表达及临床意义
2014-11-02祝立丽肖明明表贞淑李正刚李银玲景士兵
祝立丽, 肖明明, 表贞淑, 刘 洋, 李正刚, 杨 锎, 李银玲, 高 爽, 景士兵
实验研究
皮肤鳞状细胞癌中Survivin, Caspase-3, COX-2的表达及临床意义
祝立丽, 肖明明, 表贞淑, 刘 洋, 李正刚, 杨 锎, 李银玲, 高 爽, 景士兵
目的探讨皮肤鳞状细胞癌及癌旁正常皮肤中Survivin, Caspase-3和COX-2 的表达及临床意义。方法采用免疫组织化学法和荧光实时定量PCR,检测41例鳞状细胞癌及10例癌旁正常皮肤组织中Survivin, Caspase-3和COX-2 蛋白及mRNA表达情况。结果癌旁正常皮肤中Survivin, Caspase-3和COX-2 蛋白的阳性表达率分别是0、90.00%、10.00%,鳞状细胞癌中阳性表达率分别是68.29%、29.27%、73.17%。与癌旁正常皮肤相比,鳞状细胞癌中Survivin, Caspase-3和COX-2 mRNA相对表达量为11.21、0.13、9.85,差异有显著的统计学意义。经相关性分析,鳞状细胞癌中Survivin与Caspase-3蛋白表达呈负相关(χ2=11.994,P=0.001,R=-0.598);Survivin和COX-2蛋白表达呈正相关(χ2=14.415,P=0,R=0.652)。结论Survivin, Caspase-3和COX-2蛋白可能参与皮肤鳞状细胞癌的形成;Survivin和COX-2蛋白协同促进鳞状细胞癌的发展;增加Caspase-3和/或减少Survivin、COX-2蛋白表达的靶向治疗,有望成为阻止皮肤鳞状细胞癌形成、发展的新途径。
皮肤鳞状细胞癌; Survivin; Caspase-3; COX-2
皮肤鳞状细胞癌(squamous cell careinoma, SCC)是起源于表皮或附属器角质形成细胞的一种恶性肿瘤,其发病率在皮肤非黑素细胞癌中仅次于基底细胞癌,约占全部非黑素细胞癌的20%[1]。Survivin是凋亡抑制蛋白家族(inhibitors of apoptosis proteins, IAPs)中作用最强的分子,在多种肿瘤组织中的表达均增高,而在分化成熟组织中不表达(胸腺除外)[2],它的表达预示肿瘤有较高的侵袭性和不良预后[3-4]。Caspase-3是细胞凋亡通路中重要的执行因子,其表达异常可导致细胞凋亡和增殖失调,从而参与肿瘤等多种疾病的发生[5]。COX-2是环氧合酶(cycloxygenase, COX)的亚型,正常情况下绝大部分组织细胞不表达COX-2,而在炎症细胞因子、有丝分裂原和癌基因等刺激下会产生[6]。研究表明,COX-2抑制肿瘤细胞凋亡,有增加肿瘤细胞侵袭、转移的潜能[7]。笔者对确诊为SCC的41例患者,采用免疫组化法检测了Survivin、Caspase-3和COX-2蛋白的表达,并分析其与临床病理因素的关系,探讨这3种蛋白在SCC发生、发展中的作用。
1 对象与方法
1.1 标本来源
标本取自2005年1月至2014年1月,辽宁省人民医院皮肤科活检及整形外科手术切除标本的石蜡包埋组织,并由病理科诊断为皮肤鳞状细胞癌,共41例。其中男性25例,女性16例;年龄39~78岁,平均60.37岁。另取10例相应癌旁正常皮肤组织作为对照。均获得患者的知情同意。
1.2 主要试剂与方法
1.2.1 主要试剂 Survivin、Caspase-3、COX-2抗体、即用型SP免疫组织化学染色试剂盒、DAB显色试剂盒均购自北京中山生物技术有限公司。
1.2.2 实验方法 所有标本均经10%甲醛固定,石蜡包埋,严格按照免疫组化试剂盒操作说明书进行染色。
1.3 荧光定量PCR(FQ-PCR)
收集新鲜组织置于离心管中,RNA提取及FQ-PCR反应体系均严格按试剂盒说明书进行,数据由软件自动提供。Primer Pmmier 5软件设计合成引物见表1。

表1 引物序列
1.4 结果判定标准
免疫组织化学结果判定标准[6],以细胞质或细胞核中出现淡黄至棕黄色细颗粒状着色为阳性。
1.5 统计学处理
所有数据均采用SPSS 13.0软件进行统计学分析,采用χ2检验、ANOVA方差分析及Pearson相关分析进行统计学处理。
2 结果
2.1 Survivin、Caspase-3和COX-2蛋白的表达情况
10例癌旁正常皮肤组织均未见蛋白的表达,SCC组织中阳性表达率为68.29 %(28/41),与癌旁正常皮肤组织相比差异有统计学意义(χ2=12.511,P<0.001)。Caspase-3蛋白在癌旁正常皮肤组织中的阳性表达率为90%,而在SCC组织中为29.27%,差异有显著的统计学意义(χ2=9.863,P=0.002)。COX-2蛋白在癌旁正常皮肤组织中的阳性表达率为10%,在SCC组织中为73.17%,两者比较有显著的统计学意义(χ2=10.939,P=0.001 )。见表2;图1,2。
2.2 Survivin、Caspase-3和COX-2 mRNA在癌旁正常皮肤和SCC组织中的表达情况
癌旁正常皮肤组织和SCC组织各10例,荧光定量PCR结果见图3。以癌旁正常皮肤组织为对照,SCC中Survivin、Caspase-3和COX-2 mRNA的相对表达量分别是11.21,0.13,9.85,组间比较均有显著的统计学意义(P<0.001)。在癌旁正常皮肤和SCC组织中,Survivin、Caspase-3和COX-2 mRNA表达趋势与蛋白表达趋势相一致。
2.3 Survivin、Caspase-3和COX-2蛋白在SCC组织中表达的相关性分析
在SCC组织中,Survivin与Caspase-3蛋白表达呈显著负相关(χ2=11.994,P=0.001,R=-0.598),Survivin与COX-2蛋白表达呈显著正相关(χ2=14.415,P<0.001,R=0.652)。见表3,4。
3 讨论
Survivin蛋白是肿瘤细胞生存和增殖的重要因子,具有抑制凋亡和参与细胞周期调控的作用,并能调节细胞的有丝分裂,参与血管生成,对肿瘤细胞浸润、转移可能起着重要的作用[8-9]。Survivin蛋白在正常组织中不表达,而选择性地表达于恶性肿瘤组织,这种肿瘤的特异性表达使其成为近几年肿瘤诊断和基因治疗研究的新靶点。Caspase蛋白酶家族是细胞凋亡的核心机制,在细胞凋亡过程的各个阶段中均发挥重要作用,并通过级联激活而启动细胞凋亡[10]。Caspase-3基因是Caspase家族中最重要的成员,在很多正常细胞和肿瘤细胞中均有表达,是细胞凋亡过程中最重要的效应性蛋白裂解酶,大多数有触发细胞凋亡的因素,最终均需通过Caspase-3介导的信号传导途径而导致细胞凋亡[11]。Survivin可通过直接或间接作用于Caspase-3,阻断细胞的凋亡过程[3,12],提示Survivin对Caspase-3的表达可能具有负反馈机制。
表2 癌旁正常皮肤、SCC组织中Survivin、Caspase-3和COX-2蛋白的表达情况
表3 Survivin和Caspase-3蛋白在SCC组织中表达的相关性
Tab3 Relation of Survivin and Caspase-3 protein expression in SCC

SurvivinCaspase⁃3+-合计χ2PR+3252811.9940.001-0.598-9413合计122941
表4 Survivin和COX-2蛋白在SCC组织中表达的相关性
Tab4 Relation of Survivin and COX-2 protein expression in SCC
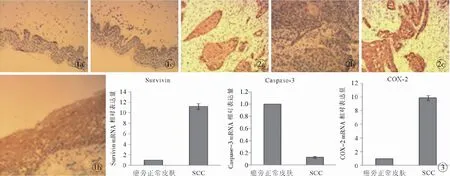
图1 Survivin、Caspase-3和COX-2蛋白在癌旁正常皮肤和SCC组织中的表达 (SP ×100) a.Survivin蛋白呈阴性表达 b. Caspase-3 蛋白呈强阳性表达 c. COX-2 蛋白呈阴性表达图2 Survivin、Caspase-3和COX-2蛋白在SCC组织中的表达 (SP ×100) a. Survivin蛋白呈强阳性表达 b. Caspase-3呈弱阳性表达 c. COX-2蛋白呈强阳性表达图3 FQ-PCR法检测Survivin、Caspase-3和COX-2 mRNA表达
Fig1 The expression of Survivin, Caspase-3 and COX-2 protein in para-carcinoma normal skin tissue and SCC by IHC (SP ×100). a. negative expression of Survivin protein. b. strong positive expression o Caspase-3 protein. c. negative expression of COX-2 protein.Fig2 Expression of Survivin, Caspase-3 and COX-2 protein in SCC by IHC (SP ×100). a. strong positive expression of Survivin protein. b. weak positive expression of Caspase-3 protein. c. strong positive expression of COX-2 protein.Fig3 Expression of Survivin, Caspase-3 and COX-2 mRNA in para-carcinoma normal skin and SCC by FQ-PCR.
本研究发现,与癌旁正常皮肤组织相比,SCC组织中Survivin表达升高,而Caspase-3表达下调,且两种蛋白在SCC中的表达呈显著的负相关。我们推测,SCC发生和演进过程中高表达的Survivin蛋白通过抑制细胞凋亡而促进细胞的转化和增生;此外,Survivin也可能通过抑制Caspase-3的活性而抑制肿瘤细胞的凋亡;Caspase-3蛋白作为介导细胞凋亡的重要中介分子,其低表达进一步抑制了肿瘤细胞的凋亡。这一结果提示,Survivin蛋白的高表达及Caspase-3蛋白的低表达可能共同参与了SCC的发病过程。本研究结果与2004年李海等及2009年邢君等报道一致[13-14]。
近年来的大量研究表明,COX-2不仅是启动炎症反应的关键酶,而且在多种人类肿瘤中有不同程度的表达,包括皮肤肿瘤。COX-2通过促进肿瘤细胞的增殖、抑制凋亡、促进肿瘤新生血管形成等机制参与多种肿瘤的发生和发展,其过度表达与多种肿瘤的发生、发展关系密切,并可作为预防和治疗肿瘤的靶分子[15-16]。在炎症和肿瘤情况下,COX-2表达迅速上调,其产生的大量前列腺E具有免疫抑制效应,可抑制T淋巴细胞及自然杀伤细胞活性,有利于肿瘤细胞的生存[6]。本研究结果显示,SCC组织中COX-2蛋白阳性表达率为73.17%,显著高于正常皮肤组织中的表达,这与2000年Masunaga 等[17]的研究结果相一致。相关性分析结果表明,SCC组织中COX-2蛋白与Survivin表达呈显著的正相关。有研究指出[18],特异性的COX-2抑制剂能明显减少Survivin蛋白在细胞中的表达,同时在动物模型中还发现,Survivin蛋白的表达水平依赖于细胞中COX-2蛋白的存在,其机制可能是在COX-2蛋白大量表达的细胞中,由于较低水平的蛋白化作用使得Survivin能够稳定地表达,从而使细胞的抗凋亡能力大大增强。提示二者在SCC的发病中具有协同作用,可能机制是COX-2通过上调Survivin来抑制肿瘤细胞凋亡,促进细胞异常增殖,共同参与SCC的发生、发展。
综上所述,联合检测Survivin、Caspase-3、COX-2蛋白表达,对皮肤鳞状细胞癌发生、发展及预后有重要意义,而对3种蛋白之间相互作用机制的进一步了解,可能会给皮肤SCC的诊断和治疗带来新的理论依据。目前,已有针对Survivin的靶向治疗[19]与其他促凋亡治疗(如COX-2抑制剂[20]等)结合,协同治疗肿瘤的多项研究;增加Caspase-3蛋白表达,和/或抑制Survivin、COX-2在肿瘤组织中的表达,可能在抗肿瘤治疗中具有重要价值。
[1] Kiprono SK, Chaula BM, Beltraminelli H. Histological review of skin cancers in African Albinos: a 10-year retrospective review[J]. BMC Cancer, 2014,14(1):157.
[2] Malhotra U, Zaidi AH, Kosovec JE, et al. Prognostic value and targeted inhibition of survivin expression in esophageal adenocarcinoma and cancer-adjacent squamous epithelium[J]. PLoS One, 2013,8(11):e78343.
[3] Ulukus EC, Kargi HA, Sis B, et al. Survivin expression in non-small-cell lung carcinomas: correlation with apoptosis and other apoptosis-related proteins, clinicopathologic prognostic factors and prognosis[J]. Appl Immunohistochem Mol Morphol, 2007,15(1):31-37.
[4] Liu JL, Zhang XJ, Zhang Z, et al. Meta-analysis: prognostic value of survivin in patients with hepatocellular carcinoma[J]. PLoS One, 2013,8(12):e83350.
[5] Boland K, Flanagan L, Prehn JH. Paracrine control of tissue regeneration and cell proliferation by Caspase-3[J]. Cell Death Dis, 2013,4:e725.
[6] Soslow RA, Dannenberg AJ, Rush D, et al. COX-2 is expressed in human pulmonary, colonic, and mammary tumors[J]. Cancer, 2000,89(12):2637-2645.
[7] Misra S, Sharma K. COX-2 signaling and cancer: new players in old arena[J]. Curr drug targets, 2014,15(3):347-359.
[8] Dohi T, Beltrami E, Wall NR, et al. Mitochondrial survivin inhibits apoptosis and promotes tumorigenesis[J]. J Clin Invest, 2004,114(8):1117-1127.
[9] Beardmore VA, Ahonen LJ, Gorbsky GJ, et al. Survivin dynamics increases at centromeres during G2/M phase transition and is regulated by microtubule-attachment and Aurora B kinase activity[J]. J Cell Sci, 2004,117(Pt 18):4033-4042.
[10] Xu M, Xia LP, Fan LJ, et al. Livin and caspase-3 expression are negatively correlated in cervical squamous cell cancer[J]. Eur J Gynaecol Oncol, 2013, 34(2):152-155.
[11] Shi Y. Mechanisms of caspase activation and inhibition during apoptosis[J]. Mol Cell, 2002,9(3):459-470.
[12] Gazzaniga P, Gradilone A, Giuliani L, et al. Expression and prognostic significance of LIVIN, SURVIVIN and other apoptosis-related genes in the progression of superficial bladder cancer[J]. Ann Oncol, 2003,14(1):85-90.
[13] 李 海, 李维鑫, 颜 鸣, 等. 皮肤鳞癌中Survivin蛋白及p63蛋白的表达及其临床意义[J]. 现代实用医学, 2004,16 (8):458-459,463.
[14] 邢 君, 张宝林. Livin在皮肤鳞状细胞癌中的表达及其与FHIT、Caspase-3相关性的初步研究[J]. 肿瘤研究与临床, 2009,21(5):311-313,316.
[15] Rahman MA, Kohno H, Nagasue N. COX-2-a target for preventing hepatic carcinoma[J]. Expert Opin Ther Targ, 2002,6(4):483-490.
[16] Elzagheid A, Emaetig F, Alkikhia L, et al. High cyclooxygenase-2 expression is associated with advanced stages in colorectal cancer[J]. Anticancer Res, 2013,33(8):3137-3143.
[17] Masunaga R, Kohno H, Dhar DK, et al. Cyclooxygenase-2 expression correlates with tumor neovascularization and prognosis in human colorectal carcinoma patients[J]. Clin Cancer Res, 2000,6(10):4064-4068.
[18] Erkanli S, Bolat F, Kayaselcuk F, et al. COX-2 and survivin are overexpressed and positively correlated in endometrial carcinoma[J]. Gynecol Oncol, 2007,104(2):320-325.
[19] Mobahat M, Narendran A, Riabowol K. Survivin as a preferential target for cancer therapy[J]. Int J Mol Sci, 2014,15(2):2494-2516.
[20] Mohamed A, El-Rayes B, Khuri FR, et al. Targeted therapies in metastatic esophageal cancer: Advances over the past decade[J]. Crit Rev Oncol Hematol, 2014 Jan 26.
ExpressionofSurvivin,Casepase-3andCOX-2insquamouscellcarcinomaanditsclinicalsignificance
ZHULi-li,XIAOMing-ming,BIAOZhen-shu,etal.
(DepartmentofDermatology,LiaoningProvincialPeople′sHospital,Shenyang110016,China)
ObjectiveTo explore the expression of Survivin, Caspase-3 and COX-2 in para-carcinoma normal skin and squamous cell carcinoma (SCC).MethodsThe expression of Survivin, Caspase-3 and COX-2 in 41 cases of SCC and in 10 cases of para-carcinoma normal skin were detected by fluorescent quatititive PCR (FQ-PCR) and immunological histological chemistry (IHC), respectively.ResultsThe positive rates of Survivin, Caspase-3 and COX-2 in para-carcinoma normal skin were 0, 90.00%, 10.00%, respectively. The positive rates of Survivin, Caspase-3 and COX-2 in SCC were 68.29 %, 29.27%, 73.17%, respectively. Compared with para-carcinoma normal skin, the relative expression of Survivin, Caspase-3 and COX-2 mRNA in SCC were 11.21, 0.13, and 9.85, respectively. The results showed statistically significance. A negative correlation was found between the expression of Survivin and Caspase-3 proteins (χ2=11.994,P=0.001,R=-0.598) in SCC, and there was a highly positive correlation between Survivin and COX-2 protein expression (χ2=14.415,P=0,R=0.652).ConclusionSurvivin, Caspase-3 and COX-2 protein might be involved in the formation of SCC. Survivin and COX-2 proteins may cooperate to promote the progress of SCC. Target treatment of increase the expression of Caspase-3 and/or decrease the expression of Survivin and COX-2 might be possible to prevent the formation of SCC.
Squamous cell careinoma; Survivin; Caspase-3; COX-2
10.3969/j.issn.1673-7040.2014.05.022
R739.5
A
1673-7040(2014)05-0317-04
2014-03-21)
110016 辽宁 沈阳,辽宁省人民医院 皮肤科(祝立丽,表贞淑,刘 洋,李正刚,杨 锎,李银玲);辽宁省人民医院 病理科(肖明明,高 爽,景士兵)
祝立丽(1983-),女,浙江金华人,主治医师.
景士兵,110016,辽宁省人民医院 病理科,电子信箱:mypathology@163.com
