冷循环射频消融治疗后肝癌患者调节性T细胞变化及其对预后的影响
2014-11-01曾江正刘光清郝新宝张建辉苏群豪黄美珠雷俊华
曾江正, 刘光清, 郝新宝, 洪 涛, 张建辉, 苏群豪,黄美珠, 黄 芬, 雷俊华
肝癌(HCC)发病隐匿,仅有10%~20%的患者有机会接受手术根治性治疗[1]。 射频消融(RFA)治疗已成为无法切除的中晚期HCC主要的局部治疗方法[2]。相关研究表明,经高温作用灭活后的肿瘤组织由于其细胞免疫表型的变化而具有瘤苗作用,从而激活机体免疫反应[3]。 调节性 T(regulatory T,Treg)细胞是一群能抑制免疫功能的负调控细胞,近年来Treg细胞己经成为肿瘤免疫学的热点问题之一。本研究通过冷循环RFA治疗HCC患者,了解RFA治疗对HCC患者Treg细胞水平的影响,同时探讨Treg细胞水平变化对HCC患者预后的影响。
1 材料与方法
1.1 材料
1.1.1 临床资料 2009年10月—2012年6月我院肿瘤内科HCC患者30例,男19例,女11例;年龄32~65岁,中位年龄51岁;初治23例,手术后复发7例;肿瘤癌灶最大直径(2.5±1.2)cm(2.1~5.0 cm);Child-Pugh A级 18例,B级 12例;所有患者术前未接受TACE或化疗,随访期间未使用影响免疫调节药物。入组标准:①病理活检证实为HCC;② 肿瘤数目 ≤3个且最大癌灶直径 ≤5.0 cm;③肿瘤有包膜或边界清晰,肿瘤距肝边缘具有足够灭瘤安全范围者;④ 肝功能Child-Pugh A级或B级,无肝外转移。排除标准:①肿瘤数目>3枚或最大癌灶直径 >5 cm,或者弥漫型HCC;② 伴有门脉癌栓或者邻近器官侵犯;③肝功能Child-Pugh C级,经保肝治疗无法改善者;④治疗前1个月内有食管(胃底)静脉曲张破裂出血;⑤不可纠正的凝血功能障碍及严重血象异常,有严重出血倾向者;⑥ 顽固性大量腹水,恶液质;⑦ 活动性感染;⑧ 严重的肝、肾、心、肺、脑主要脏器功能衰竭;⑨ 意识障碍或不能配合治疗的患者。所有患者于RFA术前均签署治疗同意书。
1.1.2 仪器设备 江苏天马高科技有限责任公司生产TM-RFTI-1冷循环RFA治疗系统。包括射频源、蠕动泵、冷循环电极、中性电极板。穿刺引导机为Philips HD11超声仪。应用日本ALOKA α10彩色多普勒超声(彩超)显像仪,采用Bracco公司超声对比剂Sono Vue,造影微泡为磷脂包裹的六氟化硫微气泡。采用美国Bectond-Dickinson公司生产的FACSCalibur型流式细胞仪 (FCM)及抗 CD3-PerCP、抗 CD25-PE、抗 CD4-FITC及同型对照,CD3-FITC/CD8-PE/CD45-PerCP/CD4APC T细胞亚群试剂盒。
1.2 方法
1.2.1 RFA方法 术前行常规彩超或超声造影检查,确认肿块的部位、大小、数目、边缘、血供情况及毗邻脏器。术前禁食6 h,术前15 min予哌替啶50 mg、非那根25 mg肌内注射。术中采用曲马多300 mg静脉滴注维持止痛,穿刺点采用2%利多卡因局麻,对于有慢性呼吸道疾病的患者术前加服可待因0.3 mg预防术中突发咳嗽,术中心电监护并准备好抢救用品。
制订方案:直径<3 cm的病灶采用一针穿刺,一点消融;直径>3 cm的病灶采用多针穿刺,多点消融的空间布针方案,多点消融的顺序是先消融深部的肿瘤再消融表浅的肿瘤,治疗范围力求完全覆盖病灶并超出病灶周边1.0~2.0 cm,最大限度地毁损病灶。右肝病灶一般从右腋前或右腋中线进针,左肝病灶一般从左肋弓内侧进针。彩超确认射频电极位置准确后先开启冷循环泵,然后选择阻抗模式进行RFA治疗,每个位点治疗时间设为12 min,然后根据病灶情况调整电极位置进行多次穿刺追加治疗,拔针时手动模式35 W缓慢退针进行针道消融。
1.2.2 FCM检测 新鲜采集的50 μl肝素抗凝血2份,分别加入抗CD3-PerCP/抗CD4-FITC/抗 CD25-PE单克隆抗体及抗CD3-PerCP/抗CD4-FITC单克隆抗体/小鼠 IgG1-PE各 15 μl,室温避光孵育20 min,加入2 ml溶血素,室温避光 10 min,1 000 r/min×5 min离心后弃上清液,加入 PBS 2 ml洗涤1次,1 000 r/min×5 min离心后弃上清液,加入PBS 250 μl,上机使用 CELL Quest软件进行检测,选择荧光强度 >100的CD4+CD25+作为Treg细胞,记录阳性细胞百分率,减去非特异性对照值。检测冷循环RFA治疗前、治疗后1、4、7和12个月后外周血调节性T细胞变化。Treg谷值为RFA治疗后每例患者外周血Treg百分率降低所达到的最低值。Treg达谷时间为从治疗开始至外周血Treg百分率降低所达到的最低值水平的时间(单位:月)。
1.2.3 疗效评价 治疗后1个月行增强CT或超声造影检查,评价病灶消融效果。参照2011年肝癌局部消融治疗规范的专家共识[4],肿瘤缓解(TR)包括:① 完全消融(CR),指肝脏三期CT或者超声造影随访,肿瘤所在区域为低密度(超声表现为高回声),动脉期未见强化;② 不完全消融(ICR),指肝脏三期CT或者超声造影随访,肿瘤病灶内局部动脉期有强化,提示有肿瘤残留。对治疗后有肿瘤残留者,可以进行再次消融治疗,若两次消融后仍有肿瘤残留,则确定为消融治疗失败,应该选用其他治疗手段。③ 肿瘤进展(TP),局部肿瘤进展(local tumor progression),指肿瘤完全消融后,在消融灶边缘出现新病灶,新病灶与消融灶相连;新病灶(new lesion),指肝内其他部位新发生的病灶;远处转移(distant metastasis),指出现肝外的转移灶。无进展生存期随访终点为治疗后肿瘤进展或者随访时间满12个月。如果肿瘤进展,及时换用其他方案治疗。
1.3 统计方法
数据采用SPSS13.0统计软件进行统计处理。计量资料Treg、Treg谷值经探索性分析,均服从正态分布,采用成组及配对t检验。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)及Kaplan-Meier生存函数的方法分析Treg细胞水平动态变化与肿瘤无进展生存期的关系。P<0.05为差异有统计学意义。
2 结果
2.1 Treg细胞与RFA疗效的关系
30例患者共用42支电极针,其中集束针4支。治疗后1个月行增强CT或超声造影检查示30例患者TR率 93.3%(28/30),其中CR 21例,PR 7例,PR行第2次补充消融治疗成功,TP率6.7%例(2/30)。RFA术前Treg(9.42±1.16)%, 术后1个月(6.55 ±0.97)%, 较术前显著下降 (t=15.325,P <0.01)。 经 12个月随访,TR 率 33.3%(10/30),TP 率66.7%例(20/30)。TR、TP组术前 Treg分别为(8.75±0.72)%、(9.76 ±1.20)%,两组比较差异有统计学意义 (t=-2.448,P=0.021), 提示RFA术前较低的Treg细胞值有较好的临床疗效。见图1、2。

图1 TR组CD4+CD25+Treg细胞
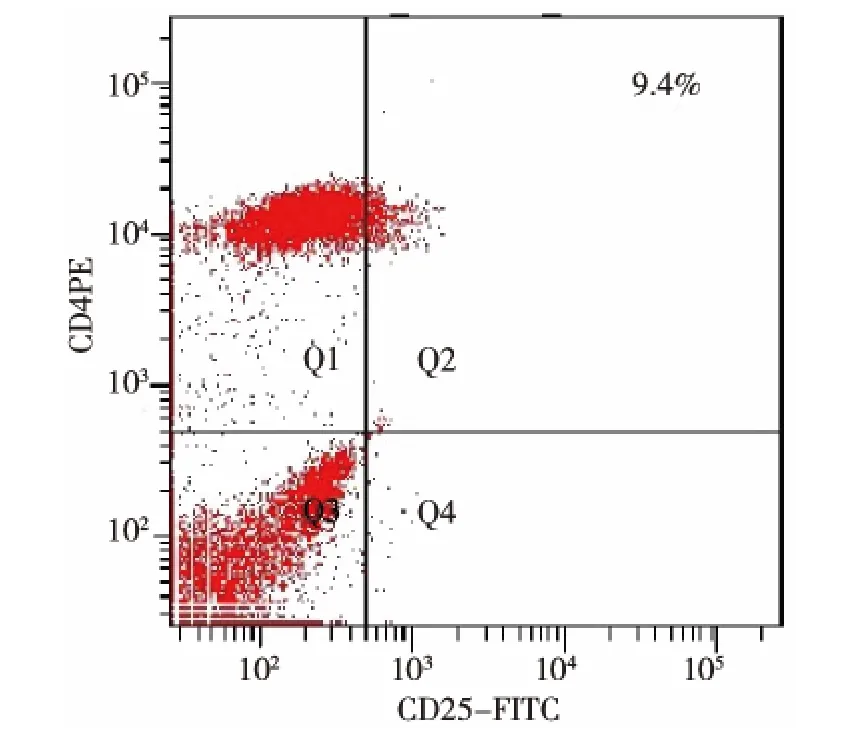
图2 TP组CD4+CD25+Treg细胞
2.2 Treg细胞水平动态变化与肿瘤无进展生存期的关系
采用ROC曲线的方法寻找Treg谷值、Treg达谷时间判断RFA术后肝癌患者肿瘤进展情况最优化的临界值水平。研究结果表明,Treg谷值及Treg达谷时间的曲线下面积(AUC)分别为0.795±0.084(P=0.009)、0.880 ± 0.061(P=0.001),说明两者对于预后判断具有一定程度上的准确性。Treg谷值以4.82%为最佳临界值时,灵敏度为90.0%,特异度为60.0%。Treg谷值大于4.82%提示预后欠佳。对于Treg达谷时间,5.5个月为最佳临界值,灵敏度为70.0%,特异度为85.0%。达谷时间大于5.5个月的患者预后更佳。见图3、4。

图3 Treg谷值预测RFA术后肿瘤进展的受试者工作曲线

图4 Treg达谷时间预测RFA术后肿瘤进展的受试者工作曲线
以上述2个最佳临界值为分类标准作Kaplan-Meier曲线表明,肝癌RFA术后Treg谷值≤4.82%的肿瘤无进展生存率优于Treg谷值>4.82%的患者,中位疾病无进展生产期(PFS)分别为10.1个月 (95%CI:8.926~11.217)、6.9 个月 (95%CI:5.227~8.648);Treg达谷时间 ≥ 5.5个月的患者预后优于Treg达谷时间 <5.5个月患者;中位PFS分别为 10.9 个月 (95%CI:9.891~11.842)、5.9 个月(95%CI:4.602~7.265)。 Log-rank检验分别为 χ2=5.207,P=0.023;χ2=22.079,P < 0.01。 见图 5、6。
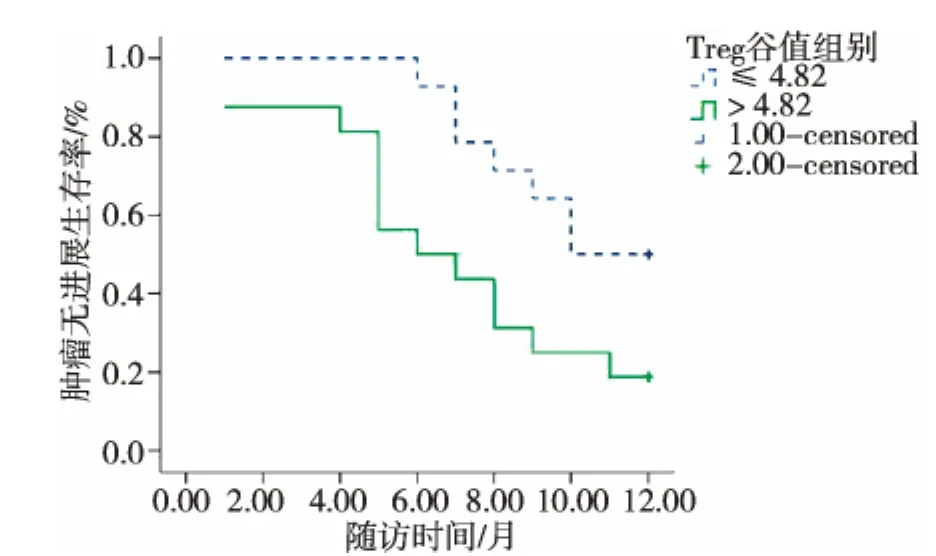
图5 不同水平的Treg谷值与肿瘤无进展生存的关系
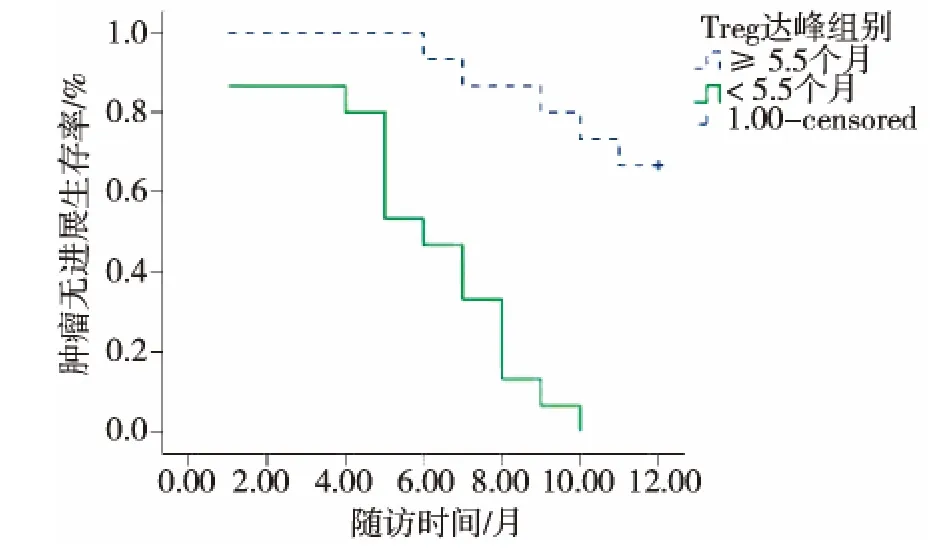
图6 不同水平的Treg达谷时间与肿瘤无进展生存的关系
3 讨论
Treg细胞是一群能抑制免疫功能的负性调控细胞,已成为肿瘤免疫学的热点问题之一。其中研究进展最快、对其特性了解最多的是CD4+CD25+Treg细胞。存在于肿瘤微环境中的肿瘤抗原和细胞因子对于Treg细胞的募集、扩增和Treg细胞的诱导有重要的作用[5]。CD25是IL-2受体的α链,是Treg细胞重要的表面标志之一。CD4+CD25+T细胞在正常人或小鼠外周血中占CD4+T细胞5%~10%,活化的CD4+CD25+T细胞可能通过抑制CD4+、CD8+T细胞的IL-2基因转录及表达从而抑制T细胞的活化和增殖[6]。研究发现转录因子Foxp3基因为CD4+CD25+Treg细胞生成和免疫调节功能发挥的关键基因,可作为Treg细胞的特异性标记[7]。近年研究发现,肿瘤周围有大量CD4+CD25+Foxp3+Treg细胞浸润,通过抑制或杀伤效应性CD8+或CD4+T细胞而抑制机体的抗肿瘤免疫,去除荷瘤鼠体内的Treg细胞可使抗肿瘤作用增强[8],进一步研究认为Treg细胞可通过增加分泌IL-10和转化生长因子β、减少分泌IL-2等干扰抗肿瘤的免疫反应[9],也可通过RANKL-RANK信号途径促进肿瘤转移[10]。对肿瘤临床特征分析,发现高Treg细胞水平与肝硬化背景和更高的TNM分期相关[11]。采用COX模型分析发现Foxp3+Treg细胞水平可以预测肝癌的复发及生存期[12]。本研究也发现RFA术后随访12月,肿瘤缓解组术前Treg细胞水平显著低于肿瘤进展组,表明RFA术前Treg细胞水平与预后相关。
肝肿瘤RFA治疗后短时间内在坏死区周围间质带热休克蛋白增加,激活机体免疫反应。数周或数月后可检测到肿瘤抗原特异性CD4、CD8 T细胞升高[13]。对乳腺癌大鼠模型,RFA治疗后在肿瘤边缘区可检测到高水平NK细胞浸润,增加热休克蛋白表达和激活caspase-3酶,同时循环Treg细胞水平显著下降[14]。对大鼠肝癌模型应用手术切除及RFA治疗,分析Treg细胞水平变化,发现手术切除后Treg细胞水平较RFA治疗后明显升高,并且Treg细胞水平与肿瘤大小呈正相关,认为RFA在术后恢复阶段可稳定Treg细胞水平,而手术切除能激活免疫抑制反应促进肿瘤生长[15]。肺癌RFA治疗后可以下调Treg细胞水平,与RFA的远期疗效相关[16]。
本课题组所采用的冷循环RFA为新一代RFA治疗仪。冷循环电极采用冷冻灌注液从内部冷却电极,使临近电极针的组织发热减轻,防止其炭化,从而增加总的能量,增加热凝固效应。本研究通过观察RFA治疗后HCC患者调节性T细胞表达的动态变化,首次探讨调节性T细胞变化对HCC患者预后的影响。发现RFA可降低HCC患者Treg细胞水平。ROC表明Treg谷值以4.82为最佳临界值时,Treg达谷时间以5.5个月为最佳临界值。采用Kaplan-Meier曲线分析表明,肝癌RFA术后Treg谷值≤4.82的肿瘤无进展生存率优于Treg谷值>4.82的患者;Treg达谷时间≥5.5个月的患者预后优于Treg达谷时间<5.5个月患者。
综上所述,冷循环RFA治疗可以下调HCC患者Treg细胞水平,进一步对其动态变化分析发现Treg谷值及Treg达谷时间在一定程度上反映RFA治疗HCC患者的预后。冷循环射频消融治疗所诱导的免疫机制可能为影响肝癌患者预后的重要因素之一。
[1] Forner A, Llovet JM, Bruix J.Hepatocellular carcinoma[J].Lancet, 2012, 379: 1245-1255.
[2] Shiina S, Tateishi R, Arano T, et al.Radiofrequency ablation for hepatocellular carcinoma:10-year outcome and prognostic factors[J].Am J Gastroenterol, 2012, 107: 569-577; quiz 578.
[3] Haen SP, Pereira PL, Salih HR, et al.More than just tumor destruction:immunomodulation by thermal ablation of Cancer[J].Clin Dev Immunol, 2011: 160250.
[4] 陈敏山.肝癌局部消融治疗规范的专家共识 [J].实用肝脏病杂志,2011,19:243-245.
[5] Ondondo B,Jones E,Godkin A,et al.Home sweet home:the tumor microenvironment as a haven for regulatory T cells[J].Front Immunol, 2013, 4: 197.
[6] Baecher-Allan C,Brown JA,Freeman GJ,et al.CD4+CD25high regulatory cells in human peripheral blood [J].J Immunol,2001,167:1245-1253.
[7] Yagi H,Nomura T,Nakamura K,et al.Crucial role of FOXP3 in the development and function of human CD25+CD4+regulatory T cells[J].Int Immunol, 2004, 16: 1643-1656.
[8] Hindley JP, Jones E, Smart K, et al.T-cell trafficking facilitated by high endothelial venules is required for tumor control after regulatory T-cell depletion [J].Cancer Res, 2012,72:5473-5482.
[9] Wu CP,Qing X,Wu CY,et al.Immunophenotype and increased presence of CD4(+)CD25(+) regulatory T cells in patients with acute lymphoblastic leukemia [J].Oncol Lett, 2012, 3: 421-424.
[10] Tan W, Zhang W, Strasner A, et al.Tumour-infiltrating regulatory T cells stimulate mammary Cancer metastasis through RANKL-RANK signalling[J].Nature, 2011, 470: 548-553.
[11] Zhou J,Ding T,Pan W,et al.Increased intratumoral regulatory T cells are related to intratumoral macrophages and poor prognosis in hepatocellular carcinoma patients[J].Int J Cancer,2009,125:1640-1648.
[12] Lin SZ, Chen KJ, Xu ZY, et al.Prediction of recurrence and survival in hepatocellular carcinoma based on two Cox models mainly determined by FoxP3+regulatory T cells[J].Cancer Prev Res (Phila), 2013, 6: 594-602.
[13] Widenmeyer M, Shebzukhov Y, Haen SP, et al.Analysis of tumor antigen-specific T cells and antibodies in Cancer patients treated with radiofrequency ablation [J].Int J Cancer, 2011,128:2653-2662.
[14] Todorova VK, Klimberg VS, Hennings L, et al.Immunomodulatory effects of radiofrequency ablation in a breast Cancer model[J].Immunol Invest, 2010, 39: 74-92.
[15] Gao HJ, Zhang YJ, Liang HH, et al.Radiofrequency ablation does not induce the significant increase of CD4 (+) CD25 (+)Foxp3 (+)regulatory T cells compared with surgical resection in Hepal-6 tumor model [J].Arch Immunol Ther Exp (Warsz),2013,61:333-340.
[16] Fietta AM, Morosini M, Passadore I, et al.Systemic inflammatory response and downmodulation of peripheral CD25+Foxp3+T-regulatory cells in patients undergoing radiofrequency thermal ablation for lung Cancer [J].Hum Immunol, 2009, 70:477-486.