肝动脉灌注贝伐单抗治疗大鼠肝泡状棘球蚴病后血管内皮生长因子的动态变化
2014-11-01桑泽杰朱帝文纪卫政顾俊鹏张海潇任伟新
桑泽杰, 朱帝文, 纪卫政, 顾俊鹏, 张海潇, 任伟新, 温 浩
肝泡状棘球蚴病(hepatic alveolar echinococcosis,HAE)中病原微生物在肝脏内具有向外突出生长特点,具有恶性浸润的增殖方式,使该病有“第二肝癌”、“虫癌”之称。绝大多数患者确诊时已属晚期,手术切除率低。口服和静脉注射阿苯达唑疗效低,且不良反应严重[1-2]。世界卫生组织将寻找治疗包虫病其他方法列为亟待解决的重大研究课题[3]。临床及实验研究发现,HAE病灶及边缘带主要由肝动脉供血,门静脉部分地参与供血,且与微血管密度(MVD)、血管内皮生长因子(VEGF)呈正相关[4-8]。采用介入方式经肝动脉灌注贝伐单抗(bevacizumab)是治疗 HAE 的新方法[4,7-9],但是介入栓塞术后血管再生问题困扰着介入医师。贝伐单抗是第1个获得美国FDA批准上市的抑制肿瘤血管生成的药物,是VEGF的IgG1抗体,可以与之高亲和性结合阻断VEGF介导的血管生成,降低血管通透性,抑制肿瘤生长[10]。抗血管药物的实验研究虽然在肝癌研究中得到广泛应用,但在HAE的治疗中少见报道。本实验基于此假设进行贝伐单抗抑制HAE大鼠血清VEGF的探索性研究,了解贝伐单抗对HAE的治疗作用,为进一步研究贝伐单抗治疗HAE提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取体质量 (0.20±0.05)kg的SPF级Wistar雌性大鼠[新疆医科大学实验动物中心供给, 合格证号: FYXK(新)2003-0001],参照相关文献制作Wisar大鼠的HAE动物模型[11]。用超声诊断和筛查大鼠HAE的感染状况,并证实HAE在大鼠肝实质内成功接种[12]。选取非钙化型HAE。
1.1.2 器材 氯胺酮、地西泮、阿托品、GE超声诊断仪、EMS切片机、无水乙醇(分析纯)、甲醛溶液(分析纯)、贝伐单抗(bevacizumab,商品名 Avastin,美国Roche公司)。人VEGF检测试剂盒(武汉博世德生物公司)。
1.2 方法
1.2.1 实验方法
1.2.1.1 实验准备:参照相关文献配制Wistar大鼠麻醉药物,把氯胺酮、地西泮、阿托品按1∶1∶0.5配伍,并用0.9%氯化钠溶液按1∶1配制并稀释麻醉药物,按7 ml/kg行腹腔麻醉给药,麻醉大鼠后背,脱毛并仰卧固定在鼠板上,参照外科标准手术腹部备皮并常规消毒、铺巾,手术刀在剑突下1 cm略偏左切3~5 cm纵行切口,逐层切开皮肤入腹并游离肠管,暴露HAE病灶及大鼠腹腔干动脉。视野范围内保持清晰,并在直视下超选择性植入自制导管在肝动脉内部备用。
1.2.1.2 分组及处理:HAE种植6个月后行超声检查,40只成功接种HAE,病灶直径达(1.0±0.2)cm,随机分成空白对照组和实验组,分别经肝动脉灌注0.9%氯化钠溶液和贝伐单抗。术后两组结扎肝固有动脉,分别于术后7、14、21和28 d鼠尾静脉取血,在最后1 d取HAE组织缘带标本,将所得标本常规置甲醛中固定48 h,石蜡包埋,连续4 μm切片(每份标本5张),脱蜡、染色,在光镜下观察HAE病理组织。光镜下观察病理切片依据大鼠泡球蚴角质层、生发层的病理学形态改变及育囊发育情况分为3级[13]。 0级(基本正常):泡状棘球蚴结构基本正常,多数见育囊或芽生结构,育囊内有数量不等的原头节,钙颗粒形态正常。Ⅰ级(变性改变):泡状棘球蚴结构存在,角质层和生发层可辨认,组织普遍变性肿胀,很少见育囊和原头节。Ⅱ级(坏死):泡状棘球蚴结构失常,生发层细胞核固缩、溶解或消失,育囊与原头节少见。偶见钙颗粒,形态模糊。重者有纤维组织增生和炎性细胞浸润。
1.2.2 血清学及病理学检测
1.2.2.1 血清VEGF检测:采用酶联免疫吸附法(ELISA)法检测血清VEGF,在反应孔加入稀释液,每孔加入50 μl标准品或样品,于空气恒温摇床上孵育2 h。倒出微孔板中液体,每孔加入400 μl冲洗缓冲液后倒出,再加入冲洗缓冲液,反复洗涤4次。每孔加入200 μl VEGF结合物孵育2 h后洗涤。每孔加入200 μl基质溶液,孵育30 min。加底物液显色后终止反应。血清VEGF放在ELISA检测仪上,于450 nm处,用空白的对照孔调零点后测各孔吸光度(A)值,A值经过Curve Expert处理获得标准曲线和回归方程绘制标准曲线,并通过标准曲线 读出待测样本的浓度。
1.2.2.2 肝功能检测:检测两组大鼠治疗前后的肝功能各项指标。
1.3 统计学处理
采用SPSS17.0软件包进行统计学分析。计量资料数据用表示,若资料服从正态分布,各组方差齐,采用方差分析,检验水准α=0.05。
2 结果
2.1 大鼠HAE的病理改变
实验过程中,对照组死亡2只,实验组死亡1只。在药物灌注后第28天,对照组病理变化以0级(基本正常)为主(9/18),光镜下可见泡状棘球蚴结构基本正常,囊壁生发层、角质层生长良好;Ⅰ级(变性)7只,Ⅱ级(坏死)2只,光镜下角质层、生发层模糊,部分生发层细胞核溶解。实验组以Ⅰ级(变性)为主(11/19),光镜下可见泡状棘球蚴结构失常,角质层、生发层普遍变性、分离或断裂、脱落,皮层变薄,部分结构被破坏,囊泡内原头节变形、崩解。肝细胞可见少量变性、坏死和纤维组织增生;0级(基本正常)改变6只,Ⅰ级(变性)改变2只。
2.2 肝动脉灌注贝伐单抗对肝功能的影响
术后第7天,实验组天冬氨酸转氨酶(AST)为(169.21 ± 7.71)u/L,丙氨酸转氨酶(ALT)为(44.21 ±2.08)u/L, 与对照组分别为 (167.21 ± 4.27)u/L、和(46.15±3.04)u/L比较,差异无统计学意义 (P>0.05)。此后,实验组AST和ALT水平逐渐下降,第14天时略高于正常水平,AST为 (119.41±7.21)u/L,ALT 为 (38.53 ± 2.31)u/L, 而 对 照组 AST 为(115.41 ± 5.35)u/L,ALT 为(37.13 ± 2.42)u/L,组间差异无统计学意义 (P>0.05)(图1、2)。 实验组第21、28天 AST分别为(106.41± 5.25)u/L 和(106.32±4.25)u/L,ALT 分别为 (32.53 ± 3.24)u/L 和 (33.47 ±3.04)u/L,恢复至正常水平,而对照组AST分别为(105.32 ± 7.33)u/L 和(104.21 ± 2.26)u/L,ALT 分别为(33.32 ± 2.31)u/L 和(32.12± 3.34)u/L,组间差异均无统计学意义(P>0.05)。
2.3 血清VEGF表达
对照组和实验组手术前、后的VEGF表达见表1。
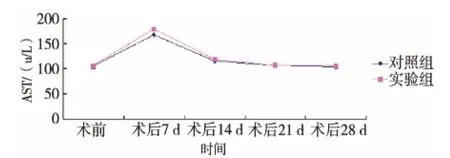
图1 两组术前及术后天冬氨酸转氨酶的变化
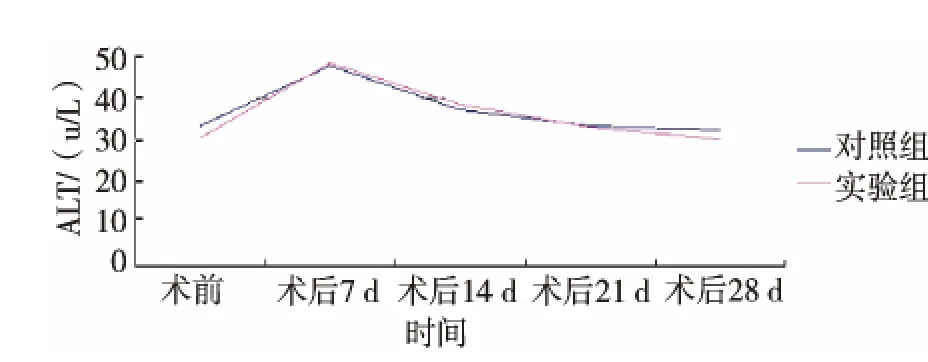
图2 两组术前及术后丙氨酸转氨酶的变化
表1 两组大鼠手术前、后的VEGF表达

表1 两组大鼠手术前、后的VEGF表达
注:与术前及对照组比,aP<0.05;与术后28 d比bP<0.05
?
3 讨论
开腹注射HAE造模要有肝细胞增生和肝硬化背景。HAE以肝动脉供血为主,而且全身免疫系统未被彻底破坏,因此与人体原发性HAE的临床情景较相似[14-15]。HAE血管造影动脉期表现为动脉增粗、迂曲、包绕,呈“手握球”征象[4];在毛细血管期可见病灶呈环行染色,中央区无染色。间接门脉造影表现可见由于肿块效应所致的门脉分支受压推移改变。HAE病灶与周围肝组织间边缘浸润带区域血流灌注高于病灶内部及周围肝脏组织,CT灌注成像及成像参数与微血管密度 (MVD)、VEGF-a呈正相关,大鼠HAE病灶对周边肝组织是以挤压及压迫为主,主要表现为缺氧、缺血的病理表现,周边浸润增殖区存在丰富的微血供,且HIF-1α与CD34均呈高表达状态,与超声造影后的环状增强区与MVD的结果一一对应[8,16]。 实验组术后 2、3 周血清 VEGF表达持续下降,与术前及对照组相比,术后4周恢复,与文献报道一致,说明血清VEGF在术后得到持续抑制。我们推测,HAE病灶边缘带的丰富血供与血清VEGF高表达呈正相关,而HAE病灶内部血供的缺失与VEGF低表达相一致,仍需进一步研究证实。
贝伐单抗是人工合成的针对VEGF的IgG1型单克隆抗体,特异性与内皮细胞VEGF上的受体信号结合[10],阻断 MAPK/ERK通路,以及上调 Bax/Bc-l 2比率,抑制VEGF的抗凋亡作用而促进凋亡,破坏新生血管内皮细胞,阻断边缘带营养供应而“杀死”HAE,同时对正常血管几无影响,对正常肝细胞也无影响。根据Folkman等[17]的理论,当肿瘤局部乏氧时,肿瘤血管的生长一方面依赖于肿瘤细胞释放血管生长因子激活血管内皮细胞的增殖和迁移;另一方面内皮细胞旁分泌血管生成促进因子刺激肿瘤细胞的生长,尤其是VEGF在其中起着极其重要的调节作用[6]。HAE病灶与周围肝组织间边缘浸润带高表达MVD和VEGF。抗血管生成药物能下调体内的促血管生成因子,上调体内的血管生成抑制因子,通过改变血管生成调节因子的平衡关系,发挥抗血管生成作用[7-8]。本实验将贝伐单抗肝动脉给药,相对于静脉给药既经济,又减低对机体的影响,而且贝伐单抗可从分子水平抑制血管新生,使血管内皮细胞休眠、衰老或凋亡,以间接抑制HAE边缘带细胞的生长。我们通过建立大鼠HAE模型并行选择性肝动脉灌注术,发现术后HAE血清VEGF明显下降,尤以术后7 d最为明显,术后28 d又恢复至原有水平。病理学结果表明,HAE病灶病理改变及病灶大小不明显,边缘带组织VEGF表达情况需进一步探究。本实验尚不能证明血清VEGF与HAE转移及预后关系。
从目前已进行的相关实验研究发现,介入治疗HAE可在较短时间内从病理学角度观察到泡球蚴组织发生变性、坏死[7,9,18],说明通过介入技术治疗HAE是切实、可行的。贝伐单抗经肝动脉灌注治疗大鼠HAE的实验表明,贝伐单抗可明显减缓HAE的VEGF表达,因为VEGF主要在缺氧的细胞及其周围基质细胞中表达,贝伐单抗不仅破坏了HAE组织细胞本身,还破坏了HAE赖以生存的微环境,从而抑制HAE的迅速生长,但是单纯采用贝伐单抗不能杀死HAE,只能延缓生长速度,因此,联合阿苯达唑治疗将是下一步研究的重点。
[1] Ammann RW,Hirsbrunner R,Cotting J,et al.Recurrence rate after discontinuation of long-term mebendazole therapy in alveolar echinococcosis (preliminary results)[J].Am J Trop Med Hyg, 1990, 43: 506-515.
[2] Nourbakhsh M,Shemshaki H,Zarezadeh A,et aI.Recurrent hydatosis at the site of non-union humerus fracture[J].Int J Prev Med,2012,3:660–663.
[3] Reittner P, Szolar DH, Schmid M.Case report.Systemic manifestation of Echinococcus alveolaris infection [J].J Comput Assist Tomogr, 1996, 20: 1030-1032.
[4] 任伟新,肖湘生,陈 鹏,等.肝泡状棘球蚴病的DSA表现及介入治疗[J].介入放射学杂志, 2004, 13: 496-498.
[5] 任伟新,肖湘生.肝泡状棘球蚴病门脉血供的实验研究[J].中国介入影像与治疗学,2007,4:142-147.
[6] 樊玉祥,任伟新,迪理木拉提·巴吾冬,等.DSA评价大鼠肝泡状棘球蚴病血供 [J].中国介入影像与治疗学,2012,01:37-40.
[7] 朱帝文,穆 民,任伟新,等.经门静脉药物灌注化疗栓塞治疗大鼠肝泡状棘球蚴病的电镜观察 [J].介入放射学杂志,2013, 22: 674-677.
[8] 王 静,任 波,刘文亚,等.肝脏泡球蚴病CT灌注成像与微血管密度及血管内皮生长因子的相关性分析[J].中华放射学杂志,2011,45:1036-1039.
[9] 樊玉祥,任伟新,迪力木拉提·巴吾冬,等.阿苯达唑微球肝动脉灌注对大鼠肝泡状棘球蚴病的治疗作用[J].中国寄生虫学与寄生虫病杂志,2011,06:415-418.
[10] Zhang W, Fulci G, Buhrman JS, et al.Bevacizumab with angiostatin-armed oHSV increases antiangiogenesis and decreases bevacizumab-induced invasion in U87 glioma[J].Mol Ther, 2012, 20: 37-45.
[11]张金辉,温 浩.原发性肝泡球蚴动物模型的建立 [J].中国局解手术学杂志,2000,9:11-13.
[12]朱帝文,任伟新,顾俊鹏,等.超声在筛检大鼠肝泡状棘球蚴病模型中的应用价值 [J].中国医学影像技术,2009,25:363-365.
[13]陆永绥,李清华,张伟明.临床检验自动化分析仪器标准化操作规程[M].杭州:浙江大学出版社,2006:9-15.
[14] Rajewsky MF,Dauber W, Frankenberg H.Liver carcinogenesis by diethhylnitrosamine in the rat[J].Science, 1966, 152: 83-85.
[15] Liu YF, Zha BS, Zhang HL, et al.Characteristic gene expression profiles in the progression from liver cirrhosis to carcinoma induced by diethylnitrosamine in a ratmodel[J].J Exp Clin Cancer Res, 2009, 28: 107.
[16] Tao S,Qin Z,Hao W,et al.Usefulness of gray-scale contrastenhanced ultrasonography (SonoVue®) in diagnosing hepatic alveolar echinococcosis [J].Ultrasound Med Biol, 2011, 37:1024-1028.
[17] Folkman J,MERLERE,Abernathy C,et al.Isolation of atum or factor responsible to angiogenesis [J].J Exp Med, 1971, 133:275-288.
[18]桑泽杰,朱帝文,纪卫政,等.射频消融治疗大鼠肝泡状棘球蚴病及病理改变[J].介入放射学杂志,2014,01:58-61.