细胞的迁移性,趋化性和侵袭性的检测方法
2014-11-01HilaryShermanPilarPardoToddUpton
Hilary Sherman,Pilar Pardo,Todd Upton
细胞的迁移性,趋化性和侵袭性的检测方法
Hilary Sherman,Pilar Pardo,Todd Upton
200040 上海,康宁生命科学亚洲技术中心
细胞的迁移性,是指细胞受到外来信号的刺激,由一个地方迁移到另一个地方的特性,通常发生在比如伤口愈合、细胞分化、胚胎发育和肿瘤转移的过程中。细胞的侵袭性和迁移性相似,但不同的是,发生侵袭时,细胞需要降解一层胞外基质(ECM)或者基底膜基质(BME)进而迁移到一个新的地方。当正常细胞发生炎症反应,或者肿瘤细胞发生转移时都需要细胞的侵袭性。由此可见,了解这些特性的发生机制,对整个生物学研究有着重要而深远的意义。
由康宁公司研发的 transwell 培养设备的出现,为在体外研究细胞的趋化性和侵袭性提供了一种相对简便的方法。通常的侵袭检测系统是由胶原蛋白、纤连蛋白、层黏连蛋白等复杂的胞外基质和基底膜基质组成。还有更复杂的检测手段是在复合蛋白层膜上培养单层表皮细胞。将分泌多种生长因子的细胞培养在可渗透层膜上作为趋化源的系统,也可以用于趋化性检测或者更繁杂的侵袭性检测。
下面所述的方法步骤是基于 BME 层膜的细胞侵袭性检测,附以趋化性检测为例(对于不含 BMC 和 ECM 层膜的侵袭性检测也遵循类似的方法)。这里具体列出了以康宁 96 孔transwell 设备为例的实验参数。对于不同规格的系统可以根据下面表格中的数据调整材料或试剂的用量。
1 材料与方法
1.1 材料
1.1.1 细胞系 非侵袭性 MCF-7 细胞系(人类乳腺癌细胞)、侵袭性 HT1080 细胞系(人类纤维肉瘤细胞)均购自美国 ATCC。
1.1.2 检测平板类型 8 μm 孔径的 96 孔 HTS transwell 培养系统、96 孔黑板、96孔黑色固相微型板、8 μm 孔径的 6 孔transwell 培养系统、12 μm 孔径的 12 孔 transwell 培养系统、8 μm 孔径的 24 孔 transwell 培养系统、超低黏附 6 孔和 24 孔平板均为康宁公司产品。
1.1.3 试剂 5 × 基底膜提取物(BME)包被溶液、10 × 包被缓冲液、10 × 细胞裂解液均为美国 Trevigen 公司产品;用来消化收集细胞的HyQtase 消化液购自美国 Hyclone 公司;Calcein AM 钙荧光素乙酰氧基甲酯(分子探针)以 1.67 μg/ml 的浓度溶解在 DMSO 中;含有 10% 胎牛血清的 IMDM 培养基、不含血清但含有 1 × ITS 的 IMDM 培养基购自美国 Invitrogen 公司。
1.1.4 设备 实验所需主要设备有37 ℃二氧化碳培养箱、生物安全柜和荧光检测仪(具有 485 nm 的激发光和 520 nm 发射光的吸收检测功能)。
1.2 方法
将细胞培养到足够的数量并需单独培养一盘相对浓度较低的细胞,以便做标准曲线检测。
第 1 天:将细胞进行饥饿处理,同时用基底膜提取物包被 transwell 设备;第 2 天:将细胞平铺在 transwell 中,并用 FBS 作为诱导剂,可以同时考虑多加一个实验组用于绘制标准曲线;第 3 天:检测通过基底膜的细胞数量,并绘制标准曲线。
1.2.1 细胞培养 细胞的密度应该低于 80%,这样可以保证经过 24 h 饥饿处理的细胞也不会长得过于密集,吸去含有血清的细胞培养基,轻轻地用 PBS 清洗细胞去除残留的血清,用不含血清的 IMDM 培养细胞,放置于培养箱中培养 24 h。
1.2.2 BME的包被 在检测过程中,不同的细胞系所需的 BME 的最适浓度有所不同。对于特定的细胞系,建议做一个梯度检测(比如从 0.1 × 到 1 × 稀释)从中找出最适浓度。只有在最适的 BME 浓度下,才可以看到细胞的侵袭性和非侵袭性在趋化诱导作用下的最大差异。
⑴在无菌条件下,用无菌去离子水将 10 × 的包被储液稀释成 1 ×。
⑵将 5 × 的 BME 储液放到 37 ℃水浴中,轻轻搅动瓶子使其完全融化。融化后的 BME 储液应尽快稀释或者放在冰上,否则其在稍高温度下将会变得非常黏稠。
⑶用 1 × 的包被液将 5 × 的BME 稀释到最适的浓度。
⑷用稀释后的 BME 溶液包被 transwell(表 1)。
⑸将包被后的培养板放到 37 ℃二氧化碳培养箱中过夜。
1.2.3 平铺细胞并绘制标准曲线 以 HTS-96 transwell 为例详细介绍细胞侵袭性检测的步骤,其也同样适用于其他不同规格的 transwell。实验过程中还需要另外再加一个阳性对照,即不经过 BME 包被的 transwell 微孔,用于计算具有侵袭性的总的细胞数。
⑴使用 HyQtase 溶液或者其他合适的细胞消化液收集细胞。
⑵使用不含血清的培养基或者胰蛋白抑制剂终止消化。

表 1 推荐的 BME 溶液包被体积
注:*Corning transwell 6.5 mm 直径的小室(24 孔板用),每包 12 个。
⑶离心去除上清,用不含血清的培养基重悬细胞沉淀。
⑷对细胞计数并以合适的浓度将细胞稀释于含有血清的培养基中(表 2)。

表 2 推荐的细胞接种密度和体积
⑸将微孔中多余的 BME 吸出,同时将细胞平铺在上面。
⑹留出至少一个孔不加细胞,作为阴性对照,以扣除背景值(图 1)。

非侵袭性 MCF-7 细胞侵袭性HT1080 细胞 123456789101112 A B C D E F G H 不含 BME 的无血清培养基 含 BME 的无血清培养基 不含 BME 的培养基+ 10% FBS 含 BME 的培养基+ 10% FBS 空白对照
⑺在加有细胞的孔中,一些用不含血清的培养基培养(即没有趋化诱导),另外一些用含有血清的培养基培养(即含有趋化因子),具体参照图 1。
⑻根据所使用的细胞系的不同,培养 12 ~ 24 h。
1.2.4 绘制标准曲线
⑴对于每一次的检测和每一种细胞系都需要做出一个相应的标准曲线。
⑵将细胞消化并收集到一个 EP 管中。
⑶用超纯去离子水将 10 × 细胞裂解液配制成 1 × 细胞裂解液(1 × CDS)。
⑷将 Calcein AM 钙荧光素乙酰氧基甲酯(50 μg)融化,加入 30 μl 的 DMSO 配制成工作浓度。
⑸离心收集细胞并重悬于 1 × CDS。
⑹将细胞稀释成一系列不同浓度的细胞悬液,从最高浓度依次到不含细胞的 1 × CDS 溶液。可以参照表 3 中推荐的细胞浓度梯度来绘制标准曲线。

表 3 96 孔板中做标准曲线所需的细胞量
⑺从每一个浓度梯度中,吸取 50 μl 到 96 孔黑板(如果使用 96 孔 HTS 平板,选择康宁 Cat.No.3583 产品,其他的选择康宁 Cat.No.3916,每组做 3 个重复。
⑻用 1 × CDS 稀释 Calcein AM 钙荧光素乙酰氧基,按照每 1 ml 1 × CDS 加入 2.4 μl Calcein AM 溶液的比例进行稀释。
⑼在绘制标准曲线的 96 孔板上,每孔加入 50 μl 的 Calcein AM/CDS 混合液。
⑽将 96 孔板在室温下避光孵育 1 h,然后检测其在 485 nm 激发光下 520 nm 处的荧光强度。
⑾对于每一个浓度梯度,计算出相应的平均相对荧光强度(RFU),之后扣除背景值。
⑿绘制细胞浓度和 RFU 相关的标准曲线。
⒀添加线性趋势线(截距设为 0)y = mx + b,y 代表细胞数;x 代表 RFU。如图 2 所示。

细胞数6 × 1045 × 1044 × 1043 × 1042 × 1041 × 1040 2.00E 4.00E 6.00E 8.00E 1.00E + 03 + 03 + 03 + 03 + 04 平均相对荧光强度
1.2.5 检测
⑴用超纯去离子水将 10 × 细胞裂解液稀释成 1 ×(1 × CDS)。
⑵将 Calcein AM 钙荧光素乙酰氧基甲酯(50 μg)融化,加入 30 μl 的 DMSO 配制成工作浓度。
⑶用 1 × CDS 稀释 Calcein AM 钙荧光素乙酰氧基,按照每 1 ml 1 × CDS 加入 1.2 μl Calcein AM 溶液的比例进行稀释。混合液应避光保存。对于不同规格的 transwell,可以参照表 4 加入合适量的混合液。

表 4 推荐的 Calcein AM/1 × CDS 溶液体积
⑷从检测板和 transwell 中吸出多余的培养基。
⑸用清洗缓冲液分别清洗 transwell 一次和检测孔板 2 次。具体的量参照表 5。

表 5 洗脱液体积
⑹加入 Calcein AM/CDS 混合液到检测板的微孔中。
⑺将 transwell 放到浸满 Calcein AM/CDS 混合液的检测板中。确保在 transwell 底部和孔板底部没有空气残留。之后将整个检测板放置于 37 ℃二氧化碳培养箱中温育 30 min。
⑻30 min 后,轻轻敲打孔板的侧面,之后放回培养箱中再次温育 30 min。
⑼从 96 孔检测板中移出插入托盘,并轻轻晃动以混匀细胞溶液。之后可以将检测板直接放入检测仪上进行荧光强度的检测。
1.3 数据分析
1.3.1 收集数据。参见表 6a。
1.3.2 除背景值。背景即为没有包被和细胞的对照组。参见表 6b。
1.3.3 根据标准曲线的公式将RLU 的值转换成细胞数量。参照表 6c。
1.3.4 根据表 6c 中的细胞数量计算出通过基底膜的总的细胞数,然后乘以表 4 中的倍增系数,得出每孔侵袭细胞的百分比(表 6d)。
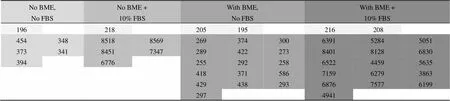
表 6a HT1080 细胞采用 96 孔 HTS transwell 板在读板机上读取的原始 RFU 数据示例(MCF-7 的数据未列出)
No BME,No FBSNo BME +10% FBSWith BME,No FBSWith BME +10% FBS 196 218 205195 216 208 45434885188569269374300639152845051 37334184517347289422273840181286830 394 6776 255292258652244595635 418371586715962793863 429438293687675776199 297 4941
表 6b 扣除背景之后的数据范例

No BME,No FBSNo BME +10% FBSWith BME,No FBSWith BME +10% FBS 0 0 0 0200*00 212* 25815283008351 69174100619750274839 17714582337128 8922273818979166618 198 6558 55 9258631042475426 218171386694760676651 22923893666473645987 97 4747 *: Average of multiple blank wells from table 6a, use for backgroundsubtract of test wells.
表 6c 根据标准曲线计算的每孔细胞量

No BME,No FBSNo BME +10% FBSWith BME,No FBSWith BME +10% FBS Solve for cell number (from figure 2): y = 5.9673x + 1236.5 277621445076551069164822751833382163123430112 229321025036543771176825611672501034847440728 2418 40370 156517851583388902658033615 253722573540426913744040925 260326571791410034518036963 1815 29563
表 6d 每孔侵袭细胞百分比

No BME,No FBSNo BME +10% FBSWith BME,No FBSWith BME +10% FBS Calculate % invasion = (cell concentration / initial cell seed)× multiplication factor (Table 4) 5.6%4.3%101.5%102.1%3.3%4.5%3.7%76.4%62.5%60.2% 4.6%4.2%100.7% 87.5%3.5%5.1%3.3%100.2%96.9%81.5% 4.8% 3.1%3.6%3.2%77.8%53.2%67.2% 5.1%4.5%7.1%85.4%74.9%81.9% 5.2%5.3%3.6%82.0%90.4%73.9% 3.6% 59.1%
1.3.5 通过基底膜的细胞数除以起始细胞数可以得到所有孔在相应条件下的侵袭细胞百分比,从而得出结果(表 6e 和图 3)。
表 6e 细胞侵袭和趋化性的平均百分比

No BME1 × BME 4.7% 4.4%–FBS 94.2%74.3%+FBS STD % invasion HT1080 No BME1 × BME 0.5% 1.2%–FBS 9.8%13.8%+FBS
2 讨论
⑴对于非侵袭性细胞系,无论是否有趋化因子的诱导,都应该没有或者几乎没有细胞的迁移或者运动。
⑵在不含血清的培养基中生长的侵袭性细胞的迁移率应该低于 10%。

图 3 根据表 6e 数据做的柱状图
(包含 MCF-7 的数据)
⑶当使用 FBS 进行趋化诱导时,细胞在 BME 包被和非包被的情况下,其迁移率的差异性应该≥ 20%。
2014-09-01
10.3969/cmba.j.issn.1673-713X.2014.05.015
