CeO2改性对CuO/SBA-15催化剂结构及其催化活性的影响
2014-10-29张洪亮汤常金
张洪亮,汤常金,高 飞,董 林,
(1.安徽工业大学现代分析测试中心,安徽马鞍山243002;2.南京大学化学化工学院,江苏南京210093;3.南京大学现代分析中心,江苏南京210093)
CO氧化反应在汽车尾气控制、燃料电池、催化燃烧[1]、气体传感器、封闭体系内微量CO的消除、呼吸用气体以及激光器中气体纯化[2]、石油化工等方面具有重要的实用价值。由于CO氧化反应具有代表性而且过程比较简单,常被科研者用作模型反应来研究催化剂的表面反应,进而研究催化剂结构与性能之间的关系。因此研究催化剂的CO氧化反应成为催化领域的热门课题之一[3]。
贵金属催化剂和过渡金属氧化物常被用来催化CO氧化反应。两个体系的反应机理不同。贵金属催化剂寿命长,活性好[4],但由于价格昂贵,资源缺乏,而且容易导致硫中毒,为此研究者一直致力于寻求低成本、高活性的非贵金属催化剂替代贵金属催化剂。铜基氧化物催化剂具有多种催化功能,且价廉易得、具有比较好的催化活性,成为有可能取代贵金属并具有应用前景的催化剂之一[5]。为了提高CuO的催化活性,人们尝试了多种方法,如使用不同载体、改变CuO的负载量、以及制备复合氧化物等。其中制备大比表面的载体负载CuO是提高催化活性的常用方法。介孔SiO2材料具有很大的比表面,其中SBA-15孔壁厚,其热稳定性和水热稳定性较高,预示着SBA-15具有更广泛的应用前景[6]。因而SBA-15常被作为载体负载活性物种用于各种催化反应。
CuO/SBA-15在CO氧化反应中催化活性比较低,常使用添加助剂的方法来提高其活性。常用的助剂有Mn2O3[7]、CeO2[8]、ZnO[9]、Cr2O3[10]、Co3O4[11]、La2O3[12]等,其中CeO2由于其优良的储释氧能力和Ce3+/Ce4+循环而受到关注。Larsson等[7]研究CeO2、Mn2O3改性对Cuo/γ-Al2O3催化剂在CO氧化、乙醇燃烧和乙酸乙酯燃烧中的性能,发现用CeO2改性比用Mn2O3改性催化CO氧化的活性好,但是对于另外两个反应其结果则相反。Shiau等[8]研究不同制备方法对CeO2改性CuO/γ-Al2O3催化剂在CO氧化反应中催化性能的影响,结果发现在γ-Al2O3上先电镀铜,再浸渍CeO2比交换顺序所制得的催化剂的活性高;同时发现催化剂的焙烧温度是650℃时,催化剂的活性最高。Moretti等[13]研究在介孔Al2O3上负载CeO2和CuO的CuO/CeO2/Al2O3催化剂在富氢条件下CO氧化的反应(PROX),发现由于CuO和CeO2之间的协同作用,容易使CuO形成Cu+物种,使催化剂具有高的活性。另外由于Al2O3具有规整的孔结构和窄的孔分布,因而CuO在载体上高度分散,这也是催化剂活性高的原因。Moretti等[14]又制备介孔的CuO/CeO2/Al2O3复合催化剂,考察其在PROX反应中的活性,发现其不但活性高而且不容易失活。近期本课题组利用固相浸渍法制备CuO-CeO2/SBA-15催化剂,其催化活性明显高于用溶液浸渍法制备的催化剂,这主要是由于固相浸渍法增加了各组分之间的相互作用[15]。
文中先通过水热法直接合成CeO2掺杂的SBA-15,然后负载一定量的CuO,制备催化剂CuO/Ce-SBA-15。通过XRD、TEM、N2吸附、TPR、CO-IR等手段考察催化剂CuO/Ce-SBA-15的结构,并对其进行催化活性的测试。
1 实验部分
1.1 样品制备
Ce-SBA-15的合成途径:4g三嵌段共聚物表面活性剂EO20PO70EO20(P123,Aldrich)溶解于30mL水和2mL2mol·L-1HCl溶液中,在40℃下搅拌4h。之后,加入60mL水并搅拌2h,再在溶液中直接加入适量硫酸铈并搅拌1h。将pH值调至2.3后,逐滴加入9.0g正硅酸四乙酯(TEOS)。在40℃下搅拌该胶体混合物24h,装入聚四氟乙烯高压釜中,100℃下水热结晶化24h。样品经过滤并用去离子水和无水乙醇洗涤数次,然后在100℃下空气中干燥12h。所得固体粉末在500℃空气中焙烧5h去除模板剂得最终产品。样品Ce-SBA-15标记为Ce(x)-SBA-15,其中x表示最终样品中nSi/nCe摩尔比。
以Ce-SBA-15为载体,用不同体积的0.05mol·L-1的Cu(NO3)2水溶液浸渍Ce-SBA-15载体,搅拌1h,油浴100℃蒸干水分,在110℃干燥12h,空气气氛下500℃焙烧5h。样品标记为yCuO/Ce-SBA-15,其中y表示最终样品中CuO的质量分数。
1.2 催化剂表征
1)X射线粉末衍射(XRD)测试 XRD定性测试在Philips X’Pert Pro衍射仪上进行,采用Cu靶(l=0.15418nm),Ni滤波片。管流为40mA,管压为40kV。
2)透射电子显微镜(TEM)分析 在JEM-2100透射电镜上进行TEM分析。测定样品研细后经乙醇溶液超声分散后置于铜网上进行观察。
3)比表面测试(BET) 比表面和孔径测定在Micromeritics ASAP-2020上进行。样品首先在573K下活化,并抽真空至5mHg,然后在液氮温度(77K)下进行比表面积测试。
4)元素含量分析(ICP) 元素含量分析在Jarrell-Ash 1100等离子发射光谱仪(ICP)上进行,所有样品均溶于热HF酸或HNO3中。
5)程序升温还原(H2-TPR)取0.05g催化剂样品置于U型石英管中,用(H2+Ar)混合气(φ(H2)=7%)流经催化剂样品,流速为60mL·min-1。升温速率10℃·min-1。热导池响应耗氢信号,得到H2-TPR谱图。
6)CO吸附原位红外(CO-IR)所用仪器为Nicolet 5700傅立叶变换红外光谱仪,扫描次数为32次,分辨率为4cm-1。取相同量催化剂粉末样品压成自支撑薄片,在N2气流(30mL·min-1)中100℃恒温处理1h,降至室温后通入CO+He混合气,以25℃·min-1速率升温至300℃,在不同温度下记录样品的红外光谱,得CO-IR谱。
1.3 CO氧化活性测试
用微型催化反应装置评价催化剂的性能。催化剂粉末样品经研磨、压片和破碎,取40-60目样品,用量0.05g。反应前催化剂样品预先经100℃空气流处理1h。原料气组成φ(CO)=1.6%,φ(O2)=20.8%,其余为N2。产物经13X分子筛(分离CO,O2和N2)分离后用热导检测器检测,空速30000mL·g-1·h-1。
2 结果与讨论
图1给出了不同Ce含量的Ce-SBA-15样品的小角XRD谱图结果。所有样品均可观察到SBA-15材料六方介孔孔道的3个衍射峰(100),(110)和(200)。(210)衍射峰太弱,难以观察到,这可能是杂原子进入SBA-15骨架内部,导致样品介孔结构的有序度下降[16]。
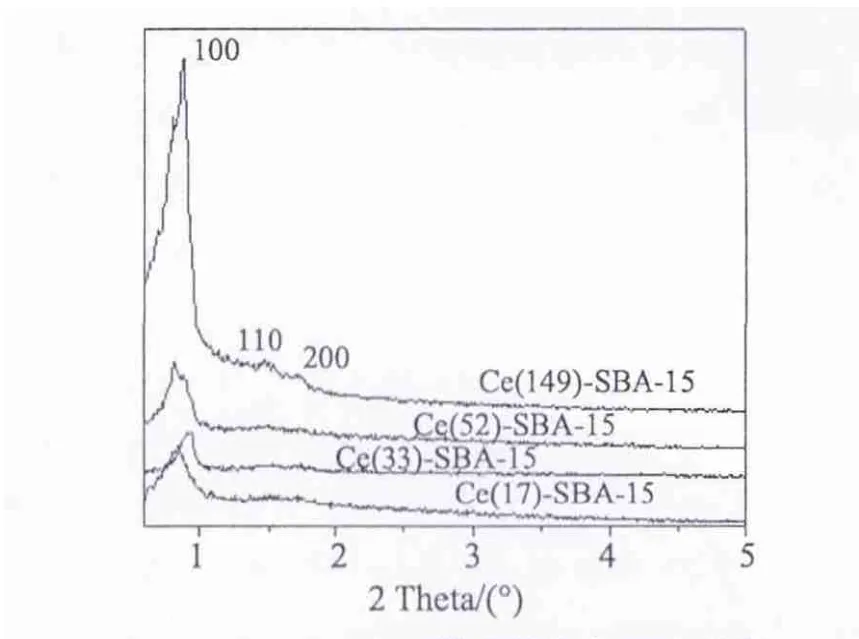
图1 不同Ce-SBA-15样品的小角XRD结果Fig.1 Small angle XRD patterns of Ce-SBA-15
为了更加直观地了解样品的孔结构信息,对Ce(33)-SBA-15样品进行了TEM表征(图2)。由图2可以看到清晰的孔道结构,说明所制备的样品属于介孔材料,孔径大约7nm左右。

图2 样品Ce(33)-SBA-15的TEM结果Fig.2 TEM images of Ce(33)-SBA-15
Ce-SBA-15样品的N2吸脱附等温线如图3所示。从图中可以看出,所有的N2吸附等温线均属于IUPAC分类中的IV型吸附等温线,并且呈现出H1型滞后环,这是典型的具有2D-六方介孔结构孔材料的吸脱附曲线[17]。在相对压力P/P0≈0.6~0.8时吸附等温线出现突跃,这表明所合成的Ce-SBA-15具有较规整的介孔结构。图4中所示的BJH孔径分布曲线表明样品孔径分布较窄,说明介孔结构的有序度比较高。
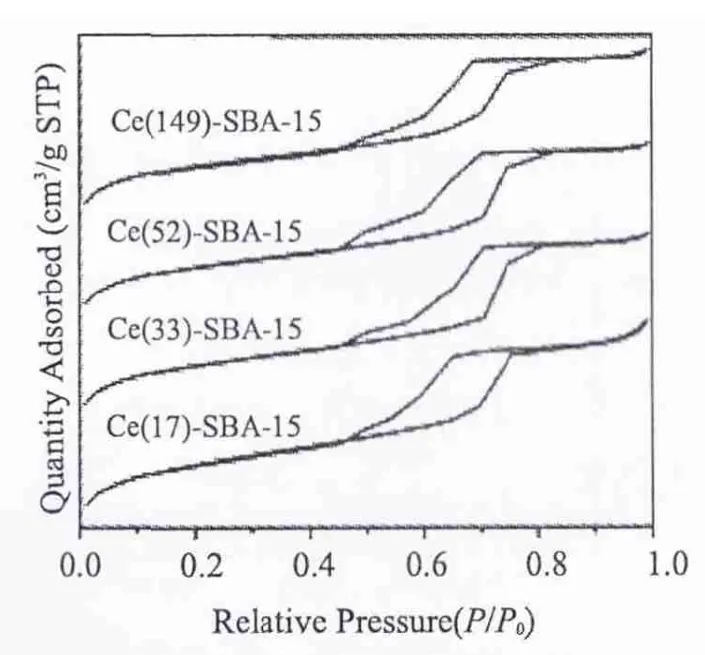
图3 样品的N2吸附等温线Fig.3 N2-adsorption isotherms of Ce-SBA-15
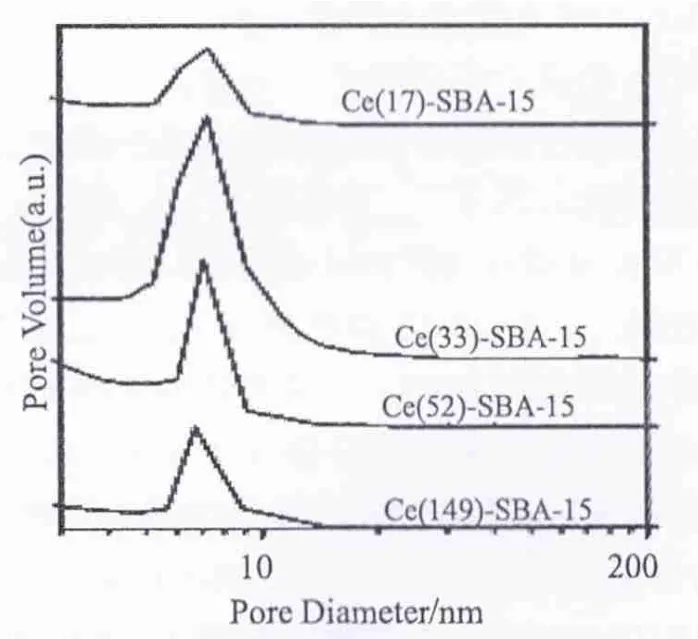
图4 样品的孔分布结果Fig.4 Pore size distributions of Ce-SBA-15
各样品的孔结构参数如表1所示,其中a0、ABET、dp、Vp和W分别表示样品的晶胞参数、比表面、孔径、孔体积和孔壁厚度。由于样品具有有序的六方孔道结构,其晶胞参数a0根据式a0=2d100/计算得到。孔壁厚度W根据式W=a0-dp计算得到。随着Ce含量的提高,样品的孔径由6.7nm提高至7.4nm,孔体积由0.83cm3·g-1提高至1.14cm3·g-1。对于Ce-SBA-15样品孔径变大可以如下解释。对于有晶型的沸石分子筛,孔径会随着杂原子的掺入而逐渐增加,这主要是因为M-O的键长大于Si-O的键长。但是对于SBA-15没有一定的规律是因为SBA-15的孔壁是无定形的SiO2,其键长和键角都会发生变化。与沸石分子筛相比,SBA-15具有比较厚的孔壁因而杂原子不可能完全掺入到SBA-15的骨架里面。因此有一定量的金属离子可能暴露在孔壁表面,类似于浸渍法,这种情况就有可能导致孔径的减少。当这些金属离子深深地嵌入到SiO2的骨架时,此时由于M-O的键长大于Si-O的键长进而导致孔径的增大。在本实验中,Ce物种的引入导致介孔材料孔径的增大,系Ce4+深深地嵌入到SiO2的骨架中所致。
通过ICP测定样品Ce-SBA-15中Ce的含量,结果如表1。可以发现焙烧后样品中Ce的含量要比投入量小,这主要是由于Ce的前躯体在水热过程中的可溶性导致没有沉淀完全。
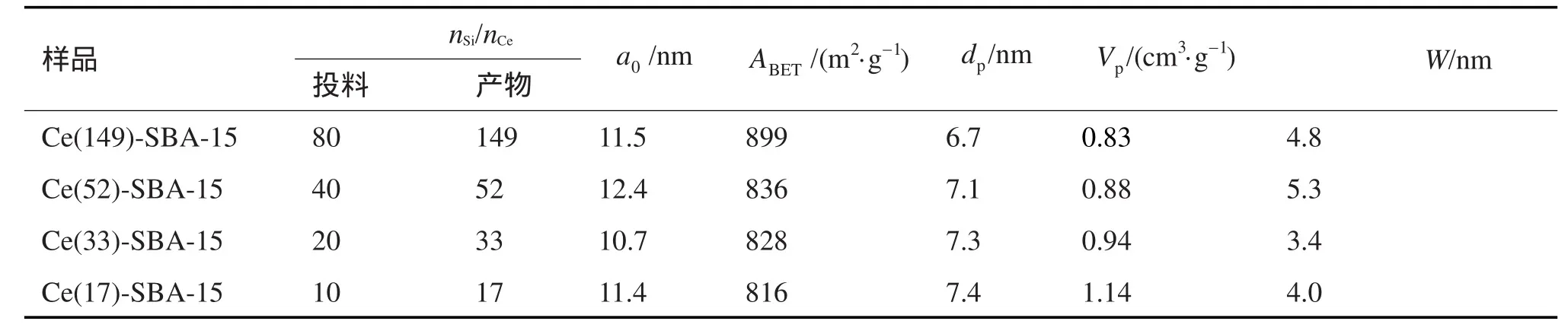
表1 不同Ce含量的Ce-SBA-15样品的孔结构参数Tab. 1 Texture para menters of Ce-SBA-15 samples
图5 给出了CeO2改性前后CuO/SBA-15催化剂XRD结果。由图5可见,所有样品均可观测到晶相CuO的特征衍射峰 (2θ=35.6°、38.7°和48.8°)。当样品中加入一定量的CeO2后,出现了微弱的晶相CeO2的特征衍射峰(2θ=28.4°)。同时,晶相CuO特征衍射峰的相对强度有所减弱,出现了明显的宽化现象,说明一定量CeO2的添加在一定程度上促进了晶相CuO的分散。
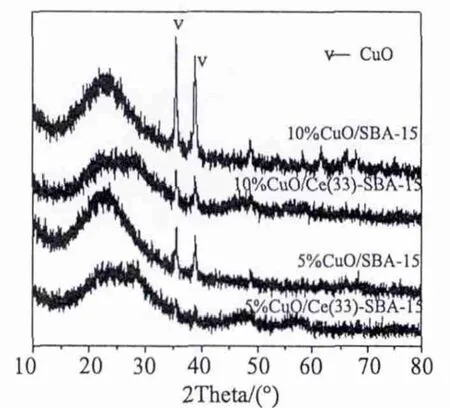
图5 不同样品的广角XRD结果Fig.5 Wide angle XRD patterns of different samples
图6 给出了添加CeO2前后,催化剂的TPR结果。铜铈之间的相互作用对CO氧化反应至关重要,而H2-TPR可以有效地反映铜与铈间的相互作用。通常认为,CuO的还原在很大程度上受到载体的影响。在SBA-15上,CuO的还原温度一般要高于250℃,而添加CeO2之后,由于铜与铈之间的协同作用,其还原峰温会明显前移。
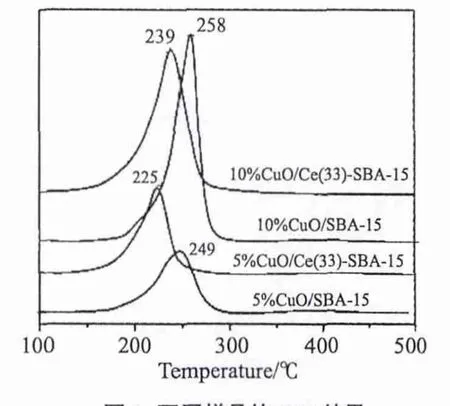
图6 不同样品的TPR结果Fig.6 TPR patterns of different samples
图7给出催化剂10%CuO/SBA-15和10%CuO/Ce(33)-SBA-15的CO吸附的红外结果。对于10%CuO/SBA-15样品,只有一个吸收峰(2131cm-1)被观察到。该吸收峰强度随着温度升高逐渐降低,但是在300℃时仍可以观察到,说明该峰是比较稳定的。根据文献[18]报道,CO分子在Cu+物种上比在Cu2+物种上的吸附要稳定,因此该吸收峰归属于CO-Cu+。10%CuO/SBA-15样品在25℃时就有一定Cu+-CO的吸附振动,这可能是由于吸附CO之前经N2处理的过程中少量CuO的氧脱附而形成了Cu+所致,这与很多文献报道结果一致[19]。对于10%CuO/Ce(33)-SBA-15样品,出现一个新的吸收峰位于2170cm-1,归属为CO-Cu0,这主要是由于加入CeO2以后促进Cu2+的还原,当吸附CO以后少量的CuO的氧脱附而形成了Cu0所致[20]。
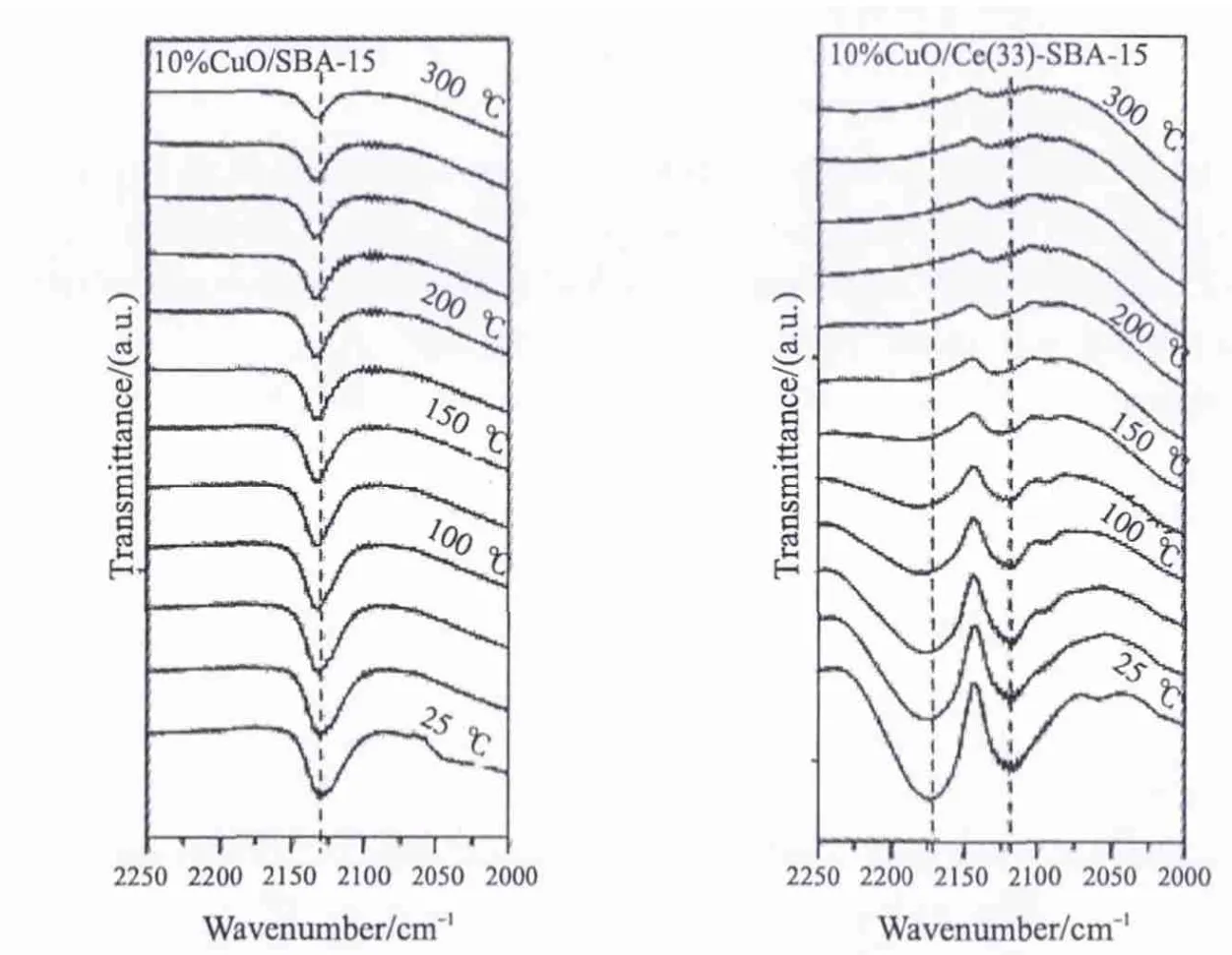
图7 CuO/SBA-15和CuO/Ce-SBA-15催化剂的CO吸附原位红外谱图Fig.7 In situ FT-IR spectra of CO adsorbed on CuO/SBA-15 and CuO/Ce-SBA-15 catalysts
图8给出了氧化铈改性前后CuO/SBA-15催化剂的CO氧化催化活性对比结果。
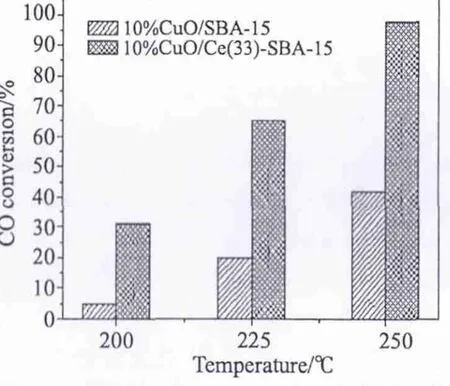
图8 CuO/SBA-15和CuO/Ce-SBA-15催化剂的CO氧化催化活性Fig.8 Catalytic activities of CuO/SBA-15 and CuO/Ce-SBA-15 catalysts for oxidation of CO
图8表明,CeO2的加入显著提高了CuO/SBA-15催化剂对CO氧化的反应活性。结合XRD、TPR和CO-IR的结果,CeO2添加改变了CuO与载体之间的相互作用。根据文献[21]报道,可以从反应机理的角度给出相应的解释。根据不同的金属氧化物具有不同的蒸发焓,CuO的蒸发焓比较低,Cu-O键易断开使得其晶格氧在低温下就可以很容易释放出来;CeO2的蒸发焓比较高,Ce-O键较难断裂,氧不易脱出。铜和铈之间的相互作用会影响二者的氧化态,可能会发生Cu2++Ce3+↔Cu++Ce4+氧化还原反应。因此,这样的协同效应会显著地提高了反应活性。Cu-Ce双组份催化剂上CO氧化机理如图9。
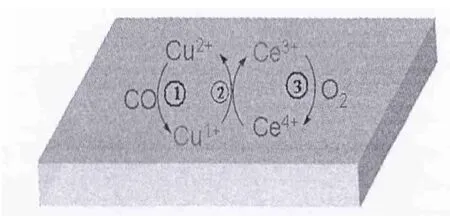
图9 CO氧化反应在CuO/Ce-SBA-15催化剂上的可能反应机理Fig.9 Possible schemes of CO oxidation over CuO/Ce-SBA-15 catalysts
4 结 论
通过水热法直接合成了CeO2掺杂的SBA-15介孔材料,并将其作为载体负载CuO用于测试CO氧化的催化活性。实验结果表明Ce-SBA-15材料具有有序的介孔结构。CeO2的加入显著提高了催化剂在CO氧化反应中的活性这主要是由于CeO2的加入,促进了CuO在载体上的分散和还原。
[1]Trimm D L.Catalytic combustion[J].Applied Catalysis A:General,1983,7:249-282.
[2]Gardner S D,Hoflund G B,Schryer D R,et al.Catalytic behavior of noble metal/reducible oxide materials for low-temperature carbon monoxide oxidation.1.Comparison of catalyst performance[J].Langmuir,1991,7:2135-2139.
[3]YangY,Saoud M K,Ab delsayed V,et al Vapor phase synthesis of supported Pd,Au,and unsupported bimetallic nanoparticle catalysts for CO oxidation[J].Catalysis Communications,2006,7:281-284.
[4]Haruta M,Tsubota S,Kobayashi T,et al.Low-temperature oxidation of CO over gold supported on TiO2,α-Fe2O3,and Co3O4[J].Journal of Catalysis,1993,144(1):175-192.
[5]Martinez-AriasA,Fernandez-Garcia M,Galvez O,et al.Comparative study on redox properties and catalytic behavior for CO oxidation of CuO/CeO2and CuO/ZrCeO4catalysts[J].Journal of Catalysis,2000,195:207-216.
[6]Zhao D,Feng J,Huo Q,et al.Triblock copolymer syntheses ofmesoporous silica with periodic 50 to 300 angstrom pores[J].Science,1998,279:548-552.
[7]Larsson P O,An derssonA.Oxides of copper,ceria promoted copper,manganese and copper manganese onAl2O3for the combustion of CO,ethyl acetate and ethanol[J].Applied Catalysis B:Environmental,2000,24:175-192.
[8]Shiau C Y,Ma M W,Chuang C S.CO oxidation over CeO2-promoted Cu/γ-Al2O3catalyst:Effect of preparation method[J].Applied CatalysisA:General,2006,301:89-95.
[9]Shobaky GAE,Fagal GA,Mokhtar M.Effect of ZnO on surface and catalytic properties of CuO/Al2O3system[J].Applied Catalysis A:General,1997,155:167-178.
[10]Shobaky GAE,Fagal GA,GhozzaAM,et al.Surface and catalytic investigations of CuO-Cr2O3/Al2O3system[J].Applied Catalysis A:General,2006,302:296-304.
[11]Liu L,Chen Y,Dong L,et al.Investigation of the NO removal by CO on CuO-CoOxbinary metal oxides supported on Ce0.67Zr0.33O2[J].Applied Catalysis B:Environmental,2009,90:105-114.
[12]Ferrandon M,Ferrand B,Björnbom E,et al.Copper oxide-platinum/alumina catalysts for volatile organic compound and carbon monoxide oxidation:synergetic effect of cerium and lanthanum[J].Journal of Catalysis,2001,202:354-366.
[13]Moretti E,Lenarda M,Storaro L,et al.Catalytic purification of hydrogen streams by PROX on Cu supported on an organized meso porous ceria-modified alumina[J].Applied Catalysis B:Environmental,2007,72:149-156.
[14]Moretti E,Lenarda M,Storaro L,et al.One-step synthesis of a structurally organized mesoporous CuO-CeO2-Al2O3system for the preferential CO oxidation[J].Applied CatalysisA:General,2008,335:46-55.
[15]Tang C,Sun J,Yao X,et al.Efficient fabrication of active CuO-CeO2/SBA-15 catalysts for preferential oxidation of CO by solid state impregnation[J].Applied Catalysis B:Environmental,2014,146:201-212.
[16]KongY,Jiang SY,Wang J,et al.Synthesis and characterization of Cu-Ti-MCM-41[J].Microporous and Mesoporous Materials,2005,86:191-197.
[17]Zhang H L,Tang C,Sun C,et al.Direct synthesis,characterization and catalytic performance of bimetallic Fe-Mo-SBA-15materials in selective catalytic reduction of NO with NH3[J].Microporous and Mesoporous Materials,2012,151:44-55.
[18]Dulaurent O,Courtois X,PerrichonV,et al.Heats of adsorption of CO on a Cu/Al2O3catalyst using FTIR spectroscopy at high temperatures and under adsorption equilibrium conditions[J].The Journal of Physical Chemistry B,2000,104:6001-6011.
[19]Busca G.FT-IR study of the surface of copper oxide[J].Journal of Molecular Catalysis,1987,43:225-236.
[20]Wan H,Li D,Dai Y,et al.Effect of CO pretreatment on the performance of CuO/CeO2/γ-Al2O3catalysts in CO+O2reaction[J].Applied CatalysisA:General,2009,360:26-32.
[21]钟依钧,吴小华,边平凤.CeO2对CuO/SiO2的助催化作用[J].浙江师大学报:自然科学版,1996,19(3):70-72.
