纳米限域LiBH4/Mg(AlH4)2复合体系的脱氢特性
2014-07-24丁晓丽
庞 刚,冯 阳,丁晓丽
(1.安徽工业大学材料科学与工程学院,安徽马鞍山243002;2.第二炮兵装备研究院第一研究所,北京100085)
纳米限域LiBH4/Mg(AlH4)2复合体系的脱氢特性
庞 刚1,冯 阳2,丁晓丽1
(1.安徽工业大学材料科学与工程学院,安徽马鞍山243002;2.第二炮兵装备研究院第一研究所,北京100085)
配位氢化物LiBH4的低温脱氢是制约其实际应用的技术瓶颈之一。采用纳米限域来进一步改善LiBH4/Mg(A lH4)2失稳体系的热解脱氢性能,用X射线衍射(XRD)、扫描电镜(SEM)和能谱(EDX)分别对其晶体结构、微观形貌和元素面分布进行表征,并采用差热分析(DSC)及热重分析(TG)研究样品的脱氢过程。结果表明,纳米限域下LiBH4/Mg(A lH4)2复合体系的脱氢性能得到了显著改善,与纯LiBH4/Mg(AlH4)2体系相比,纳米限域作用不仅使复合体系的初始脱氢温度降低了70℃,而且还将脱氢反应动力学性能提高了近7倍。
储氢;LiBH4;反应失稳;纳米限域;脱氢性能
如何实现氢的安全、高效存储是制约氢能规模应用的“瓶颈”环节[1-4],是当前储氢研究的热点。现已开发的金属氢化物,如LaNi5和TiMn2基合金[5],储氢质量分数低于2%,无法满足w(氢)>5.5%的车载储氢材料需求[6-7]。因此,迫切需要研究和开发高容量固态储氢材料。
LiBH4具有较高的质量储氢密度(质量分数约18.5%),是当前研究的热点材料,但其较高的热脱氢温度无法与氢动力燃料电池直接匹配[8-9]。为此,研究者们提出一种以孔性介质作为骨架材料,利用所含纳米级微孔、间隙或者缺陷等的空间分散或约束作用来实现LiBH4的纳米化调制,以降低其热力学稳定性[10-11]。Zhang等[12]和Fang等[13]将LiBH4嵌入介孔碳中形成纳米复合材料,可降低结构稳定性,使其具有优异的脱/加氢性能。Vajo等[14]发现MgH2可作为反应失稳剂来改变LiBH4的分解反应路径,同样可改善其脱氢热力学性能。随后Liu等[15]进一步研究发现,在LiBH4中引入Mg(A lH4)2可实现MgH2和A l的双重失稳作用。该复合体系初始脱氢温度降低了40℃,同时在470℃时可完全脱氢。尽管LiBH4复合材料热稳定性已得到了显著改善,但是Mg(AlH4)2/LiBH4复合体系的主脱氢过程仍需在较高温度下才能完成。因此,笔者借助纳米限域效应来进一步调制LiBH4/Mg(A lH4)2失稳体系的热解脱氢性能。
1 样品的制备与表征
初始原料LiBH4(质量分数95%)、NaA lH4(质量分数95%)、MgCl2(质量分数97%)和乙醚(分析纯)购于Sigma-A ldrich公司,上述原材料均直接使用。Mg(AlH4)2通过机械球磨1∶2摩尔比的MgCl2和NaA lH4制得,球磨后产物进一步采用乙醚进行提纯处理,以消除副产物NaCl。选取介孔碳球阵列(MCSA)作为纳米限域的骨架材料,其合成主要采用两步模板法,具体实验过程见文献[16],该方法制备的MCSA具有均一的纳米孔道,相关孔道结构表征在文中未给出。纳米限域体系的构建主要采用湿法浸渍技术来实现:将摩尔比为6∶1的LiBH4和Mg(AlH4)2溶于乙醚中制备出6LiBH4/Mg(A lH4)2混合溶液,随后将混合溶液用滴管滴加到预先制备的MCSA上,在50℃下浸渍2 h,紧接着抽滤和真空干燥;然后按溶液滴加—浸渍—抽滤—真空干燥的步骤操作多次,所获样品再用乙醚洗涤,以除去沉积在MCSA外表面的氢化物;最后将样品真空干燥48 h以上,所得样品通过称重计算可知约含质量分数为50%的6LiBH4/Mg(A lH4)2。制备的纳米限域样品标记为MCSA/6LiBH4/Mg(A lH4)2。
采用Cu Kα的X射线粉末衍射(XRD)(Rigaku D/ max 2400,Japan)对样品的结构与相组成进行分析,XRD样品的制备在氩气手套箱中完成,并在样品表面贴一层Scotch透明胶带,以防止在测试过程中样品与空气中氧、水发生反应。样品表面微观形态采用Shimadzu Superscan SSX-550电子扫描电镜(SEM)进行表征,并采用EDX分析元素分布情况。采用差热分析(DSC)及热重分析(TG)观察样品的脱氢过程,且在德国Netzsch公司的STA 409PC同步热分析仪上测试完成,升温速率为10℃/m in,冲释气体为高纯氩气。样品的脱氢反应动力学性能在自动Sieverts装置(AMC GasReaction Controller,USA)中测试,每次样品用量约0.5 g,脱氢过程的背底压力为10 Pa。
2 结果与讨论
2.1 相组成及其存在形式
图 1为 6LiBH4/Mg(A lH4)2和 MCSA/6LiBH4/ Mg(A lH4)2样品的XRD图谱。由图1可得:与纯6LiBH4/Mg(AlH4)2类似(图1(a)),MCSA/6LiBH4/ Mg(A lH4)2样品中同样含有LiBH4和Mg(AlH4)2两相;不同之处在于,纳米限域样品中上述2种氢化物的衍射峰明显变宽,强度显著降低(图1(b)),这主要是氢化物经湿法浸渍进入到MCSA纳米孔道中并以纳米或非晶态存在的缘故。采用Debye-Scherrer公式计算可得,氢化物的平均晶粒尺寸约为24 nm,这进一步证实了氢化物被纳米限域在MCSA的孔道之中。该样品选区EDX分析见图2。图2表明,样品中存在均匀分布的B,Mg和A l元素,且与C元素的分布相吻合。上述结果表明,MCSA/6LiBH4/Mg(AlH4)2样品中复合氢化物纳米颗粒均匀分散于MCSA中。
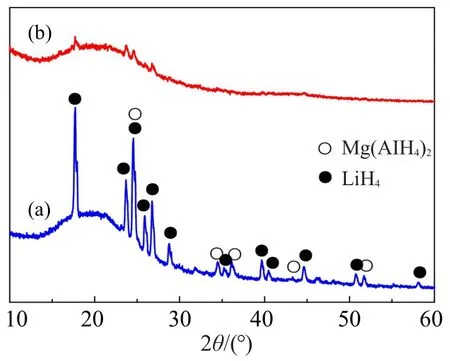
图1 (a)6LiBH4/M g(AlH4)2和(b)MCSA/6LiBH4/Mg(A lH4)2样品的XRD图谱Fig.1 XRD patterns of(a)6LiBH4/M g(A lH4)2and(b)MCSA/6LiBH4/Mg(AlH4)2samp les

图2 MCSA/6LiBH4/M g(AlH4)2样品的SEM图片及其EDX选区元素面分布Fig.2 SEM and EDSm apping of the selected region oftheMCSA/6LiBH4/M g(AlH4)2sam p le
2.2 脱氢反应过程变化
Liu等[15]已证实,6LiBH4/Mg(AlH4)2复合体系的脱氢过程分为3步:第一步为Mg(A lH4)2的分解,生成MgH2和A l,同时放出氢气;第二步为MgH2的分解,生成Mg;第三步为LiBH4与Mg和A l的反应,生成MgA lB4和LiH,并放出氢气。为揭示纳米限域对上述反应过程的改善作用,采用DSC技术考察MCSA/ 6LiBH4/Mg(AlH4)2样品的热焓变化。为便于比较,纯LiBH4和Mg(AlH4)2的DSC曲线一并给出,结果如图3。从图3可得上述3步脱氢过程仍然存在,但其脱氢温度显著降低,具体为:第一步脱氢反应温度由纯Mg(A lH4)2的135℃降低至72℃;第二步MgH2的分解由292℃降低至278℃;而第三步脱氢反应由纯LiBH4的429℃降低至368℃。由此表明,纳米限域显著降低了复合体系的热力学稳定性,并促使脱氢反应在相对较低的温度下进行。
2.3 热解脱氢性能
图4为纯 LiBH4,6LiBH4/Mg(A lH4)2和MCSA/ 6LiBH4/Mg(AlH4)2样品的TG曲线。由图4可得:纯LiBH4在283℃时缓慢开始释放H2,到500℃释放了质量分数为8.5%的H2,仅释放了其理论含氢量(质量分数~14.6%)的58%;而6LiBH4/Mg(AlH4)2样品的初始脱氢温度约为116℃,到500℃时释放了质量分数为11.8%的H2,接近其理论含氢量(质量分数的12.4%),这表明Mg(A lH4)2有效改善了LiBH4的脱氢性能;值得注意的是,MCSA/6LiBH4/Mg(AlH4)2样品的初始脱氢温度位于40℃,接近于室温,其主脱氢过程也明显提前,在380℃时即完成脱氢,释放了质量分数约11.0%的H2。由此进一步证实纳米限域可显著改善6LiBH4/ Mg(A lH4)2复合体系的热解脱氢性能。
进一步比较6LiBH4/Mg(A lH4)2和MCSA/6LiBH4/ Mg(A lH4)2样品的等温脱氢性能,结果如图5。由图5可得:6LiBH4/Mg(AlH4)2样品在350℃时420m in内缓慢释放了质量分数为7.5%的H2;而MCSA/6LiBH4/ Mg(A lH4)2样品释放相同含量的氢气仅需65m in,其脱氢反应速率提高了近7倍,且在120m in即完全脱氢。由此再次证明,纳米限域可有效提高6LiBH4/ Mg(A lH4)2复合体系的脱氢性能。
3 结 论
纳米限域作用不仅显著降低了LiBH4/Mg(A lH4)2复合体系的热稳定性,而且还有效提高了脱氢反应动力学性能。与纯LiBH4/Mg(A lH4)2样品相比,纳米限域样品的初始脱氢温度接近于室温(~40℃),在380℃时即完成脱氢,且反应动力学性能提高了近7倍。本研究结果充分表明,“纳米限域”和“反应失稳”两方法相结合,为LiBH4/Mg(AlH4)2复合体系储氢材料的性能改善提供了一种较为有效的技术途径。
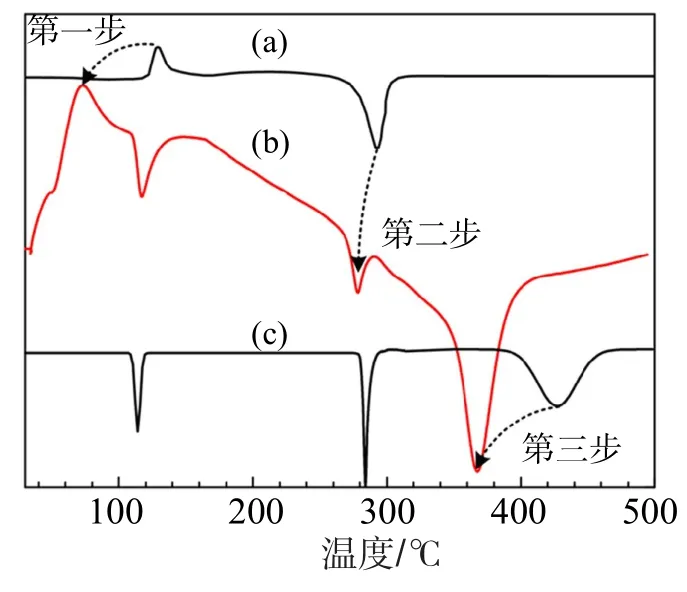
图3 (a)纯M g(A lH4)2,(b)MCSA/6LiBH4/M g(A lH4)2和(c)纯LiBH4样品的DSC曲线Fig.3 DSC curvesof(a)pureM g(A lH4)2,(b)MCSA/6LiBH4/ M g(A lH4)2and(c)pure LiBH4sam p les

图4 (a)纯LiBH4,(b)6LiBH4/M g(A lH4)2和(c)MCSA/6LiBH4/ Mg(AlH4)2样品的TG曲线Fig.4 TG curvesof(a)pure LiBH 4,(b)6LiBH4/M g(A lH4)2and(c)MCSA/6LiBH4/M g(A lH4)2sam ples

图5 (a)6LiBH4/Mg(AlH4)2和(b)MCSA/6LiBH4/M g(AlH4)2样品的350℃等温脱氢曲线Fig.5 P-C isothermsof hydrogen desorption of(a)6LiBH4/ Mg(AlH4)2and(b)MCSA/6LiBH4/Mg(AlH4)2samples at350℃
[1]Schüth F.Technology:hydrogen and hydrates[J].Nature,2005,434:712-713.
[2]Yang J,Sudik A,Wolverton C,etal.High capacity hydrogen storagematerials:attributes forautomotive applicationsand techniques formaterialsdiscovery[J].Chem Soc Rev,2010,39:656-675.
[3]Schlapbach L,ZüttelA.Hydrogen-storagematerials formobile applications[J].Nature,2001,414:353-358.
[4]GeorgeW C,M ildred SD,M ichelle V B.The hydrogen economy[J].Phys Today,2004,12:39-44.
[5]ZüttelA.Materials forhydrogen storage[J].Mater Today,2003,9:24-33.
[6]Zhang QA,Nakamura Y,Oikawa K,etal.Synthesisand crystalstructureof Sr2AlH7:anew structural type ofalkalineearth aluminum hydride[J].Inorg Chem,2002,41(25):6547-6549.
[7]Chen P,Xiong ZT,Luo JZ,etal.Interaction ofhydrogenw ithmetalnitridesand imides[J].Nature,2002,420:302-304.
[8]GrochalaW,EdwardsP.Thermaldecomposition of the non-interstitialhydrides for the storage and production of hydrogen[J].Chem Rev,2004,104:1283-1315.
[9]Hamilton CW,Baker RT,Staubitzc A,etal.B-N compounds for chemicalhydrogen storage[J].Chem Soc Rev,2009,38:279-293. [10]Li Y,Zhou G,Fang F,etal.De-/re-hydrogenation features of NaA lH4confined exclusively in nanopores[J].Acta Mater,2011, 59(4):1829-1838.
[11]丁晓丽,庞刚.“反应失稳”复合储氢材料的研究进展[J].安徽工业大学学报:自然科学版,2011,28(2):166-169.
[12]Zhang Y,Zhang W S,Wang A Q,et al.LiBH4nanoparticles supported by disordered mesoporous carbon:hydrogen storage performancesand destabilizationmechanisms[J].Int JHydrogen Energy,2008,32:3976-3980.
[13]Fang Z,Wang P,Rufford T,etal.Kinetic and thermodynamic-based improvementsof lithium borohydride incorporated into activated carbon[J].ActaMater,2008,56:6257-6263.
[14]Vajo JJ,Mertens F,Ahn C,etal.MgH2destabilized w ith Si[J].JPhys Chem C,2004,108:13977-13983.
[15]Liu D,Liu Q,SiT,etal.Superiorhydrogen storage propertiesof LiBH4catalyzed by Mg(AlH4)2[J].Chem Commun,2011,47(20): 5741-5743.
[16]Liu H,CuiW,Jin L,etal.Preparation of three-dimensionalorderedmesoporouscarbon sphere arraysby a two-step templating route and theirapplication for supercapacitors[J].JMater Chem,2009,19:3661-3667.
责任编辑:何莉
Hydrogen Release from the Nanoconfined LiBH4/Mg(A lH4)2Composites
PANG Gang1,FENG Yang2,DING Xiaoli1
(1.SchoolofMaterials Scienceand Engineering,AnhuiUniversity of Technology,Ma'anshan 243002,China 2.The FirstResearch Institute,The Second Artillery EquipmentAcademy,Beijing 100085,China)
Oneof thekey scientific issues in theapplication of LiBH4is to releasehydrogen at low temperature.The nanoconfinementof LiBH4/Mg(AlH4)2destabilized system wasadopted to further improve itsdehydriding properties. X-ray diffraction(XRD),scanning electronm icroscopy(SEM)and energy-dispersive X-ray(EDX)were performed to characterize itsmicrostructures,morphologiesand elementalmapping.Differentialscanning calorimetry(DSC)and thermogravimetric analysis(TG)wasused to study itsdehydriding progresses.The resultsshow thatnanoconfinement is an effective strategy for promoting the dehydrogenation of LiBH4/Mg(A lH4)2system.Compared to pure LiBH4/ Mg(AlH4)2sample,the nanoconfined sample notonly hasa reduced onset temperature by 70℃,butalso exhibitsa kineticsw ith nearly seven times faster.
hydrogen storage;LiBH4;reactive destabilization;nanoconfinement;dehydrogenation properties
TK91;TF325.2
A
10.3969/j.issn.1671-7872.2014.01.010
1671-7872(2014)01-0043-04
2013-04-10
国家自然科学基金项目(51202004)
庞刚(1983-),男,安徽利辛人,助理实验师,博士生,主要研究方向为先进能源材料。
