多肽药物研究进展
2014-10-25孙立春COYDavid
孙立春 COY David H
(美国杜兰大学医学院多肽药物研发中心 New Orleans, LA 70112-2699)
1 多肽药物的特点
多肽一般是指一种所含氨基酸数量在50到100以内的小分子蛋白。与小分子化合物类相比,多肽为大分子,而与大分子蛋白或抗体相比,多肽仍是小分子。多肽易于合成改造和优化组合,能很快确定其药用价值。由于本身的特性,多肽从临床试验到FDA批准所需时间也比小分子药物时间短很多(大约平均为10年)。而多肽通过临床试验的机率比小分子化合物要高两倍[1-3]。多肽的特定优点使其在药物开发中表现出特定的优势和拥有临床应用价值。
更具体而言,与小分子化合物相比,多肽半衰期一般很短,不稳定,在体内容易被快速降解,多肽制剂需要低温保存,但是,通过改造修饰或者与其他材料组成稳定的复合物,可提高稳定性。相对大分子蛋白或抗体类,多肽在常温下却更稳定,用量更少,单位活性也更高。与大分子蛋白相比,多肽化学合成技术成熟,多肽容易与杂质或副产品分离,纯度高[3-7]。而重组蛋白的质量、纯度和产量都难以保证。重组蛋白也不能引入非天然氨基酸,不能在末端酰胺化,同时生产周期长,成本高。多肽一般比蛋白抗体类药物成本低,但比很多小分子药物的合成成本高。长链多肽的合成成本会更高,一个分子量为5 000道尔顿的多肽比一个分子量为500道尔顿的小分子化合物的合成成本要高10倍。但是随着科技进步,设备更新和工艺改善,小分子多肽的合成成本和商业成本已经大幅度下降,更加适合于临床应用和市场开拓。有些仅含有几个氨基酸的小肽比有些复杂小分子的合成成本低。
多肽最大的问题是不能口服,主要是因为易被降解和难穿越肠黏膜[4,6,8-9]。但是,有各种可替代的其他给药途经如皮下注射,鼻腔喷射。有些多肽药物比小分子药物用药量更少,选择性更强,特异性更好,作用效果更好,副作用更小。许多小分子化合物在人体特定器官聚集,大分子蛋白或抗体会被网状内皮系统(reticuloendothelial system)和肝脏非特异性吸收,不可避免地导致不同程度的副作用,有的会很严重。多肽一般没有副作用或者副作用很小,主要是小分子多肽降解后的产物为氨基酸,一般不会在特定器官组织中累积,容易通过肝和肾从体内很快被清除掉,因而,几乎没有异物代谢引起的毒理学问题。但是有些会因用量过大等原因而产生副作用或者因注射导致注射部位的炎症或其他反应。而且,小分子多肽一般没有免疫原性,不会导致机体产生严重的免疫反应。但是有些多肽正是因为其免疫原性,可以诱导机体产生强烈的免疫反应,因而吸引人们开发新一代的多肽疫苗[4,10-12]。
由于多肽的分子大小、极性、亲水性和带电性等问题使之缺乏细胞膜渗透力,影响细胞吸收,因而一般难以如小分子那样穿越细胞膜,通过生理屏障,也不能穿过血脑屏障。但是有一类细胞渗透肽(CPP)却具有很强的细胞膜穿透力,因而被用作药物载体来辅助这些药物穿过细胞膜。同时,一些多肽可以用作非靶向特异性的小分子药物的靶向载体,通过细胞表面的特定受体将药物传递到受体特异性的特定靶点细胞如肿瘤细胞内,能更好地提高小分子药物的特异性,药效性,减少副作用[3-6,9,13-15]。
2 多肽药物靶点
大多数多肽以细胞外(extracellular)分子为靶点,少于10%的是以细胞内(intracellular)分子为靶点。细胞外分子靶点主要是G蛋白偶联受体(G protein-coupled receptor,GPCR)[2]。GPCR家族是最大的受体家族,已经确定的家族成员大约有800~1 000个。GPCR在现代药物开发中占据极其重要的地位,现代药物约50%都是以GPCR为靶点。这些GPCR的共同特点是都有七个跨膜结构域。GPCR信号一般是通过细胞外的配体与这些GPCR相互作用,引起GPCR的构象变化,通过激活三联体G蛋白调控GPCR下游的各种信号路经。GPCR家族中的一些受体在特定组织细胞内异常表达,调控人体正常的或者异常的生理功能,是药物开发的潜在对象。
一些GPCR的配体是小分子多肽,对这些多肽的改造和修饰成为多肽药物开发的最主要方向之一[5,15-16]。比如,由我们中心开发的两个多肽药物decapeptyl (用于治疗前列腺癌) 和somatuline(lanreotide,用于治疗肢端肥大)就是分别针对GPCR促黄体激素释放激素(LHRH)受体和生长抑素受体(somatostatin receptor,SSTR)。在治疗神经内分泌瘤(NETs)及相关疾病的药物中,以生长抑素(somatostatin)为背景的药物是最常用的首选药物。生长抑素以GPCR家族成员生长抑素受体为靶点,调控各种激素的分泌和其它细胞功能。开发长效和特异的生长抑素衍生物能够用来有效地治疗多种疾病。人们一直在对天然生长抑素进行改造修饰来获得特异性更强、稳定性更好的临床用生长抑素衍生物药物,多个此类多肽衍生物如奥曲肽(octreotide)、兰瑞肽(lanreotide)、伐普肽(vapreotide)、帕瑞肽(pasireotide)、somatoprim和司格列肽(seglitide)等已被FDA批准为临床药物(图1)[2,7]。它们针对不同的SSTR受体亚型,如奥曲肽主要与SSTR2,SSTR3,SSTR5亲和力强,帕瑞肽主要与SSTR1,SSTR3和SSTR5亲和力强,somatoprim主要与SSTR2,SSTR4和SSTR5亲和力强,而兰瑞肽、伐普肽和司格列肽主要与SSTR2和SSTR5亲和力强。不同的药物通过与不同生长抑素受体亚型相互作用,调控不同信号路经,用于治疗不同疾病。我们新开发的全新的生长抑素衍生物象天然生长抑素一样,与所有五种SSTR亚型都有高亲和力,能够更好地模拟天然生长抑素,更有效地抑制各种激素分泌,而且还能抑制肿瘤细胞增殖和肿瘤生长。相反,天然生长抑素和大多数相关药物不能有效地抑制细胞和肿瘤生长,因此,这些新的生长抑素衍生物将具有重要的药物开发价值。此外,胃泌素释放肽(GRP)、垂体腺苷环化酶激活多肽(PACAP)等多肽的特异性受体都是GPCR家族成员[2,5,7]。随着GPCR家族不断壮大,以GPCR为靶点的多肽药物的开发将展示更广阔的前景。
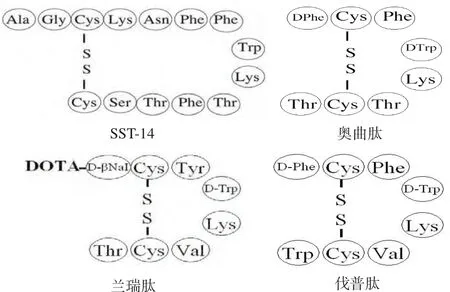
图1 生长抑素SST-14及其部分衍生物的分子结构[17]
3 多肽药物的重要性
人体内存在各种各样的多肽,它们参与调控人体内各种各样的生理和病理过程。如,多肽通过调控生长素分泌来调控细胞的分泌,通过调控各种信号路径来调控细胞的生长、分化和凋亡等各种细胞功能。多肽作为药物主要用于治疗癌症、代谢紊乱(metabolic disorders)、心血管等重大疾病。针对代谢疾病如糖尿病,患者需要长期用药,故所用药物需要副作用小、没有免疫原性等特点,以确保安全性。而癌症等靶向性强的疾病,所用药物则需要高药效、高选择性,减少副作用。同时多肽还可以用作药物载体增强药物靶向性,对治疗癌症等靶向性疾病具有针对性。多肽药物具备治疗这些重大疾病所需优点,适合于治疗相关疾病。
著名的多肽药物格拉替雷(copaxone,glatiramer)是人工合成的、由谷氨酸、丙氨酸、酪氨酸和赖氨酸四种氨基酸组成的小肽,被美国FDA批准用于治疗多发性硬化症(multiple sclerosis),目前已经在40多个主要国家上市。格拉替雷具有良好的疗效,能增强患者的耐受性,降低复发率,同时副作用少。天然生长抑素的衍生物兰瑞肽用于与内分泌有关的肢端肥大症的长期治疗[1,16],另一个衍生物帕斯瑞肽最近被FDA批准用于治疗库兴氏病。最著名的生长抑素的衍生物奥曲肽能抑制生长激素、胰高血糖素和胰岛素等激素的分泌,比天然生长抑素作用更强、选择性更高,用于治疗胃肠胰内分泌肿瘤、肢端肥大症等多种相关疾病。芦西纳坦(surfaxin,lucinactant)被FDA批准用于预防和治疗早产儿呼吸窘迫综合征(respiratory distress syndrome,RDS)。omontys(peginesatide)是一种聚乙二醇化多肽药物,用于治疗与肾透析患者的慢性肾脏疾病相关的贫血。戈舍瑞林(goserelin)是一种治疗乳癌和前列腺癌的多肽类药物,艾塞那肽(exenatide,byetta)被用来治疗成人2型糖尿病[7,9,18-19]。目前上市的多肽药物多达几十种,它们已经被广泛用来治疗各种人类疾病如哮喘、过敏、疼痛、关节炎、糖尿病、心血管病、胃肠功能紊乱、感染性疾病、炎症、癌症、肥胖和骨质疏松等等[4,6,15,19]。这些疾病与人类的生命健康息息相关,代表着全球非常重要的药物市场,也体现多肽药物的应用价值和重要性。
4 多肽药物的发展
现代药物在20世纪是小分子化合物的时代,这类药物一直占据着药物市场的统治地位[6,20]。由于小分子药物的顺利发展和多肽自身的缺陷,多肽药物的发展在很长一段时间内一直未受到重视。随着小分子药物开发成本和风险越来越高,开发难度越来越大,直接导致开发成功率越来越低[6,9];与此同时,在多肽药物开发领域却不断取得进展。随着多肽合成与纯化的相关工艺技术和设备条件的改善和提高及基因重组和其他现代技术的逐渐成熟,人们逐渐把更多注意力投向多肽药物开发。几十年前,第一个多肽药物胰岛素(insulin)被用于治疗糖尿病[1],第一个化学合成的多肽药物催产素(oxytocin)被用于促進产妇分娩[7],自那以来,多肽药物从几乎一片空白发展到今天,已成为研发现代药物不可或缺的重要领域之一,而且其发展也越来越快。
过去几十年来,每年进入临床试验的多肽候选药物一直稳步增长。20世纪70年代以前,每年平均不到1个多肽药物进入临床试验;70年代,每年平均大约只有1个进入临床试验;而在80年代和90年代,每年平均进入临床试验的大约分别为5个和10个;21世纪前10年,进入临床试验的多肽药物数量攀升,每年平均大约有17个[2-3]。尤其是近一、二十年来,与多肽合成相关的技术、设备和工艺等方面得以迅速发展,直接导致了多肽药物研发成本和生产成本的大幅度下降,多肽药物的开发也因此进入到黄金时期。
其它现代科技的进步也带动了多肽领域的发展,这使多肽在医药行业和基础研究领域都赢得了越来越多的关注。如20世纪80年代发明的噬菌体展示技术(phage display)被越来越多地用来寻找新的多肽,用该技术可以发现完全新的、不被现有专利保护的、拥有自主知识产权的多肽新药。结构与计算机化学的应用也非常有助于对多肽药物的设计、模拟和预测,减少后续的研发成本。此外,基因重组技术、多肽载体技术、生物信息和系统生物学方法等的应用,丰富了多肽药物的开发手段和应用范围。正是各方面的进展使得多肽药物在过去十年来取得巨大的进展,有多达16个多肽药物被FDA批准为临床应用的上市药物(表1)。2012年更成为多肽研发成果最喜人、多肽药物被FDA批准最多的一年。这一年,FDA所批准的40个新药中就有6个是多肽新药[7,18]:替度鲁肽(teduglutide)、卡非佐米(car fi lzomib)、利那洛肽(linaclotide)、西那普肽(sinapultide)、帕瑞肽(pasireotide)和 peginesatide)[2,7](表 1)。2013年也有多个多肽新药已经或将被批准(如治疗2型糖尿病的lixisenatide)。预计未来会有越来越多的多肽药物获批准进入药物市场。然而,利用传统的化学合成方法开发多肽药物仍然是当前和未来相当长一段时间内全球新药研发的最有效、最重要的方向之一。

表 1 过去十年来批准上市的16个多肽药物[2,7]
5 多肽药物市场
多肽药物主要用于治疗癌症、代谢紊乱相关的重大疾病,这些疾病相关的药物拥有全球非常重要的市场[16]。目前,总的来说,全球药物市场上有大约60~70种多肽药物,如索马杜林(somatuline)、copaxone、诺雷德(zoladex)、sandostatin、促胰液素(secretin)、亮丙瑞林(leuprolide)、icatibant、雨蛙素(ceruletide)、比伐卢定(bivalirudin)、加压素(vasopressin)、伐普肽(vapreotide)、普兰林肽(pramlintide)、促肾上腺皮质激素(corticotropin)和杆菌肽(bacitracin)等等)[1-2,6-7],有200~300种多肽药物在临床试验中,有500~600种正在临床前试验中,更多的多肽药物在实验室研究阶段[1-3,7,15-16]。可以预见,未来会有越来越多的多肽药物获FDA批准进入药物市场。一些现有的多肽药物已经拥有可观的消费市场。有些药物如格拉替雷和奥曲肽的全球销量达到每年10亿美元以上。治疗骨质疏松的特立帕肽(teriparatide, forteo)和治疗糖尿病的艾塞那肽也接近10亿美元的年销量。尽管如此,在近万亿美元的全球药物市场中,多肽药物的市场份额仍然非常小,每年市场不到200亿美元,占全球药物市场<2%[1-2,19]。从另一方面而言,这刚好显示出多肽药物具有很广阔的上升空间。估计到2018年,整个生物类药物市场(包括合成多肽,重组表达多肽,蛋白和抗体)将达到每年700多亿美元,而多肽药物市场也将达到每年250亿美元[1,6],其市场成长也比整体药物市场成长快约两倍[1,6,19]。
在全球多肽药物市场中,美国是最主要的市场,拥有超过60%的市场份额;而欧洲拥有大约30%的市场份额;亚洲和其他各地共享剩余的大约10%的市场份额。其中,亚洲多肽药物市场又以日本为主,中国市场则非常小[1,21]。中国目前在市场销售的只有不到20个多肽药物,它们全为进口或仿制产品,还没有一个自主创新的多肽新药。这也说明多肽药物在中国具有很好的开发潜力和市场前景。中国政府也相应出台了各种政策和扶持手段,来鼓励和支持创新多肽药物的研究和开发。尽管中国在创新多肽药物研发方面基础薄弱,然而至少拥有数百家公司从事多肽原料和原料药方面的生产销售,占据着世界主要的原料市场。中国已经拥有良好的多肽药物开发基础和创新环境,也拥有巨大的人才优势,将这些优势转化为多肽药物的创新,是一个可探讨的、有吸引力的方向。
6 多肽药物面临的挑战
虽然多肽药物研发取得很大进展,但是多肽药物还面临着各种挑战。多肽药物研发的投资大,风险高,而且,合成技术、生产工艺和产品纯度等方面的问题导致产品质量达不到要求,或者成本过高等因素,这些都限制着多肽药物的发展。同时,不仅仅需要发现新的多肽药物,而且要找到新的输送技术或给药方式,以便于多肽药物一旦进入体内能继续维持稳定和活性。多肽药物目前主要是用静脉注射、皮下注射和肌肉注射等不同的给药方式,这些给药方式的不同也会影响多肽药物的药代动力学和生物活性。药物口服是最方便最受病人欢迎的方式[6,22-24],而多肽药物不能口服直接给病人带来诸多不便,这大大影响了多肽的应用和市场的推广。因此,多肽药物口服制剂是亟待解决的难题[4,6-7,24]。另一方面,生产工艺从一种到另一种的变化也是一种新的挑战。大批量生产可以降低成本,小批量生产会增加成本。尽管小规模合成条件非常成熟,如何将相关工艺应用于较大规模生产、提高工业化效率和降低生产成本,也仍然是个亟待解决的问题。长期以来,一直是以小分子化合物的标准作为统一的药物标准。然而,多肽药物完全不同于小分子化合物,如何针对多肽药物设定特定的标准也是需要考虑、解决的问题。因此,多肽药物开发的前景与挑战并存;而且,多肽药物研发更需要多学科、多领域科研工作者长期的协同合作,才能共同面对新挑战、开拓新局面[3-4,6-7,19]。
7 多肽药物的前景
近年来,现代技术和设备的迅速发展使得多肽生产成本大幅度的下降,多肽药物已进入黄金发展阶段。将来,多肽化学、重组蛋白生产、酶法合成、生物有机化学等多学科多领域可能有更多的交叉和融合,利用各自方面的优势来分工合作以解决上述诸多问题、提高效率和促进大规模化生产。生物重组技术的成熟,将更适合于大批量生产,尤其是有利于长链多肽的生产。生物信息技术将更好地预测多肽功能片段和可能的生物活性。新配方或辅助剂使多肽药物在室温下更加趋于稳定。长效多肽或者缓释系统能使更少量的多肽药物在更长时间内在人体内维持或者提高活性。口服给药问题将会持续取得进展,最终得以解决。这种给药方式将会给病人带来最大便利,同时也会有助于大幅度扩大多肽药物市场[7,16]。多肽药物(从大批量生产到纯化、从几个氨基酸的短肽到达数百个氨基酸的长肽)的生产、设备和工艺将来会有更显著的提高。如,医药企业和生产厂家正在考虑如何把批量化生产规模(一般规模为每年30~50 kg,很少超过每年100 kg)扩大到几百公斤甚至上吨,这将大幅度提高工业化效率和降低生产成本[19]。
其他现代技术如生物信息学、系统生物学方法、噬菌体展示技术和基因重组技术将会进一步完善,新的技术和方法会不断出现。如,将生物信息和系统生物学方法应用于多肽药物开发,将结构与计算化学应用于多肽药物设计,利用多肽的免疫原性来设计和开发多肽类疫苗。新的多肽载体技术也将有助于扩展多肽药物的开发和应用。该多肽载体技术是由美国杜兰大学医学院诺贝尔奖获得者Andrew Schally教授发明创造,他用多肽作为非靶向的癌症化疗药物的载体。这种多肽载体拥有高亲和力、高靶向特异性和高稳定性等特点,而且生产工艺简单,容易工业化。将非靶向的抗癌小分子药物连接到多肽载体上,构成全新的受体靶向的多肽载体抗癌药物。这些新的药物通过其癌细胞表面的特定受体将药物分子输送到特定癌细胞内,增加特异性,减少副作用,提高靶向抗癌效果[10-11,17,25]。除了作为癌症化疗药物载体外,多肽也可以广泛应用到其它方面[5,10-11,17,26]。此外,其他传统方面如药物配方、药物筛选、药物输送和化学修饰等方面的不断进展都将会进一步提高人们对多肽药物的期望值。
[1] Badiani K. Peptide as drugs[EB/OL]. [2013-12-20]. http://ipimediaworld.com/wp-content/uploads/2012/06/Pages-from-IPI-Volume4-Issue2-12.pdf.
[2] Reichert J. Development Trends for Peptide Therapeutics(2010 Report Summary) [EB/OL]. [2013-12-20]. http://www.peptidetherapeutics.org/PTF_report_summary_2010.pdf.
[3] Lax R. The Future of Peptide Development in the Pharmaceutical Industry[EB/OL]. [2013-12-20]. http://www.polypeptide.com/assets/002/5188.pdf.
[4] Vlieghe P, Lisowski V, Martinez J, et al. Synthetic therapeutic peptides: science and market[J]. Drug Discov Today, 2010,15(1-2): 40-56.
[5] Reubi JC. Peptide receptors as molecular targets for cancer diagnosis and therapy[J]. Endocr Rev, 2003, 24(4): 389-427.
[6] Craik DJ, Fairlie DP, Liras S, et al. The future of peptidebased drugs[J]. Chem Biol Drug Des, 2013, 81(1): 136-147.
[7] Lax R, Meenan C. Challenges for therapeutic peptides part 1:on the inside, looking out[EB/OL]. [2013-12-20]. http://www.polypeptide.com/assets/002/5260.pdf.
[8] Marx V. Watching peptide drugs grow up[J]. Chem Eng News, 2005, 83(11):17-24.
[9] Sun L. Peptide-based drug development[EB/OL]. [2013-12-20]. http://www.esciencecentral.org/journals/peptide-baseddrug-development-2329-6798.1000e103.pdf.
[10] Schally AV, Engel JB, Emons G, et al. Use of analogs of peptide hormones conjugated to cytotoxic radicals for chemotherapy targeted to receptors on tumors[J]. Curr Drug Deliv, 2011, 8(1): 11-25.
[11] Sun LC, Coy DH.. Cytotoxic conjugates of peptide hormones for cancer chemotherapy[J]. Drugs Future, 2008, 33(3): 217-223.
[12] Yamada A, Sasada T, Noguchi M, et al. Next-generation peptide vaccines for advanced cancer[J]. Cancer Sci,2013,104(1):15-21.
[13] Khafagy el-S, Morishita M. Oral biodrug delivery using cellpenetrating peptide[J]. Adv Drug Deliv Rev, 2012, 64(6):531-539.
[14] Madani F, Lindberg S, Langel U, et al. Mechanisms of cellular uptake of cell-penetrating peptides[J]. J Biophys,2011: 414729. doi: 10.1155/2011/414729.
[15] Thayer AM. Improving peptides: small fi rms develop better peptide drug candidates to expand this pharmaceutical class and attract big pharma partners[J]. Chem Eng News, 2011,89(22): 13–20.
[16] Bellmann-Sickert K, Beck-Sickinger AG. Peptide drugs to target G protein-coupled receptors[J]. Trends Pharmacol Sci,2010, 31(9): 434-441.
[17] Sun L, Coy DH. Somatostatin receptor-targeted anti-cancer therapy[J]. Curr Drug Del, 2011, 8(1): 2-10.
[18] Thomas D. A big year for novel drugs approvals,biotechnology industry organization[EB/OL]. [2013-01-17].http://www.biotech-now.org/business-and-investments/insidebio-ia/2013/01/a-big-year-for-novel-drugs-approvals#.
[19] Glaser V. Scaling up peptide drugs[J]. Genet Eng Biotechnol News, 2013, 33(7): 54-55.
[20] Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. J Nat Prod,2012, 75(3): 311-335.
[21] McGee P. First successes turn tide for peptide therapeutics[EB/OL]. (2007-09-06)[2013-12-20]. http://www.dddmag.com/articles/2007/09/ fi rst-successes-turn-tide-peptide-therapeutics.
[22] Grant M, Leone-Bay A. Peptide therapeutics: it’s all in the delivery[J]. Ther Deliv, 2012, 3(8): 981-996.
[23] Lax R, Meenan C. Challenges for therapeutic peptides part 2: delivery systems[J]. http://www.polypeptide.com/assets/002/5261.pdf.
[24] Hamman JH, Enslin GM, Kotzé AF. Oral delivery of peptide drugs: barriers and developments[J]. BioDrugs, 2005, 19(3):165-177.
[25] Keller G, Schally AV, Nagy A, et al. Effective therapy of experimental human malignant melanomas with a targeted cytotoxic somatostatin analogue without induction of multidrug resistance proteins[J]. Int J Oncol, 2006, 28(6): 1507-1513.
[26] Kubo T, Yanagihara K, Sato Y, et al. Enhancement of gene silencing effect and membrane permeability by peptideconjugated 27-nucleotide small interfering RNA[J].Molecules, 2012, 17(9): 11089-11102.
