替米沙坦通过上调PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究
2014-10-25储著凌霍中华侯乐伟栾荣刚胡国强
尹 鹏,胡 君,储著凌,霍中华,侯乐伟,吕 盛,栾荣刚,胡国强
(解放军第四五四医院普外烧伤整形外科,江苏 南京 210002)
结肠癌(colon cancer)是最常见的消化道恶性肿瘤之一,近年来发病率和死亡率逐年增加[1~3]。浸润和转移是恶性肿瘤最主要的生物学特征,也是影响治疗效果和预后的主要因素[1~3]。目前的研究发现,氧化物酶体增殖激活受体γ(peroxisome proliferatorsactivated receptor gamma,PPAR-γ)对于肿瘤细胞的转移和增殖过程具有重要的调节作用[4,5]。同时发现血管紧张素受体1(AT1R)阻断剂(ARB)如替米沙坦和厄贝沙坦等,能够有效促进PPAR-γ的合成[6]。同时研究证实,PPAR-γ对组织抑制剂-1(TIMP-1)的表达有重要的调节作用。本实验的目的是观察ARB是否能够通过上调PPAR-γ的表达促进结肠癌SW480细胞TIMP-1的表达和对细胞增殖的影响。
1 材料和方法
1.1 主要试剂和材料 PCR试剂盒购自宝生物工程有限公司;鼠抗人TIMP-1抗体、鼠抗人PPAR-γ抗体和鼠抗人β-actin抗体购于美国Santa Cruz公司;替米沙坦(美国Sigma公司),DMEM培养基(美国Gibco公司),小牛血清(杭州四季青);MTT试剂盒(美国Promega公司),超纯水;其余试剂均为分析纯。
1.2 细胞培养 SW480细胞常规接种在含10%胎牛血清、100g/L 青霉素、100g/L 链霉素的 RPMI 1640培养液中,置于37℃、95%空气、5%CO2孵箱内培养。每48小时换液、传代1次,取对数生长期细胞用于实验。
1.3 细胞活性检测 取对数生长期细胞消化制成单细胞悬液,接种于96孔培养板中,每孔接种100μl约含5×103个细胞。贴壁后无血清培养细胞16~24h,使细胞同步化。空白对照组加入PBS,阳性实验组加入替米沙坦,终浓度为100μmol/L (100μM),在37℃、5%CO2条件下培养细胞。使用MTT比色试验对不同时间点 (0、24和72h)的细胞生长状态进行测定,实验重复4次。细胞活性(%)= (OD干预组/OD对照组)×100%[7]。
1.4 细胞TIMP-1和PPAR-γmRNA表达检测 按照RT-PCR试剂盒说明书提取细胞总RNA。以2μg总RNA为模板,用Oligo(dT)18作为引物,按照试剂盒说明书介绍要求合成cDNA第1链。TIMP-1正义 5′-GCAACTCCGACCTTGTCATC-3′,反 义 5′-AGCGTAGGTCTTGGTGAAGC-3′;PPAR-γ 正 义5′-TCTCTCCGTAATGGAAGACC-3′, 反 义 5′-GCTGTCACCTTCACCGTTCC-3′;β-actin 正 义:5′-CTCCATCCTGGCCTCGCTGT-3′,反 义:5′-GCTGTCACCTTCACCGTTCC-3′,PCR反应体系如下:2 μl逆转录产物模板、PCR Master Mix(2×)25μl、正反引物各2μl,以超纯水补充至50μl。PCR反应条件为:96℃5min;91℃30s,56℃60s,73℃60s,循环35轮,最后74℃延伸10min。PCR产物8μl与5×loading buffer 2μl混匀后,1.2%琼脂糖凝胶20V/cm电压进行电泳约30min。应用凝胶成像系统(Biorad)摄影,Quantity One软件对目的条带进行扫描分析。用与β-actin PCR产物条带灰度比值作为TIMP-1和PPAR-γmRNA的相对表达量。
1.5 Western blot法检测细胞中TIMP-1和PPAR-γ蛋白表达 按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1小时,分别加入鼠抗人单克隆抗 体 TIMP-1 (1∶500)、PPAR-γ(1∶400)和β-actin(1∶1500),4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
2 结果
2.1 MTT法细胞活性测定结果分析 干预时间0、24、72小时时细胞活性依次为98.0±3.5、62.1±18.6和29.8±11.2,结果显示,随时间变化,替米沙坦组SW480细胞活性逐渐减低,明显低于对照组(均P<0.05),且各时间点间的细胞活性存在显著统计学差异(均P<0.05)。
2.2 TIMP-1和PPAR-γmRNA 的表达 在给予替米沙坦干预后,在0、24和72h时对SW480细胞TIMP-1和 PPAR-γmRNA 的表达显示,TIMP-1和PPAR-γmRNA的表达呈时间依赖性递增(均P<0.05),见表1、图1。
表1 TIMP-1和PPAR-γmRNA的表达(n=4,)Table 1 The mRNA expression of TIMP-1and PPAR-γin SW480cells

表1 TIMP-1和PPAR-γmRNA的表达(n=4,)Table 1 The mRNA expression of TIMP-1and PPAR-γin SW480cells
注:①与0h比较,P<0.05;②与24h比较,P<0.05
干预时间0h 24h 72h TIMP-1mRNA 0.18±0.02 0.58±0.07① 0.72±0.19①②PPAR-γmRNA 0.21±0.06 0.42±0.12① 0.89±0.21①②
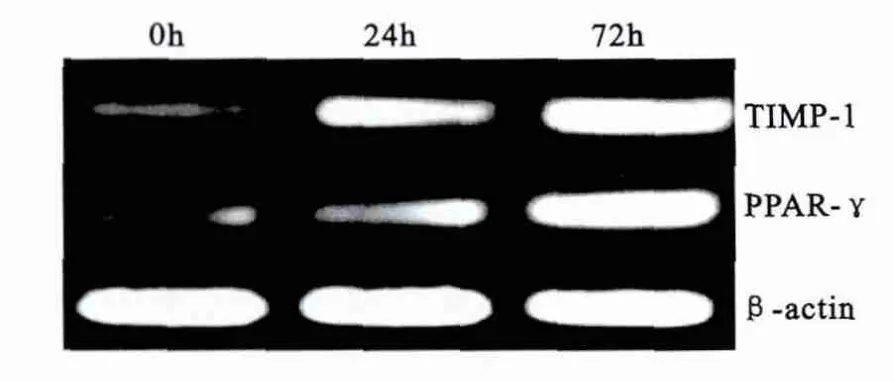
图1 TIMP-1和PPAR-r mRNA的表达Figure 1 The expression of TIMP-1and PPAR-r mRNA
2.3 TIMP-1和PPAR-γ蛋白的表达 在给予替米沙坦干预后,在0、24和72h时对SW480细胞TIMP-1和PPAR-γ蛋白表达显示,TIMP-1和 PPAR-γ蛋白表达呈时间依赖性的递增(均P<0.05),见表2。
表2 TIMP-1和PPAR-γ蛋白表达(n=4,)Table 2 The protein expression of TIMP-1and PPAR-γin SW480cells

表2 TIMP-1和PPAR-γ蛋白表达(n=4,)Table 2 The protein expression of TIMP-1and PPAR-γin SW480cells
注:①与0h比较,P<0.05;②与24h比较,P<0.05
干预时间0h 24h 72h TIMP-1蛋白 0.24±0.03 0.52±0.11① 0.76±0.13①②PPAR-γ蛋白 0.19±0.05 0.39±0.06① 0.81±0.19①②

图2 TIMP-1和PPAR-r蛋白的表达Figure 2 The expression of TIMP-1protein
3 讨论
目前由于饮食结构和生活习惯的改变,结肠癌以成为导致人类癌症死亡的最常见的消化道恶性肿瘤之一,其发病率和死亡率呈逐年升高,同时流行病学调查显示结肠癌的发病人群有年轻化趋势[1~3]。
侵袭和转移是恶性肿瘤最明显的特征,也是导致肿瘤复发的重要原因。目前对于以抑制肿瘤转移为目标的研究方兴未艾,是肿瘤研究的热点之一。肿瘤细胞侵袭转移到邻近组织及远处器官是一个多步骤的复杂过程。肿瘤细胞首先必须具备降解细胞外基质(extracellular matrix ECM)及基底膜(basement membrane,BM)的功能,而这个降解功能主要有蛋白水解酶完成。基质金属蛋白酶(matrix metalloproteinases,MMPs)是蛋白水解酶中重要的一类。近年发现,MMPs主要是通过对基底膜(BM)和ECM的降解和增强肿瘤血管的生成促进肿瘤细胞的侵袭、浸润和转移。MMPs超家族具有相似的基本结构包括前肽区域、信号肽区域、催化活性区域、类血红素蛋白结合区、ECM 同源序列区域和铰链区[8,9]。组织抑制剂(TIMPs)是近年来发现的抑制MMPs活性的多功能因子家族,是一组低分子量的糖蛋白,主要由成纤维细胞、上皮细胞、内皮细胞等合成和分泌。已发现的TIMPs酶有5种,为组织中MMPs主要的内源性抑制因子,能特异地抑制MMPs家族的基质降解酶。TIMP-1是TIMPs中的一种,研究发现在多种肿瘤细胞中呈现高表达,并认为TIMP-1的表达与肿瘤细胞的分化程度、浸润和转移能力密切相关[9,10]。TIMP-1具有IV型胶原酶的作用,对IV型胶原和纤维连接蛋白(FN)有降解作用。TIMP-1的表达和活化可以受基因转录、酶原活化和抑制剂等多水平的调控[9,10]。研究发现PPAR-γ在TIMP-1的表达调控过程中扮演着重要的角色[11]。
过氧化物酶体增殖激活受体γ(peroxisome proliferators-activated receptor gamma,PPAR-γ)属于PPAR的亚型之一,可通过蛋白-蛋白相互作用和竞争辅助因子调控核转录因子-κB(NF-κB)、转录激活因子(STAT)和活化蛋白-1(AP-1)等多个重要的肿瘤发生发展相关的核转录因子,进而对多种肿瘤细胞的侵袭、转移、增殖和凋亡等过程起调节作用[4~8]。进一步研究还发现,PPAR-γ在包括肺癌等多种恶性肿瘤中表达明显下降,同时发现上调PPAR-γ的表达可以有效的促进包括A549细胞和Hela细胞等多种肿瘤细胞的凋亡,抑制多种与肿瘤转移和浸润相关分子(如 MMPS和 VEGF等)的合成和表达[4~8]。目前PPAR-γ已成为治疗肿瘤的热点。
多个研究发现,血管紧张素受体1(AT1R)阻断剂(ARB)可以有效地上调PPAR-γ的表达抑制炎症反应和肿瘤的生长,并认为该过程可能与血管紧张素系统(RASS)无关[6]。在我们的研究中,发现在给予SW480细胞替米沙坦100μmol/L干预后,SW480细胞活性呈时间依赖性降低。该结果表明,替米沙坦具有抑制SW480细胞增殖的作用。进一步使用PTPCR和western blot分析发现SW480细胞TIMP-1和PPAR-γmRNA和蛋白表达在替米沙坦干预后呈时间依赖性降低。该结果表明替米沙坦可以通过促进TIMP-1的表达抑制SW480细胞的粘附和侵袭能力,并可能与上调PPAR-γ的表达密切相关。
4 结论
本实验结果表明,替米沙坦可能通过上调SW480细胞中PPAR-γ的表达促进TIMP-1的合成,并导致肿瘤的生长和侵袭能力的降低。但具体的机制还有待进一步研究。
[1]Nishihara R,Wu K,Lochhead P,et al.Long-term colorectalcancer incidence and mortality after lower endoscopy[J].N Engl J Med,2013,369(12):1095-1105.
[2]Ben-Ishay O,Brauner E,Peled Z,et al.Diagnosis of colon cancer differs in younger versus older patients despite similar complaints[J].Isr Med Assoc J,2013,15(6):284-287.
[3]邹 毅,张 军,夏 全,等.左、右半结肠癌合并肠梗阻一期切除的对比研究 [J].西部医学,2010,22(12):2269-2270.
[4]Groblewska M,Siewko M,Mroczko B,et al.The role of matrix metalloproteinases(MMPs)and their inhibitors(TIMPs)in the development of esophageal cancer[J].Folia Histochem Cytobiol,2012,50(1):12-9.
[5]Lee JJ,Drakaki A,Iliopoulos D,et al.MiR-27btargets PPARγ to inhibit growth,tumor progression and the inflammatory response in neuroblastoma cells[J].Oncogene,2012,31(33):3818-3825.
[6]Chen Y,Luo Q,Xiong Z,et al.Telmisartan counteracts TGF-β1induced epithelial-to-mesenchymal transition via PPAR-γin human proximal tubule epithelial cells [J].Int J Clin Exp Pathol,2012,5(6):522-529.
[7]Wei D,Peng JJ,Gao H,et al.Digoxin Downregulates NDRG1 and VEGF through the Inhibition of HIF-1α under Hypoxic Conditions in Human Lung Adenocarcinoma A549Cells[J].Int J Mol Sci,2013,14(4):7273-7285.
[8]陈 兢,王 伟,游 潮,等.异种 MMP-2DNA疫苗对小鼠结肠腺癌细胞CT26生长及转移的实验研究[J].西部医学,2008,20(01):20-23.
[9]Mansure JJ,Nassim R,Chevalier S,et al.A novel mechanism of PPAR gamma induction via EGFR signalling constitutes rational for combination therapy in bladder cancer[J].PLoS One,2013,8(2):e55997.
[10]Shen D,Deng C,Zhang M.Peroxisome proliferator-activated receptor gamma agonists inhibit the proliferation and invasion of human colon cancer cells[J].Postgrad Med J,2007,83(980):414-419.
