瑞舒伐他汀抑制小鼠哮喘模型慢性气道炎症反应的实验研究*
2014-10-25王导新李万成
张 维,朱 涛,王导新,邓 洁,李万成
(1.成都医学院第一附属医院,四川 成都 610000;2.四川大学华西医院呼吸内科,四川 成都 610041;3.重庆医科大学附属第二医院呼吸内科,重庆 400010)
支气管哮喘(bronchial asthma)简称哮喘,目前被定义为由多种细胞和细胞组分参与的慢性气道炎症性疾病[1~3]。慢性持续的气道炎症是哮喘的根本原因[1~3]。虽然GINA指南的广泛推广和接受,以及吸入激素(ICS)和长效β2激动剂(LABA)的使用使哮喘的临床控制有所提高,但是哮喘的死亡率和急诊住院率并未有明显改善[1~3]。新的治疗药物的研究仍然是哮喘研究热点。目前发现他汀类药物具有广泛的抗炎作用和免疫调节作用[4~6]。本研究旨在探讨瑞舒伐他汀在慢性哮喘模型中的抗炎作用和治疗价值。
1 材料与方法
1.1 实验动物 SPF级雄性BALB/C小鼠30只,6~8周龄,体重18~22g(四川大学实验动物中心提供);卵清蛋白(ovalbumin,OVA)购于美国Sigma公司;瑞舒伐他汀购于瑞典阿斯利康公司;TNF-α、IL-4、IL-5和IL-13ELISA试剂盒均购于美国R&D公司。
1.2 动物模型建立 在实验的第1、7、14天通过腹腔注射10μgOVA和100μgAL(OH)3配制成的溶液致敏。从第15~81天将小鼠置于特制塑料容器内,用超声雾化器喷入5%OVA生理盐水10ml激发1小时。OVA激发后小鼠出现烦躁、呛咳、呼吸加快及轻度紫绀等哮喘发作症状[2]。实验动物分为3组,即空白对照组(Control group)、卵清蛋白+瑞舒伐他汀(OVA+RUS group)和卵清蛋白组(OVA group),每组10只,分笼饲养。①Control组:注射等量0.9%生理盐水代替OVA,并吸入0.9%生理盐水10ml,余同OVA组。②OVA组:按上述方法制备哮喘模型。③OVA+RUS组:每次激发前30min皮下注射瑞舒伐他汀(30mg/kg·d),15~81天。在实验的81天腹腔注射戊巴比妥(50mg/Kg)麻醉小鼠,下腔静脉放血处死,并将生理盐水注入右心室冲洗两次以洗尽肺内残留血液。
1.3 支气管肺泡灌洗液(BALF)细胞计数 末次雾化吸入24小时后,以1%戊巴比妥钠(50mg/kg)腹腔注射麻醉后,以静脉留置导管作气管插管遥以1、0.8 ml磷酸盐缓冲液(PBS)分2次作支气管肺泡灌洗,并收集BALF 1ml。BALF在4°C下以400r/min离心5min,沉渣以100μl PBS液重悬。使用Diff-Quik染色后做细胞分类计数。下腔静脉放血处死小鼠,打开胸腔,结扎右总支气管于远端切下放于10%中性甲醛中保存。
1.4 支气管肺泡灌洗液(BALF)细胞因子水平分析根据购买公司试剂盒方法对BLAF中TNF-α、IL-4、IL-5和IL-13水平进行分析。
1.5 HE染色和PAS染色 取右下肺组织,常规制成5μm的石蜡切片,HE染色观察小鼠肺组织病理改变。PAS染色法检测肺组织粘蛋白糖原表达情况,粘蛋白糖原呈PAS阳性染色,气道PAS阳性细胞主要为杯状细胞和粘液腺细胞,其定量分析可代表气道粘液表达水平。肺组织PAS染色后,对每只小鼠随机取至少10个直径在100~200μm支气管进行PAS阳性细胞和PAS阴性细胞计数,并用PAS阳性细胞/支气管总细胞的百分比来表示。切片采用Image-Pro Plus(Media Cybernetics,Silver Spring,Md)图像分析系统进行分析[2]。
2 结果
2.1 BALF中细胞计数水平 OVA致敏和激发后小鼠BALF中细胞总数、嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞数明显增加(均P<0.05),同时与OVA+RUS组相比较,OVA组增加更加显著(均P<0.05),见表1。
2.2 BALF中细胞因子水平 OVA致敏和激发后小鼠BALF中 TNF-α、IL-4、IL-5 和 IL-13水平明显增加(均P<0.05),同时与 OVA+RUS组相比较,OVA组增加更加显著(均P<0.05),见表2。
2.3 小鼠肺组织病理学变化与气道粘液分泌 肺组织切片常规HE染色和PAS染色,光镜下观察。空白组小鼠肺组织中小气道及血管周围未见炎症细胞浸润,支气管柱状上皮细胞无增生,无杯状细胞增生,基底膜下未见平滑肌增殖,管腔未见狭窄;OVA组小鼠肺组织中小气道及血管周围有大量炎症细胞浸润,支气管上皮细胞增生明显,杯状细胞明显增多,粘液分泌增多,基底膜增厚明显,并见显著平滑肌增殖;OVA+RUS组小鼠肺组织中小气道及血管周围可见炎症细胞浸润,支气管上皮细胞增生,杯状细胞增加,粘液分泌增多,基底膜增厚和平滑肌增殖,但无OVA组显著。同时PAS染色发现,OVA致敏和激发后小鼠支气管PAS阳性细胞数较空白组明显增加,差异有显著统计学意义(P<0.05),且与OVA+RUS组比较,OVA组增加更明显,差异有显著统计学意义(P<0.05),见图1、2,表3。
表1 各组BALF中细胞水平计算(×104/ml,n=10,)Table 1 The cells in BALF

表1 各组BALF中细胞水平计算(×104/ml,n=10,)Table 1 The cells in BALF
注:①与对照组比较,P<0.05;②与OVA组比较,P<0.05
3.2±1.6 0±0 0±0 0.9±0.2 1.5±0.4 OVA+RUS组 12.4±2.5①② 2.1±0.4①② 1.5±0.4①② 2.2±0.8①② 2.6±0.9①②OVA组 23.4±4.8① 4.2±0.8① 3.1±0.6① 4.1±0.9① 5.1±1.1组别 细胞总数 嗜酸性粒细胞 中性粒细胞 淋巴细胞 巨噬细胞对照组①
表2 各组BALF中细胞因子水平(n=10,)Table 2 The cytokines in BALF

表2 各组BALF中细胞因子水平(n=10,)Table 2 The cytokines in BALF
注:①与对照组比较,P<0.05;②与OVA组比较,P<0.05
组别 IL-4(×102 pg/ml) IL-5(×102 pg/ml) IL-13(×103 pg/ml) TNF-α(×103 pg/ml)1.27±0.25 4.55±0.12 0.82±0.16 1.03±0.13 OVA+RUS组 1.64±0.37①② 8.24±1.36①② 1.46±0.31①② 1.36±0.24①②OVA组 2.69±0.86① 14.33±2.54① 3.21±0.48① 3.67±0.74对照组①
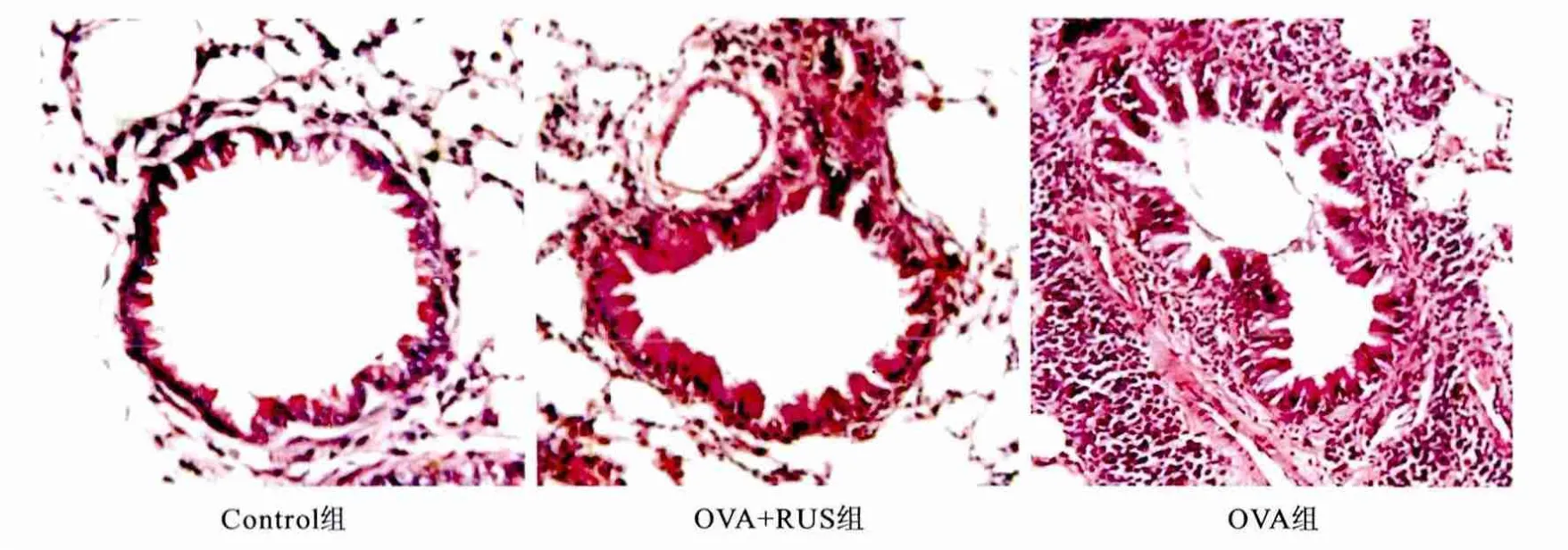
图1 各组小鼠肺组织病理改变(HE染色×400)Figure 1 The pathological changes of lung(HE Staining×400)

图2 各组小鼠肺组织糖蛋白表达情况 (PAS染色×400)Figure 2 The glycoprotein in the mice
表3 各组小鼠气道糖原表达PAS染色百分数(n=10,)Table 3 The percent of clycogen and PAS

表3 各组小鼠气道糖原表达PAS染色百分数(n=10,)Table 3 The percent of clycogen and PAS
注:①与对照组比较,P<0.05;②与OVA组比较,P<0.05
组别 PAS染色百分数 (×10-2)3.6±2.6 OVA+RUS组 37.8±7.9①②OVA组 58.4±10.2对照组①
3 讨论
支气管哮喘(bronchial asthma)简称哮喘,目前定义为一种由多种细胞(包括嗜酸性粒细胞、中性粒细胞、肥大细胞和淋巴细胞等)和细胞组分(包括多种细胞因子和炎症介质)参与的慢性气道炎症性疾病[1~3]。虽然近些年随着GINA指南知识的普及,吸入激素(ICS)和长效β2激动剂(LABA)的联合应用的推广使哮喘的临床控制水平有了较大幅度提高,但是慢性哮喘患者的受益却仍然有限[1~3,7]。目前认为慢性哮喘可以引起气道重构(airway remodeling),并导致气道不完全可逆性狭窄[1~3]。气道重构的主要表现包括气道上皮细胞增殖,杯状上皮细胞化生,粘液分泌增加,气道上皮基底膜增厚,基底膜下胶原沉积,气道平滑肌细胞(ASM)增生肥大及肺小血管的增殖性改变等[2,8~10]。
他汀类药物主要通过抑制羟甲基戊二酰辅酶A(HMG-CoA)还原酶改善机体的脂肪代谢。但目前的研究发现,他汀类药物还具有除改善脂代谢以外,还具有抑制炎症反应、氧化应激、凋亡以及抗肿瘤等多种作用,同时发现这些作用与抑制羟甲基戊二酰辅酶A (HMG-CoA)还原酶无明显的联系[4~6,11]。目前研究证实,他汀类药物的抗炎作用与抑制核转录因子-κB(NF-κB)密切相关[6]。瑞舒伐他汀是他汀类药物中作用较强的制剂。
我们的实验中,HE染色提示肺组织出现明显的病理改变,包括小气道及血管周围有大量炎症细胞浸润,支气管上皮细胞增生明显,杯状细胞明显增加,粘液分泌增多,基底膜增厚明显和显著的平滑肌增殖。但与OVA组相比较,OVA+RUS组病理改变较轻,表明瑞舒伐他汀能够有效抑制OVA诱导的小鼠肺组织的炎症反应。同时研究认为,哮喘相关的炎症状态可导致气道柱状上皮细胞向杯状上皮细胞化生,导致气道粘液分泌明显增加[1~3]。气道粘液过度分泌可以导致气道不可逆性阻塞,是致死性哮喘和难治性哮喘的重要原因[1~3]。
4 结论
瑞舒伐他汀可以有效抑制OVA诱导的慢性哮喘导致的炎症反应和气道粘液分泌,缓解气道狭窄。但具体的分子机制仍需要进一步探讨。
[1]von Mutius E,Hartert T.Update in asthma 2012[J].Am J Respir Crit Care Med,2013,188(2):150-156.
[2]朱 涛,任旭斌,朱 静,等.γ-氨基丁酸 A型受体调节哮喘动物模型气道重构的实验研究[J].南方医科大学学报,2010,30(4):842-846.
[3]李祖敏,黄铮铮.甘草酸二铵辅助治疗咳嗽变异性哮喘发作期的临床研究[J].西部医学,2012,24(11):2081-2083.
[4]Spite M,Serhan CN.Novel lipid mediators promote resolution of acute inflammation:impact of aspirin and statins[J].Circ Res,2010,107(10):1170-1184.
[5]Zeki AA,Kenyon NJ,Goldkorn T.Statin drugs,metabolic pathways,and asthma:a therapeutic opportunity needing further research[J].Drug Metab Lett,2011,5(1):40-44.
[6]Ni XQ,Zhu JH,Yao NH,et al.Statins suppress glucose-induced plasminogen activator inhibitor-1expression by regulating RhoA and nuclear factor-κB activities in cardiac microvascular endothelial cells[J].Exp Biol Med(Maywood),2013,238(1):37-46.
[7]李 蕴,梁宗安,李素云,等.复方黄龙汤对哮喘小鼠气道炎症的影响与机制[J].西部医学,2012,24(11):2051-2056.
[8]YunYan X,Shuhe W,Mingyao L,et al.A GABAergic system in airway epithelium is essential for mucus overproduction in asthma[J].Nat Med,2007,13(7):862-867.
[9]Malik S,Sharma AK,Bharti S,et al.In vivo cardioprotection by pitavastatin from ischemic-reperfusion injury through suppression of IKK/NF-κB and upregulation of pAkt-e-NOS[J].J Cardiovasc Pharmacol,2011,58(2):199-206.
[10]Alexeeff SE,Litonjua AA,Sparrow D,et al.Statin use reduces decline in lung function:VA Normative Aging Study[J].Am J Respir Crit Care Med,2007,176:742-747.
[11]Schonbeck U,Libby P.Inflammation,immunity,and HMGCoA reductase inhibitors:statins as antiinflammatory agents[J].Circulation,2004,109:II18-II26.
