pCS-CG-DsRed2-vigilin重组载体的构建及vigilin重组慢病毒包装*
2014-10-25沈文燕杨文理刘秋英俞小琴
沈文燕,李 冉,覃 扬,杨文理,刘秋英,魏 玲,俞小琴
(四川大学华西基础医学与法医学院生物化学与分子生物学教研室,四川 成都 610041)
Vigilin(人高密度脂蛋白结合蛋白)是一个高度进化保守的多功能蛋白质,含有14个KH结构域。目前已经发现多KH结构域蛋白在RNA的代谢方面起重要作用[1]。Vigilin的同源物Scp 160(酵母多KH结构域RNA结合蛋白)和DDP1(果蝇着丝粒结合蛋白)在维持DNA、RNA的结构和功能中均起重要作用。其中DDP1包含15个KH结构域,它能结合单链核酸进而发挥其作用[2]。DDP1参与维持DNA结构功能的稳定和臂间异染色质的形成[3]。目前已发现Vigilin在脂代谢以及染色体分离,mRNA代谢,转录,维持细胞结构功能稳定方面起重要作用[4~6]。Vigilin作为一个多功能蛋白质,研究其在生物体内的作用显得尤为重要。
慢病毒载体是在人免疫缺陷Ⅰ型病毒(HIV-1)的基础上发展起来的,使用慢病毒包装系统建立的慢病毒能够感染分裂细胞,终末分化细胞和非分裂细胞,并能将目的基因高效的整合到宿主细胞染色体中,整合基因理论上能在细胞中永久表达。随着慢病毒载体的逐渐改造,目前使用的慢病毒包装系统包装的慢病毒具有较高的生物安全性。慢病毒载体作为一种理想的基因转移载体正在被越来越多的神经科学、基因功能研究,基因表达等领域的科研工作者所接受[7~9]。因此,我们构建了pCS-CG-DsRed2-vigilin重组慢病毒载体,包装的重组病毒能较好的感染HEK293T和HepG2细胞,为后续研究在生物学形态方面vigilin功能提供了良好的生物材料。
1 材料和方法
1.1 材料
1.1.1 细胞株 人胚肾细胞HEK293T,人肝癌细胞系HepG2均为本实验室保存。均采用含10%FBS(民海生物)的DMEM(GIBCO)培养基培养。
1.1.2 菌种载体及工具酶 大肠杆菌DH5α为本实验室保存;慢病毒相关载体pSPAX2,pMD2.G,pCSCG由德克萨斯州大学刘建余博士惠赠,去除绿色荧光蛋白GFP的重组质粒pCS-CG-vigilin为本实验室杨文理博士构建;T4DNA连接酶及各种限制性内切酶购自Thermo公司。
1.1.3 转染试剂聚乙烯亚胺PEI购自polysciences公司,Polybrene购自Invitrogen公司,质粒小提试剂盒和DNA凝胶回收纯化试剂盒购自OMEGA公司。恒温水浴箱(金坛市医疗仪器厂),恒温摇床(Beckman公司),二氧化碳培养箱(Thermo公司),操净工作台(苏 净),凝胶成像仪 (Bio-Rad公司),ECLIPSE TE2000S荧光倒置显微镜(Nikon)。
1.2 方法
1.2.1 重组质粒的构建 穿梭质粒pcDNA3.1(-)-DsRed2的构建:用NheⅠ、NotⅠ将DsRed2基因目的片段从pDsRed2-N1上切下,DNA凝胶电泳回收后,用T4连接酶连入穿梭载体pcDNA3.1(-)上,并转入DH5α感受态细胞中,挑选单克隆用Nhe-Ⅰ、NotⅠ鉴定,鉴定正确后的阳性克隆送北京诺赛基因测序,插入了目的片段的质粒命名为pcDNA3.1(-)-DsRed2。重组质粒pCS-CG-DsRed2-vigilin的构建:将构建好的穿梭质粒pcDNA3.1(-)-DsRed2和pCS-CG-vigilin分别用KpnⅠ单酶切回收后连接并转转入DH5α感受态细胞中,挑选单克隆分别用KpnⅠ和SacⅡ单酶切鉴定,酶切鉴定正确后送测序,插入了目的片段的质粒命名为 pCS-CG-DsRed2-vigilin,重组的 pCSCG-DsRed2-vigilin部分酶切点图谱见图1。
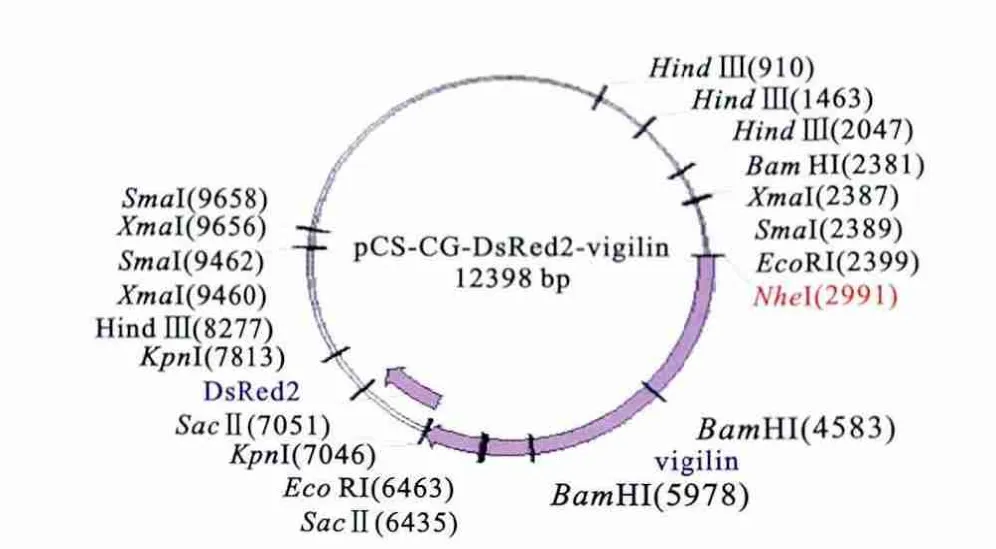
图1 重组慢病毒载体pCS-CG-DsRed2-vigilin图谱Figure 1 Map of the recombinant lentiviral vector pCS-CG-DsRed2-vigilin
1.2.2 重组慢病毒包装 分别提取慢病毒载体pCSCG、重组载体pCS-CG-DsRed2-vigilin 和包装质粒pSPAX2,pMD2.G,利用PEI共转染入 HEK293T细胞,具体转染方法为:将9μgPEI和3μg质粒分别溶于DMEM中,其中三种质粒的质量比为pCS-CGDsRed2-vigilin∶pSPAX2∶pMD2.G=4∶3∶1,室温孵育20min后将两者混匀,室温孵育25min,将质粒与PEI的混合物逐滴缓慢加于6cm培养皿中,6小时后更换新鲜完全培养基(DMEM+10%FBS),转染24小时后收集慢病毒,另加5ml新鲜完全培养基,再培养24小时后收集病毒,将收集好的病毒用0.45μm的滤器过滤以除去细胞碎片,分装,保存于-70℃备用。
2 结果
2.1 pCS-CG-DsRed2-vigilin载体构建 首先在构建的pcDNA3.1(-)-DsRed2中,挑选单克隆用 NheⅠ、NotⅠ双酶切鉴定,挑选的6个克隆经酶切后电泳如图2所示,其中1、3、5、7、9、11为 NheⅠ、NotⅠ酶切产物,2、4、6、8、10、12为未经酶切的相应克隆质粒。1、3、5、7、9、11均显示预期的5.4kb和767bp两条电泳条带,送北京诺赛基因测序,测序结果表明,与报道的pDsRed2—N1中DsRed2的基因序列相同。
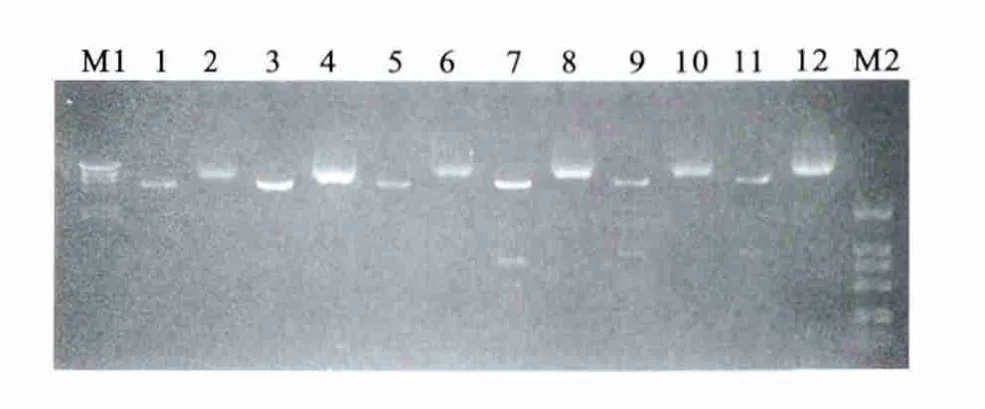
图2 质粒pcDNA3.1(-)-DsRed2的鉴定Figure 2 Identification of plasmid pcDNA3.1(-)-DsRed2
已成功插入DsRed2目的片段的pcDNA3.1(-)-DsRed2中有两个 Kpn1的酶切点,pCS-CG-vigilin C末端紧接一个Kpn1的酶切点,将pcDNA3.1(-)-DsRed2、pCS-CG-vigilin分别用 Kpn1单酶切后回收连接转化,挑选单克隆先用Kpn1酶切鉴定,连接上 DsRed2 的pCS-CG-DsRed2-vigilin应有一个片段大小约800bp的insert切下,见图3;再将带有DsRed2insert的质粒用SacⅡ单酶切鉴定插入的DsRed2基因的方向是正向还是反向,如果有600bp的插入子切下则DsRed2的连接方向正确,如有1400bp的insert切下则DsRed2连接方向错误。正确的克隆见图4。将酶切鉴定正确的克隆送测序,测序结 果 显 示,DsRed2 已 连 到 pCS-CG-DsRed2-vigilin上,且方向正确。
2.2 重组慢病毒的包装及鉴定 将重组表达型载体pCS-CG-DsRed2-vigilin和包装质粒pSPAX2,pMD2.G共转染HEK293T细胞,24小时后收集慢病毒,再加5ml新鲜完全培养基,继续培养至48h收集慢病毒,过滤,分装。将收集的慢病毒分别感染HEK293T和HepG2细胞,将已经感染的细胞培养48小时后于荧光倒置显微镜下观察红色荧光,见图5、6,所示较明显的红色荧光,说明慢病毒已成功生产,将同一视野自然光和荧光的图片对比发现,重组慢病毒可高效的感染HEK293T和HepG2细胞。
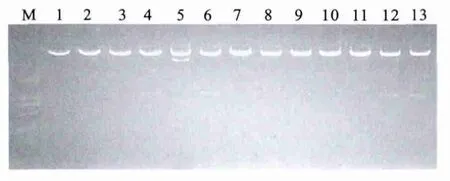
图3 pCS-CG-DsRed2-vigilin Kpn1酶切鉴定Figure 3 Identification of plasmid pCS-CG-DsRed2-vigilin by Kpn1
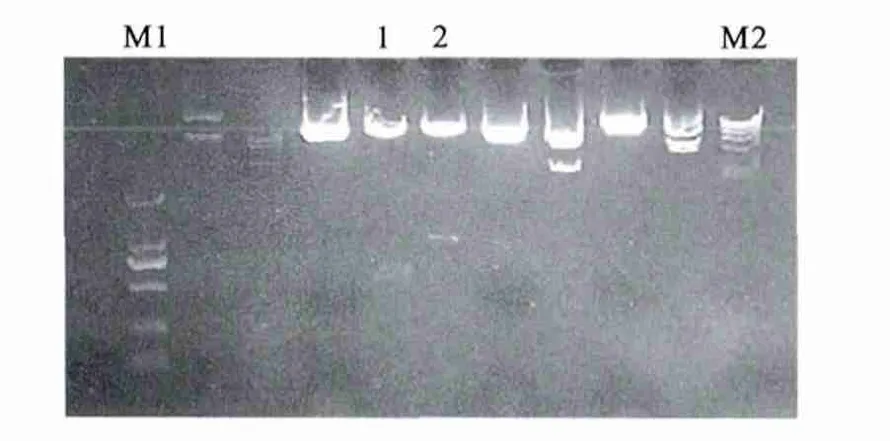
图4 pCS-CG-DsRed2-vigilin SacⅡ 酶切鉴定Figure 4 Identification of plasmid pCS-CG-DsRed2-vigilin by SacⅡ
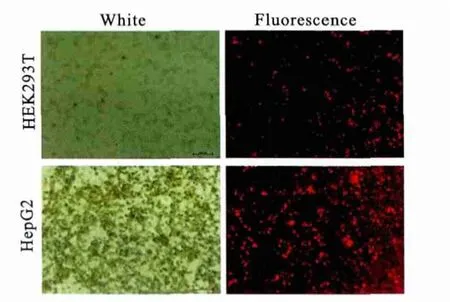
图5 重组慢病毒感染HEK293T和HepG2细胞48h后DsRed的表达(×100)Figure 5 DsRed expression in HEK293Tcells and HepG2cells after transducing recombinant lentivirus for 48h(×100)

图6 重组慢病毒感染HEK293T和HepG2细胞48h后DsRed的表达(×200)Figure 6 DsRed expression in HEK293Tcells and HepG2cells after transducing recombinant lentivirus for 48h(×200)
3 讨论
本研究中采用慢病毒包装体系载体pCS-CG和包装质粒pSPAX2,pMD2.G三质粒系统成功的包装出带红色报告基因的慢病毒,该包装系统中pCS-CG是带增强型绿色荧光蛋白(EGFP)的慢病毒载体骨架,含有包装、逆转录和整合所需的HIV顺式作用序列。同时具有异源启动子控制下的多克隆位点,pSPAX2能提供gag、pol蛋白,pMD2.G提供Env蛋白。这种分工形式大大降低了恢复成野生型病毒的可能,具有较大的生物安全性。目前实验研究常用的病毒载体主要有逆转录病毒载体、腺病毒载体、慢病毒载体等。其中逆转录病毒载体只能感染分裂期的细胞,且只能容纳较短(<8kb)的DNA片段。腺病毒载体虽可携带大片段DNA片段,但其转、感染效率较低,只能短暂表达目的蛋白。虽然慢病毒属于逆转录病毒的一种,但它能携带大片段的基因整合到宿主细胞的染色体上,且不易产生宿主免疫反应[8~12]。故本研究采用慢病毒载体来生产带有红色荧光的vigilin慢病毒。
我们的研究将DsRed2从pDsRed2-N1中用NheⅠ、NotⅠ双酶切切下,连入pcDNA3.1(-)上,再从pcDNA3.1(-)-DsRed2中用Kpn1单酶切切下DsRed2片段插入 pCS-CG-vigilin中,成功构建了pCS-CG-DsRed2-vigilin重组慢病毒载体。并将该重组慢病毒载体与慢病毒包装质粒一起共转染HEK293T细胞,包装出带红色报告基因的vigilin慢病毒。用该病毒分别感染HEK293T和HepG2细胞,均能观察到较强的红色荧光,说明包装出的慢病毒能高效的感染HEK293T和HepG2细胞。这个过程中我们构建了一个穿梭载体pcDNA3.1(-)-DsRed2,这种方法在没有合适酶切点的情况下避免了采用PCR来获取目的片段时可能发生的错配等情况,大大提高了构建的效率。
4 结论
Vigilin是一个多功能蛋白质,本研究构建了pCSCG-DsRed2-vigilin重组慢病毒载体,并成功地包装出相应的慢病毒,包装出的vigilin慢病毒为我们后续研究vigilin在细胞中的生物学形态奠定了基础。
[1]Birchler JA,Kavi HH,Fernandez HR.Heterochromatin:RNA points the way[J].Curr Biol,2004,14(18):R759–R761.
[2]Huertas D,Cortés A,Casanova J,et al.Drosophila DDP1,a multi-KH-domain protein,contributes to centromeric silencing and chromosome segregation[J].Curr Biol,2004,14(18):1611-1620.
[3]Cortés A,Huertas D,Fanti L,et al.DDP1,a single-stranded nucleic acid-binding protein of Drosophila,associates with peri-centric heterochromatin and is functionally homologous to the yeast Scp160p,which is involved in the control of cell ploidy[J].EMBO J,1999,18(13):3820-3833.
[4]Wang QQ,Zhang Z,Blackwell K,et al.Vigilins binds to promiscuously A-to-I-edited RNAs and are involved in the formation of heterochromatin[J].Curr Biol,2005;15(4): 3842391.
[5]Cunningham KS,Dodson RE,Nagel MA,et al.Vigilin binding selectively inhibits cleavage of the vitellogenin mRNA 3’-untranslated region by the mRNA endonuclease polysomalribonuclease 1[J].Proc Natl Acad Sci USA,2000,97(23):12498-12502.
[6]杨文理,武 静,谢晓砚,等.人vigilin基因全长编码区的分段克隆及鉴定[J].四川大学学报(医学版),2008,39(6):877-881.
[7]Follenzi A,Santambrogio L,Annoni A.Immune responses to lentiviral vectors[J].Curr Gene Ther,2007,7(5):306-315.
[8]Chumakov SP,Kravchenko JE,Prassolov VS,et al.Efficient down regulation of multiple mRNA targets with a single shRNA-expressing lentiviral vector[J].Plasmid,2010,63(3):143-149.
[9]Ramos OS,CarrataláYP,Puerta SG,et al.Dual promoter lentiviral vector generates transgenic mice expressing E2-CSFV glycoprotein in their milk,but impairs early identification of transgenic embryos [J].Theriogenology,2011,75(7):1280-1289.
[10]Keen JE,Hungerford LL,Littledike ET,et al.Effect of ewe ovine lentivirus infection on ewe and lamb productivity[J].Prev Vet Med,1997,30(2):155-169.
[11]周亚峰,李红霞,蔡思达,等.穿梭质粒pCDH1-GFP-HCN4的构建及HCN4重组慢病毒的包装[J].苏州大学学报(医学版),2012,32(3):354-358.
[12]王婷婷,王淑娟,严景华.hNoc4L基因重组慢病毒表达载体的构建与鉴定[J].生物工程学报,2010,26(11):1569-1575.
