姜黄素通过MAPK信号通路诱导人肝癌SMMC-7721细胞凋亡
2014-10-25李会宣张红兵
李会宣,杨 虹,张红兵,高 健
1河北经贸大学生物科学与工程学院,石家庄050061;2华北制药集团新药研究开发有限责任公司抗体药物研制国家重点实验室,石家庄 050015
姜黄素(Curcumin)是植物多酚类色素,广泛存在于姜黄属植物的根茎中,中药姜黄的重要活性成分之一。姜黄素的主要药理作用有抗氧化、抗炎、抗癌、降脂、抗动脉粥样硬化、抗纤维化、清除自由基等作用[1]。由于姜黄素无明显的毒副作用,其抗肿瘤作用日益引起人们的重视,已成为肿瘤预防和治疗的一个研究热点[2]。姜黄素对于肝癌的作用,目前的研究多集中于体外抗肿瘤效应[3],对其分子机制报道较少。本实验对姜黄素抑制人肝癌SMMC-7721细胞增殖并诱导凋亡作用及其可能的作用机制进行初步的研究。通过观察姜黄素对人肝癌SMMC-7721细胞增殖和凋亡的影响,检测姜黄素对SMMC-7721细胞中 Caspase-3、Survivin、Bcl-2 和 Bax基因表达的影响,揭示姜黄素诱导细胞凋亡的信号通路,以期为临床应用提供理论依据。
1 材料与方法
1.1 实验材料
肝癌细胞SMMC-7721(华北制药集团新药研究开发有限责任公司惠赠);姜黄素(国药集团化学试剂有限公司)以少量二甲基亚砜(DMSO)溶解配制成1 mmol/L储备溶液;RPMI-1640(Gibico公司);MTT、胎牛血清、DMSO、ERK特异性抑制剂PD98059、p38 MAPK特异性抑制剂 SB203580及JNK特异性抑制剂SP600125购自Sigma公司;Trizol试剂及RT-PCR反应体系购自Promega公司;Survivin、Bcl-2和Bax的PCR引物由上海生物工程有限责任公司合成;鼠抗人 Caspase 3、Survivin、Bcl-2、Bax、β-actin、p-JNK/JNK、p-ERK/ERK 和 p-p38/p38的单克隆抗体,HRP联连的兔抗鼠的二抗、化学发光试剂均为Santa Cruz公司产品。
1.2 仪器与设备
垂直电泳系统(美国Bio-Rad公司),流式细胞仪(BD FACSCalibur),Gel DOC2000凝胶成像系统(美国Bio-Rad公司),Microplate Reader 450酶标仪(美国Bio-Rad公司),5415D离心机(基因科技公司),半干转膜仪(美国Bio-Rad公司)和ID数码成像分析系统(美国Kodak公司)。
1.3 实验方法
1.3.1 MTT法测定姜黄素对SMCC-7721细胞增殖的影响
取对数生长期的SMCC-7721细胞,0.25%胰蛋白酶消化分离,重新混悬于含10%胎牛血清的RPMI-1640培养液,调整细胞数为5×104cell/mL,以每孔200 μL加入96孔培养板中于CO2培养箱中培养,贴壁24 h后分别加入终浓度为10、20、40和80 μmol/L的姜黄素,每组设5个复孔,并设阴性和空白对照组,分别培养 12、24、48、72 h,每孔分别加入5 mg/mL MTT溶液40μL,振荡后于37.0℃继续培养4 h,吸弃孔内上清培养液,于每孔内加入300 μL DMSO,使形成的甲月赞(ormazan)充分溶解,放入酶标仪,选择570 nm,空白孔调零,记录各孔吸光度OD值。
1.3.2 细胞计数法测定姜黄素对SMCC-7721细胞增殖的影响
将处于对数生长期的SMCC-7721细胞悬液以3×104~4×104cell/孔的密度接种于24孔板,培养12 h后,吸去培养液,随机分组(n=5),加入正常培养液(不加姜黄素的Control组)或终浓度为10、20、40和80 μmol/L的姜黄素的培养液,培养一定时间后,用血细胞计数板计数,以时间为横轴、细胞数为纵轴做量效曲线。
1.3.3 流式细胞仪(FCM)检测姜黄素诱导SMMC-7721细胞的凋亡
人肝癌SMMC-7721细胞常规培养至对数生长期,换无血清培养液培养12 h使细胞周期同步化,加入终浓度为40 μmol/L的姜黄素溶液培养,正常对照Control组加入等量培养基,再培养48 h后,制成单细胞悬液,离心弃上清,沿管壁缓慢加入700 mL/L预冷(-20℃)乙醇固定,上机检测前RNA酶消化,再加入PI染色液,4℃避光30 min,FCM检测凋亡率及细胞周期。
1.3.4 RT-PCR检测 Survivin、Bcl-2和 Bax的 mRNA的表达
取对数生长期SMMC-7721细胞,加入40 μmol/L的姜黄素作用不同后采用Trizol一步法提取总RNA,取 1 μL 总 RNA 以 10 μL 体系逆转录,制备cDNA并进行反转录PCR。使用引物如下:Survivin(GenBank:U75285.1)上游引物5'-CCACCGCATCTCTACATTC-3',下游引物 5'-CTTTC TTCGCAGTTTCCTC-3',产物长度 344 bp;Bcl-2(Gen-Bank:M13995.1)上游引物5'-ATGGCGCACGCTGGGAGAA-3',下 游 引 物 5'-CGGTAGCGGCGGGAGAAGTC-3',产物长度 326bp;Bax(GenBank:AY217036.1)上游引物5'-ACCAAGAAGCTGAGCGAGTGTC-3',下游引物 5'-CCC ACCCCTCCCAGAAAAAT-3',产物长度 480bp;β-actin(Gen-Bank:DQ407611.1)上游引物5'-AGTGTGACGTG-GACATCCGCA-3',下游引物5'-ATCCACATCTGCTGGAAGGTGGAC-3',产物长度220 bp。循环条件:预变性94℃ 5 min,变性94℃ 40 s,退火58℃ 40 s,延伸72℃ 50 s,循环30次,终延伸10 min。扩增产物用琼脂糖凝胶电泳检测,应用凝胶成像系统进行扫描。
1.3.5 Western blot检测 Bcl-2、Survivin、Bax 和Caspase-3蛋白的表达
1.3.5.1 细胞总蛋白提取
取对数生长期的 SMMC-7721细胞,加入40 μmol/L姜黄素处理一定时间后,收集细胞,PBS洗涤两次,加入细胞裂解液100 μL,4℃14000 rpm离心10 min,将上清按需分装,保存于-70℃,蛋白浓度以改良Lowry法进行蛋白定量。
1.3.5.2 Western blot检测
各组取等量蛋白提取液,经SDS-PAGE泳分离,电转移至PVDF膜上;取膜并用5% 脱脂奶粉封闭后,与鼠抗人 Bcl-2、Survivin、Bax或 Caspase 3的单克隆抗体(1∶300)于4℃反应过夜,洗膜后再与HRP标记的相应二抗(1∶10000)室温反应2 h,洗膜后利用增强性化学发光试剂盒(ECL)检测特异性蛋白条带,采用成像分析系统分析结果。
1.3.6 Western blot检测姜黄素对JNK、ERK和p38 MAPK信号通路的影响
Western blot检测JNK、ERK和p38 MAPK蛋白及磷酸化水平,一抗使用p-JNK/JNK、p-ERK/ERK和p-p38/p38 MAPK的单克隆抗体,方法同1.3.5。
1.3.7 统计学处理
所有数据用means±SD表示,采用SPSS13.0统计软件进行数据处理,两组以上数据间比较用方差分析,两组间比较用t检验,以P<0.05表示差异有统计学意义。
2 实验结果
2.1 姜黄素可抑制人肝癌细胞SMMC-7721的增殖
以10、20、40 和 80 μmol/L 四种浓度的姜黄素分别处理人肝癌SMMC-7721细胞不同时间,检测细胞增殖情况。结果如图1所示,MTT法检测结果表明(图 1A):与正常对照组相比,20、40 和 80 μmol/L的姜黄素明显抑制SMMC-7721的增殖,且随浓度的增大和时间的增加效果愈明显。利用细胞计数法得到了同样的结果,如图1B所示。为了防止药物的细胞毒性作用,后续试验姜黄素的浓度宜采用40 μmol/L,处理时间48 h。
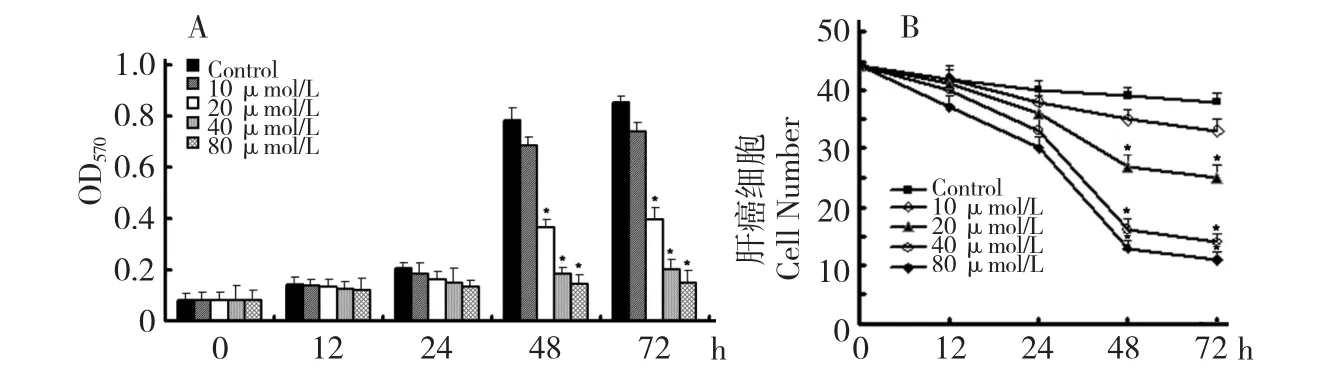
图1 姜黄素对人肝癌细胞SMMC-7721增殖的影响Fig.1 Effect of curcumin on proliferation of SMMC-7721 cells
2.2 姜黄素可诱导人肝癌细胞SMMC-7721凋亡
流式细胞术检测发现,40 μmol/L的姜黄素作用于人肝癌细胞48 h后,与正常对照组Control相比,在实相图上出现典型性细胞亚二倍体凋亡峰,细胞凋亡率为32.59%,明显高于对照组的凋亡率1.89%,结果见表1和图2。
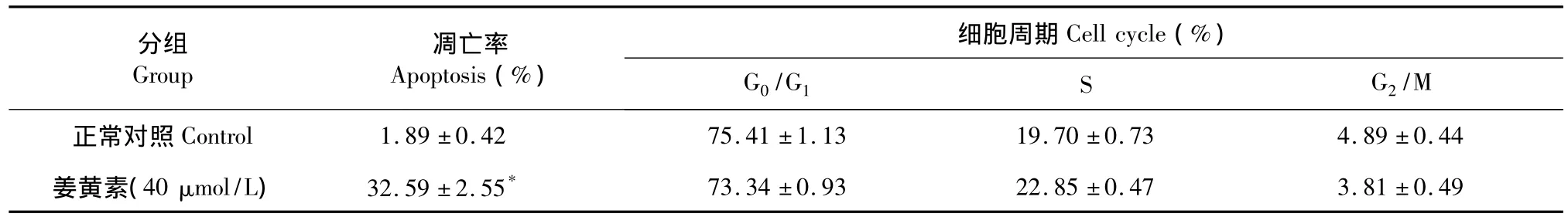
表1 姜黄素对SMMC-7721细胞凋亡的影响 (n=6,means±SD)Table 1 Effect of curcumin on apoptosis of SMMC-7721 cells(n=6,means±SD)
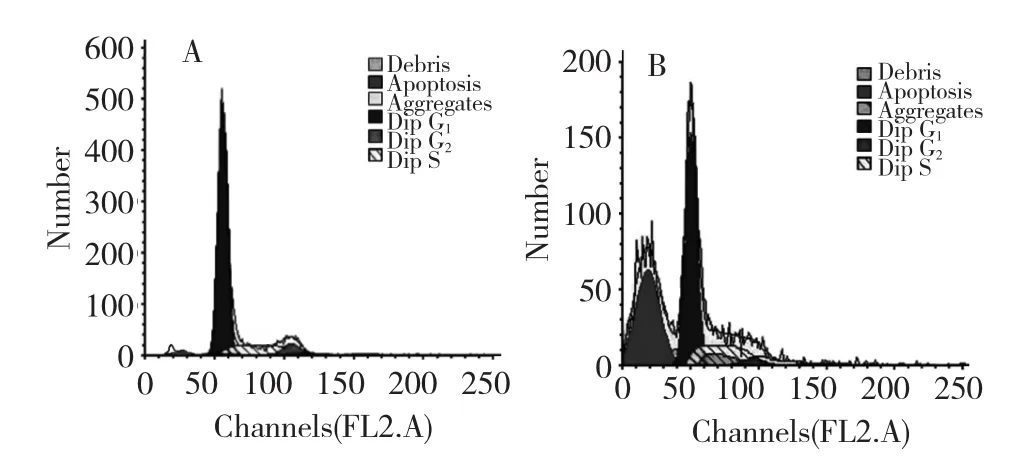
图2 姜黄素对人肝癌细胞SMMC-7721细胞凋亡的影响Fig.2 Effect of curcumin on apoptosis of SMMC-7721 cells
2.3 姜黄素可抑制人肝癌细胞SMMC-7721抗凋亡蛋白Bcl-2和Survivin的表达,诱导促凋亡蛋白Bax的表达
为了明确姜黄素诱导人肝癌SMMC-7721细胞凋亡的机制,用40 μmol/L的姜黄素分别处理细胞12 h、24 h、48 h、72 h 后提取总 RNA 和蛋白,检测SMMC-7721中凋亡相关蛋白基因的表达。RT-PCR检测结果显示随着姜黄素作用时间的延长SMMC-7721细胞的抗凋亡蛋白Bcl-2和Survivin的表达量逐渐减少;而促凋亡蛋白Bax的表达逐渐增加,如图3A所示,Western blot检测结果与RT-PCR一致,如图3B所示。表明,姜黄素诱导SMMC-7721细胞凋亡可能与上调Bax的表达、下调Bcl-2和Survivin的表达有关。

图3 姜黄素对人肝癌细胞SMMC-7721细胞中Bcl-2、Survivin和Bax表达的影响Fig.3 Effect of curcumin on expression of Bcl-2,Survivin and Bax in SMMC-7721cells
2.4 姜黄素可诱导人肝癌细胞SMMC-7721中Caspase-3活性增强
用40 μmol/L的姜黄素分别处理细胞12、24、48、72 h后,Western blot检测促凋亡蛋白Caspase 3的表达及活性的变化。随着姜黄素作用时间的延长,24 h后Caspase 3蛋白的表达量显著提高,而其剪切后的活化型Caspase 3(p17亚基)的表达量48 h后显著上升,结果见图4。提示,姜黄素诱导人肝癌SMMC-7721细胞凋亡可能与增强Caspase 3活性增强有关。
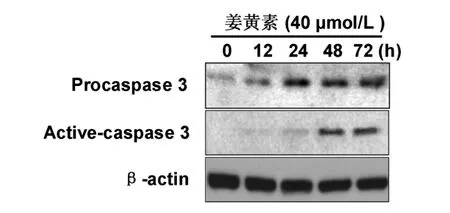
图4 姜黄素对人肝癌细胞SMMC-7721细胞中Caspase 3表达的影响Fig.4 Effect of curcumin on the expression of Caspase 3 in SMMC-7721cells
2.5 姜黄素激活人肝癌细胞SMMC-7721中JNK,抑制ERK和p38 MAPK信号通路
为了考察姜黄素诱导人肝癌细胞SMMC-7721凋亡的信号通路,用姜黄素处理培养的SMMC-7721细胞,观察 MAPK信号通路三个主要成员,即ERK1/2、JNK、p38 MAPK 的变化。用 Western blot的方法检测姜黄素处理后三个信号转导蛋白的磷酸化水平变化。结果显示,当40 μmol/L姜黄素作用于SMMC-7721细胞24 h后,JNK的磷酸化开始升高,48 h后明显升高。ERK和p38 MAPK的磷酸化水平48 h后降低明显,见图5。表明,姜黄素可以激活人肝癌细胞SMMC-7721中的JNK信号通路、抑制ERK和p38 MAPK信号通路。
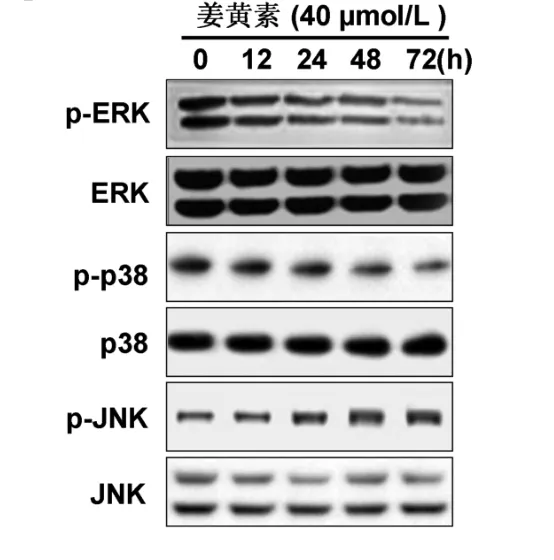
图5 姜黄素对人肝癌细胞SMMC-7721细胞中MAPK信号通路的影响Fig.5 Effect of curcumin on MAPK pathway activity in SMMC-7721cells
2.6 姜黄素通过JNK,ERK和p38 MAPK信号通路影响人肝癌细胞SMMC-7721中Bax、Caspase 3、Bcl-2和Survivin的表达
为了验证姜黄素激活SMMC-7721细胞中JNK、抑制ERK和p38 MAPK信号通路与上调Bax和Caspase 3的表达、下调Bcl-2和Survivin的表达有关,分别检测用JNK、ERK、p38 MAPK信号通路抑制剂SP600125、PD98059和SB203580对姜黄素处理SMMC-7721细胞后上述蛋白的表达。结果显示,加入抑制PD98059和SB203580后,进一步上调了Bax的表达、下调了Bcl-2和Survivin的表达(图6A、B),其中,两种抑制剂引起的不同效应是PD98059的加入并没有显著提升Caspase 3的活性。加入抑制剂SP600125后,下调了姜黄素诱导的Bax和Caspase 3的表达、上调了姜黄素抑制的Bcl-2和Survivin的表达(图6C)。结果提示,JNK、ERK和p38 MAPK均可介导姜黄素对人肝癌细胞SMMC-7721中Bax、Caspase 3、Bcl-2和Survivin的表达。

图6 MAPK抑制剂在姜黄素对人肝癌细胞SMMC-7721细胞中Bcl-2、Survivin、Bax和活性Caspase 3表达的影响Fig.6 Effect of MAPK inhibitor on the expression of Bcl-2,Survivin and Bax in SMMC-7721cells with curcumin
2.7 姜黄素通过JNK,ERK和p38 MAPK信号通路影响人肝癌细胞SMMC-7721凋亡
为了证明姜黄素激活JNK、抑制ERK和p38 MAPK信号通路与人肝癌SMMC-7721细胞凋亡有关,用信号通路抑制剂 SP600125、PD98059和SB203580处理细胞后流式细胞仪检测细胞的凋亡。如图7所示,阻断ERK和p38 MAPK信号通路后,与单纯姜黄素诱导条件下相比(图7B),细胞的凋亡率进一步上升(图7C、D)。阻断JNK信号通路后,细胞的凋亡率比单纯姜黄素诱导条件下有所下降(图7E)。柱形图显示各组的凋亡率。以上结果表明,JNK、ERK和p38 MAPK信号通路参与介导了姜黄素诱导的人肝癌SMMC-7721细胞的凋亡。
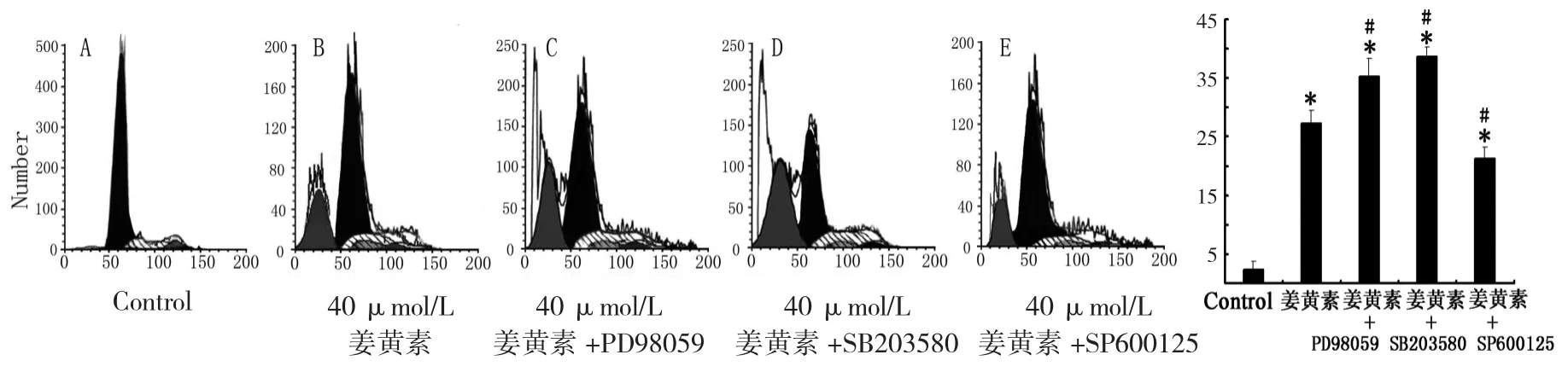
图7 MAPK抑制剂在姜黄素对人肝癌细胞SMMC-7721细胞凋亡的影响Fig.7 Effect of MAPK inhibitor on SMMC-7721 cells apoptosis with curcumin
3 讨论
姜黄素可以抑制多种癌细胞的增殖并诱导凋亡,其机制多与姜黄素多与增强Caspase的活性,干扰肿瘤细胞的细胞周期,调节凋亡相关蛋白的表达以诱导细胞凋亡有关。而姜黄素对于人肝癌细胞SMMC-7721的作用,以往的研究表明姜黄素可以抑制增殖并诱导凋亡,已发现机制为姜黄素作用于肝癌细胞后产生H2O2,H2O2损伤细胞线粒体并与膜电位降低有关,从而通过线粒体途径诱导细胞凋亡[4]。姜黄素诱导人肝癌SMMC-7721细胞凋亡还与调节表达的Bax/bcl-2蛋白比例有关[5]。最近研究表明MAPK的活化也是诸多抗癌药引起肿瘤细胞凋亡必需的,ERK MAPK由生长因子所活化,对细胞的增殖和存活起着关键作用,抑制ERK的活性可以下调细胞中c-myc的表达而促进细胞凋亡。目前普遍认为p38 MAPK可以通过增强c-myc、Bax、Fas、Caspase 3等蛋白的表达、磷酸化p53、参与Fas/FasL介导的凋亡、激活c-jun和c-fos、诱导Bax转位等途径导致细胞发生凋亡。而JNK MAPK促进凋亡的机制与增强Fas表达、调控Bcl-2的表达、改变细胞内Ca2+环境和激活Caspase家族有关。以上表明,ERK、p38和JNK三组MAPK家族与癌细胞的凋亡密切相关[6]。本研究考察姜黄素作用于人肝癌细胞SMMC-7721后MAPK信号通路在细胞凋亡中的作用。研究发现,姜黄素作用于人肝癌细胞SMMC-7721后,细胞的增殖受到抑制,细胞出现明显的凋亡,Bax、Caspase 3的表达明显增加而Bcl-2和Survivin的表达明显减少。研究中还发现,姜黄素可以激活人肝癌细胞SMMC-7721的JNK信号通路、抑制ERK和p38 MAPK信号通路,阻断这些信号通路后Bax、Caspase 3、Bcl-2和Survivin的表达发生变化。表明通过 MAPK信号通路上调 Bax、Caspase 3的表达和下调Survivin、Bcl-2的表达是姜黄素诱导肝癌细胞凋亡的重要机制之一。
本文的研究中发现,与以前的报道相似的是姜黄素的作用并没有明显改变人肝癌细胞SMMC-7721的细胞周期,也没有引起细胞周期阻滞作用[7]。至于姜黄素是具有作用于其他肿瘤细胞,能够增强肿瘤细胞周期蛋白依赖激酶(CDK)的表达并抑制p21、p27和 p53等的表达的功能[8],有待于进一步考察。
在不同类型的细胞凋亡过程中,Caspase-3是细胞色素C下游的靶标激活物,激活Caspase-3是线粒体-细胞色素C-细胞凋亡途径中的关键步骤[9]。本实验中还发现,JNK和p38 MAPK信号通路与Caspase-3的活化有关,而ERK信号通路的阻断没有引起Caspase 3活性的明显变化。推测可能是JNK和p38 MAPK信号通路与线粒体途径有着共同的通路最终导致凋亡的发生。本实验显示姜黄素可以通过MAPK信号通路发挥诱导肝癌细胞凋亡的作用,在治疗肝癌方面表现出良好的应用前景,这为姜黄素的临床应用提供了更多的理论依据。
1 Wang HS(王华森),Huai QY(怀其勇).Preparation and antimicrobial activities of curcumin derivatives.Nat Prod Res Dev(天然产物研究与开发),2013,25:237-240.
2 Chen LM(陈莉敏),Kang JJ(康建军),Liu Y(刘洋),et al.Synthesis and in vitro antioxidant activity of curcumin analogs.Nat Prod Res Dev(天然产物研究与开发),2011,23:722-725.
3 Phillips J,Sonavane K,Moore-Medlin T,et al.Curcumin inhibits UV radiation-induced skin cancer in vivo.Otolaryngol Head Neck Surg,2012,147:56-56.
4 Hu H(胡辉),Jing XB(荆绪斌),Cai XB(蔡先彬),et al.Curcumin induced apoptosis of hepatocellular carcinoma by oxidative damaged mitochondria.Chongqing Med(重庆医学),2012,41:269-270.
5 Yu J,Zhou X,He X,et al.Curcumin induces apoptosis involving bax/bcl-2 in human hepatoma SMMC-7721 cells.Asian Pac J Cancer Prev,2011,12:1925-1929.
6 Wang WZ,Li L,Liu MY,et al.Curcumin induces FasL-related apoptosis through p38 activation in human hepatocellular carcinoma Huh7 cells.Life Sci,2013,92:352-358.
7 Zhao YH(赵毅辉),Li DJ(李德俊),Wang SJ(王顺金).Effects of curcumin on proliferation,cell cycle statusand apoptosis ofhumanhepatocellularcarcinomaSMMC-7721 cells.Exp Lab Med(实验与检验医学),2010,28:130-133.
8 Mukhopadhyay A,Banerjee S,Stafford LJ,et al.Curcumininduced suppression of cell proliferation correlates with down-regulation of cyclin D1 expression and CDK4-mediated retinoblastoma protein phosphorylation.Oncogene,2002,21:8852-8861.
9 Lin TK,Cheng CH,Chen SD,et al.Mitochondrial dysfunction and oxidative stress promote apoptotic cell death in the striatum via cytochrome c/caspase-3 signaling cascade following chronic rotenone intoxication in rats.Int J Mol Sci,2012,13:8722-8739.
