Roux-en-Y胃转流术对超重2型糖尿病患者的疗效以及心血管风险的影响
2014-10-23曾莎莎黄骥佘强廖涌郭渝明
曾莎莎,黄骥,佘强,廖涌,郭渝明
目前糖尿病正在全球范围内蔓延,患病人数逐年递增,已经严重威胁人类健康。传统糖尿病治疗方法主要包括控制饮食、增加运动、生活方式干预、口服降糖药物及注射胰岛素等,在上述方法无法满意控制血糖的前提下,代谢手术成为了一个新选择[1]。代谢手术分为容量限制型、吸收不良型和混合型,Roux-en-Y胃转流术(Roux-en-Y Gastric Bypass,RYGB)属于混合型,是目前运用最为广泛的代谢手术术式。与吸收不良型手术相比,两者减肥程度相当[2],而RYGB不会引起严重的吸收不良[3];与限制型手术相比,RYGB可以引起高达50%的额外体重减少率(excess weight loss ,EWL)[4],优于单纯的容量限制型手术[2]。因此从20世纪90年代至今,该术式一直为肥胖外科及糖尿病外科的医生所青睐。并且我国的专家也推荐RYGB作为代谢手术的首选术式[5]。在国内外针对RYGB治疗肥胖合并2型糖尿病的一些研究中,其效果已获得肯定。而针对正常体重或超重的2型糖尿病患者进行的研究并不多。
本研究主要利用武警重庆总队医院相关患者的资料,按照我国成人超重及肥胖分级标准,将超重的人群,即体重指数(BMI)介于24~27.9 kg/m2的2型糖尿病患者纳入研究范畴,以评估RYGB对于我国超重而非肥胖的2型糖尿病患者的疗效及对患者相关心血管风险的影响。
1 资料与方法
1.1研究对象连续入选2011年3月至2012年3月期间于武警重庆总队医院行RYGB的超重的2型糖尿病患者,共57例。其中男性34例,女性23例;年龄32~59岁,平均年龄(48±7.6)岁。BMI(24~27.9)kg/m2,平均(25.81±1.34)kg/m2;术前已确诊糖尿病病史1~10年,平均4.07年。其中有30例患者同时合并原发性高血压(包括既往诊断及本次入院初诊的病例),均符合2005年《中国高血压防治指南》和1999年WHO/ISH指南中的高血压诊断标准,即收缩压≥140 mmHg和(或)舒张压≥90 mmHg(1 mmHg=0.133 kPa),并排除继发性高血压可能。根据是否合并高血压分为高血压组和正常组。30例高血压患者再根据具体血压值分为1级、2级和3级高血压组[收缩压140~159 mmHg和(或)舒张压90~99 mmHg为1级高血压;收缩压160~179 mmHg和(或)舒张压100~109 mmHg为2级高血压;收缩压≥180 mmHg和(或)舒张压≥110 mmHg为3级高血压]。所有患者均无手术禁忌证,经非手术治疗效果不佳或不能耐受,自愿接受RYGB,手术前均经武警重庆总队医院糖尿病外科和内分泌科联合会诊并签署知情同意书。纳入标准:①符合1999年WHO 的2型糖尿病诊断标准,即空腹血糖(FPG)≥7.0 mmol/L和(或)餐后2小时血糖(2hPG)≥11.1 mmol/ L;②BMI 24~27.9 kg/m2;③年龄18~60岁;④糖尿病病程不超过10年;⑤C肽水平≥0.3 mg/L。排除标准:血清中的谷氨酸脱羧酶抗体(GAD-Ab)、胰岛细胞抗体(ICA)和胰岛素自身抗体(IAA)阳性的自身免疫性糖尿病患者。
1.2观察指标
1.2.1相关指标检测分别于术前及术后6个月记录患者身高、体重,BMI,BMI=体重(kg)/身高(m)2。采清晨空腹静脉血测定糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A1(ApoA1)和载脂蛋白B(ApoB)水平,并计算ApoA1/ApoB的比值。使用BioRadVariantⅡ糖化血红蛋白仪(美国)检测全血HbAlc含量。使用日立7180型全自动生化分析仪测定血清中TG、TC、HDL-C、LDL-C、ApoA1和ApoB含量,测定试剂由四川迈克生物科技股份有限公司提供。行口服葡萄糖耐量试验(OGTT),所有患者禁食8~10 h,于清晨空腹抽取静脉血,之后进食75g葡萄糖,分别在进食后30 min、60 min、120 min、180 min抽取静脉血,使用日立7180型全自动生化分析(日本)仪检测静脉血浆葡萄糖,试剂由四川迈克生物科技股份有限公司提供,并记录FPG与2 hPG结果。
1.2.2整体疗效评定根据我国专家指导意见推荐的疗效判定标准:①临床完全缓解:无论术前采用何种方式治疗糖尿病,术后不再需要内科干预措施,可以长期将血糖保持在正常水平(随机血糖<11.1 mmol/L、FPG<7.0 mmol/L、OGTT试验2hPG<11.1mmol/L、HbA1c<6.5%);②临床部分缓解:术前需要使用胰岛素才能控制血糖,而术后仅口服降糖药物即可将血糖控制至正常水平;或术前需要口服降糖药物才能控制血糖,而术后降糖药物减量亦可将血糖控制至上述水平;③无效:患者术后的药物治疗方案、血糖、HbA1c与术前相比无明显变化[5]。
1.2.3心血管风险评估根据患者的年龄和血压、BMI、血脂的测定值,以及是否合并吸烟、糖尿病,分别使用中国缺血性心血管疾病(ICVD)危险评估模型和Framingham危险评估模型计算未来10年心血管风险。
1.3统计学分析使用SPSS 11. 0软件进行统计分析,计量资料采用(s)表示,术前与术后资料比较采用配对t检验,P<0.05,为差异有统计学意义。
2 结果
2.1 RYGB手术情况所有患者均开腹行RYGB手术,开腹后适当游离胃大、小弯,距贲门约4~5 cm处用一次性直线闭合器将胃横向闭合,残胃容量约150~400 ml;于Treitz韧带以下相应距离切断空肠,将远端空肠与近侧胃行侧侧吻合,近端空肠与回肠行侧侧吻合。手术时间70~120 min,术中出血100~300 ml。
2.2 RYGB术前、后血糖和糖化血红蛋白水平比较术后6个月,患者FPG从(8.27±2.46)mmol/L降至(6.92±1.26)mmol/L,2hPG从(17.71±3.48)mmol/L降至(11.09±2.07)mmol/L,HbA1c从(9.09±2.62)%降至(6.71±0.95)%,较术前明显下降(P<0.01)(表1)。按照我国专家指导意见推荐的疗效判定标准,术后有39例患者达到临床完全缓解标准,治愈率68.42%;有17例患者达到临床部分缓解标准,有1例患者无效,总体有效率为98.25%。
2.3 RYGB术前、后血脂及脂蛋白变化情况术后6个月,患者TG、TC和LDL-C水平与手术前比较明显下降,差异有统计学意义(P<0.05)。HDL-C、ApoA1/ApoB术前、术后变化无统计学差异(P>0.05)(表1)。
2.4 RYGB术前、后BMI及血压的变化情况患者术前平均BMI为(25.81±1.34)kg/m2,术后6个月平均BMI为(23.07±2.03)kg/m2,术后BMI明显下降,差异有统计学意义(P<0.01,表2)。术后6个月,患者收缩压、舒张压较术前均明显下降,差异有统计学意义(P均<0.01,表1)。
高血压组患者RYGB术后的收缩压、舒张压与术前相比明显下降,差异有统计学意义(P<0.01);血压正常组患者术前、术后的收缩压及舒张压变化无统计学差异(P>0.05)。(表2)。术后6个月,30例高血压患者中有19例患者血压降至140/90 mmHg以下,治愈率达到63.33%,部分患者在住院期间血压即恢复正常;有7例患者术后降压药减量亦可将血压控制至正常水平,有4例患者降压药服用量与术前相比无明显变化。
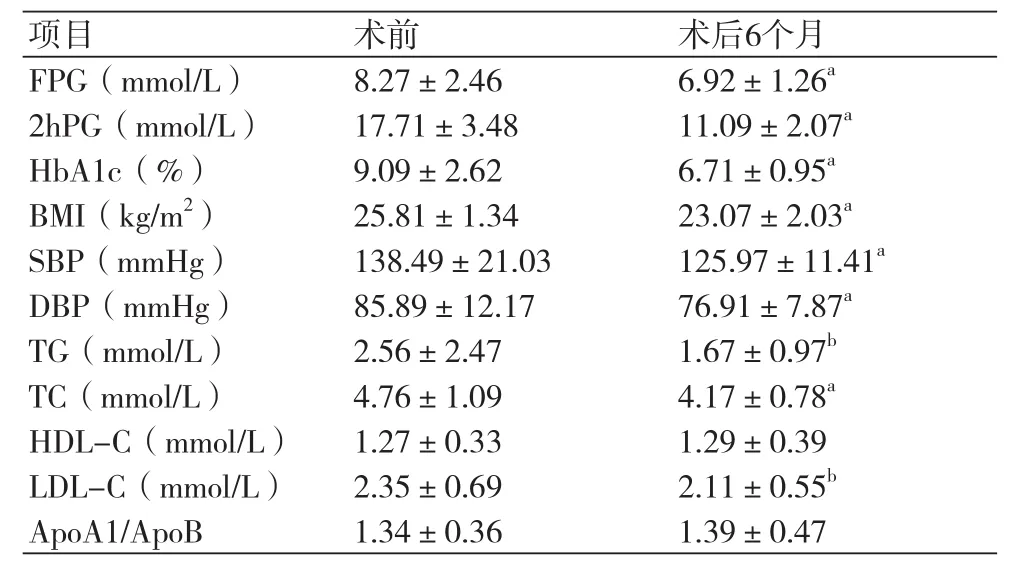
表1 手术前后血糖、血压、血脂水平比较(n=57)

表2 手术前后高血压组与正常血压组患者血压变化(mmHg)
不同分级的高血压患者RYGB术后收缩压、舒张压较术前均明显下降,差异有显著统计学意义(P<0.01)。其中3级高血压患者术后血压下降幅度最大,术后收缩压平均下降44.66 mmHg,舒张压平均下降22.66 mmHg(表3)。
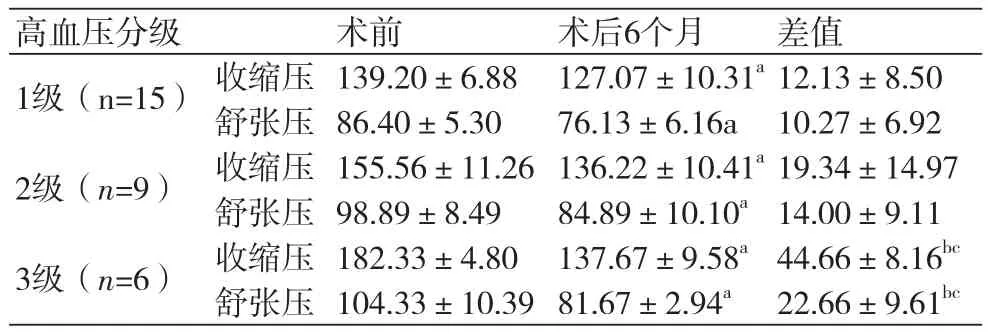
表3 不同级别高血压患者手术前后血压变化(mmHg)
2.5 RYGB术后6月时心血管风险评估无论是我国的ICVD危险评估模型还是国外的Framingham危险评估模型,患者术后6个月时评估未来10年心血管风险较术前明显下降(表4)。
2.6 RYGB术后并发症57例患者中,术后有9例出现胃排空障碍,有2例出现吻合口溃疡,有2例出现切口脂肪液化,经治疗后均好转。无死亡病例及其他严重并发症出现,随访期间无严重心血管事件发生。
3 讨论
目前代谢手术的研究对象多为肥胖患者,但是亚洲人肥胖发生率较低,有研究发现,高加索人中糖尿病患者的平均BMI多超过30 kg/m2,而我国2型糖尿病患者的平均BMI约在25 kg/m2左右[6],在相同的BMI水平,亚洲人与高加索人相比,其脂肪含量(尤其是内脏脂肪)更高,更易罹患心血管疾病和糖尿病[7]。因此,照搬国外的经验并不完全适合我国的实际情况。对于BMI≥28 kg/m2的2型糖尿病患者行代谢手术,相关专家分别做出了推荐[8,9]。但针对BMI<28 kg/m2的患者行RYGB尚无明确指南推荐。因此,本研究将超重而非肥胖的人群(即BMI 24~27.9 kg/m2)纳入研究范畴,评估Roux-en-Y胃转流术(RYGB)对其疗效及对心血管风险的影响。结果表明,我国超重的2型糖尿病患者行RYGB同样是安全、有效的,术后6个月68.42%的患者糖尿病完全缓解,98.25%的患者糖尿病得到改善,血压、TG、TC、LDL-C水平较术前明显下降。其中术前合并原发性高血压的30例患者中,63.33%的患者术后血压降至正常,86.67%的患者高血压得到改善,并且高血压3级患者的术后血压下降幅度较高血压1、2级患者更加明显。
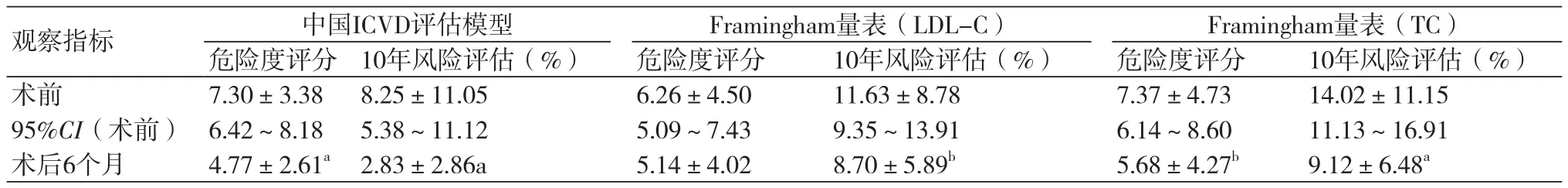
表4 手术前后10年心血管风险评估情况(n=57)
一项荟萃分析显示,肥胖的2型糖尿病患者RYGB术后平均体重减轻38.5 kg,EWL减少55.9%[10]。如果超重患者体重下降程度也与其相同,则可能出现严重营养不良。在台北地区进行的研究发现[11],不同BMI的2型糖尿病患者胃转流术后其BMI下降幅度不同,术前BMI越高,则术后BMI下降程度越大;反之亦然。本研究中患者术后平均体重减轻5.47 kg,术后最低BMI为18.4 kg/m2,无严重营养不良病例出现。
RYGB改善血糖、血压、血脂的机制尚不明确,手术引起患者胃容量缩小、肠道吸收不良,以及术后体重下降发挥了一定作用,而RYGB术后相关激素水平的改变,如胃促生长素、胰高血糖样肽-1(GLP-1)、抑胃肽(GIP)、酪酪肽(PYY)等发挥更为重要的作用[12-20]。目前RYGB的开展以腹腔镜手术为主,而本研究属于回顾性研究,纳入的所有病例均采用的开腹RYGB,但有研究显示这两种方法的糖尿病缓解率并无明显差异[21]。
糖尿病与心血管疾病密切相关,与正常人比较,糖尿病患者心血管疾病风险增加2~5倍,未来10年发生心肌梗死危险高达20%[22]。大量文献报道,RYGB可用以治疗2型糖尿病,安全且效果显著,并能有效改善高血压、高血脂等合并症,降低全因死亡率[23-26]。目前用以评估心血管风险的工具很多,Framingham危险评估模型在全球范围内应用最广泛,但该模型存在高估我国人群心血管风险的可能[27];中国ICVD危险评估模型由国家“十五”攻关“冠心病、卒中综合危险度评估及干预方案的研究”课题组共同建立,是适合我国人群的缺血性心血管发病危险的评估方法和简易评估工具[28]。本研究分别选用中国ICVD危险评估模型和Framingham危险评估模型对入选患者术前、术后心血管风险进行评估。研究发现,随着患者术后血糖、血压、血脂的改善,未来10年心血管疾病风险明显下降。
综上所述,对于超重的2型糖尿病患者,RYGB可以有效改善血糖、血压、血脂,并能降低未来10年心血管风险,且未发现严重并发症。由于本研究是回顾性研究,能提供的数据有限,有待更进一步的研究以提供更全面的报道。
[1]Rubino F,Schauer PR,Kaplan LM,et al. Metabolic surgery to treat type 2 diabetes: clinical outcomes and mechanisms of action[J]. Annu Rev Med,2010,61:393-411.
[2]Buchwald H,Avidor Y,Braunwald E,et al. Bariatric surgery: a systematic review and meta-analysis[J]. JAMA,2004,292(14):1724-37.
[3]MacLean LD,Rhode BM,Nohr CW. Long- or short-limb gastric bypass[J]? J Gastrointest Surg,2001,5(5):525-30.
[4]Ochner CN,Gibson C,Shanik M,et al. Changes in neurohormonal gut peptides following bariatric surgery[J]. Int J Obes,2011,35(2):153-66.
[5]中华医学会外科学分会内分泌外科学组,中华医学会外科学分会胃肠外科学组,中国医学会外科学分会外科手术学学组,等. 中国糖尿病外科治疗专家指导意见(2010)[J]. 中国实用外科杂志,2011,31(1):54-8.
[6]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2010)[J]. 中国糖尿病杂志,2012,20(1):1-36.
[7]Wen CP,David Cheng TY,Tsai SP,et al. Are Asians at greater mortality risks for being overweight than Caucasians? Redefining obesity for Asians[J]. Public Health Nutr,2009,12(4):497-506.
[8]中华医学会糖尿病学分会,中华医学会外科学分会. 手术治疗糖尿病专家共识[J]. 中国实用外科杂志,2011,31(5):367-70.
[9]Rubino F,Kaplan LM,Schauer PR,et al. The Diabetes Surgery Summit consensus conference: recommendations for the evaluation and use of gastrointestinal surgery to treat type 2 diabetes mellitus[J]. Ann Surg,2010,25l(3):399-405.
[10]Buchwald H,Estok R,Fahrbach K,et al. Weight and type 2 diabetes after bariatric surgery:systematic review and meta-analysis[J]. Am J Med,2009,122(3):248-56.
[11]Lee WJ,Wang W,Lee YC,et al. Effect of Laparoscopic Mini-Gastric Bypass for Type 2 Diabetes Mellitus: Comparison of BMI>35 and <35 kg/m2[J]. J Gastrointest Surg,2008,12(5):945-52.
[12]Korner J,Inabnet W,Febres G,et al. Prospective study of gut hormone and metabolic changes after adjustable gastric banding and Rouxen-Y gastric bypass[J]. Int J Obes (Lond),2009,33(7):786-95.
[13]Ybarra J,Bobbioni-Harsch E,Chassot G,et al. Persistent correlation of ghrelin plasma levels with body mass index both in stable weight conditions and during gastric-bypass-induced weight loss[J]. Obes Surg,2009,19(3):327-31.
[14]Korner J,Inabnet W,Febres G,et al. Prospective study of gut hormone and metabolic changes after adjustable gastric banding and Rouxen-Y gastric bypass[J]. Int J Obes (Lond), 2009,33(7):786-95.
[15]Bose M,Machineni S,Olivan B,et al. Superior appetite hormone profile after equivalent weight loss by gastric bypass compared to gastric banding[J]. Obesity (Sliver Spring), 2010,18(6):1085-91.
[16]Laferrere B,Teixeira J,McGinty J,et al. Effect of weight loss by gastric bypass surgery versus hypocaloric diet on glucose and incretin levels in patients with type 2 diabetes[J]. J Clin Endocrinol Metab,2008,93(7):2479-85.
[17]Morinigo R,Moizé V,Musri M,et al. Glucagon-like peptide-1, peptide YY, hunger, and satiety after gastric bypass surgery in morbidly obese subjects[J]. J Clin Endocrinol Metab,2006,91(5):1735-40.
[18]Salinari S,Bertuzzi A,Guidone C,et al. Insulin sensitivity and secretion changes after gastric bypass in normotolerant and diabetic obese subjects[J]. Ann Surg.,2013,257(3):462-8.
[19]Jørgensen NB,Jacobsen SH,Dirksen C,et al. Acute and long-term effects of Roux-en-Y gastric bypass on glucose metabolism in subjects with Type 2 diabetes and normal glucose tolerance[J]. Am J Physiol Endocrinol Metab,2012,303(1):E122-31.
[20]le Roux CW,Welbourn R,Werling M,et al. Gut hormones as mediators of appetite and weight loss after Roux-en-Y gastric bypass[J]. Ann Surg,2007,246(5):780-5.
[21]Arterburn DE,Bogart A,Sherwood NE,et al. A multisite study of longterm remission and relapse of type 2 diabetes mellitus following gastric bypass[J]. Obes Surg,2013,23(1):93-102.
[22]杨长卫,马鹏飞,张建祥. 二甲双胍对2型糖尿病大血管病变的防治研究进展[J]. 临床误诊误治,2014,27(1):107-11
[23]Buchwald H,Avidor Y,Braunwald E,et al. Bariatric surgery: a systematic review and metaanalysis[J]. JAMA,2004,292(14):1724-37.
[24]Sjöström L,Lindroos AK,Peltonen M,et al. Lifestyle, diabetes, and cardiovascular risk factors 10 years after bariatric surgery[J]. N Engl J Med,2004,351(26):2683-93.
[25]Sjöström L,Narbro K,Sjostrom CD,et al. Effects of bariatric surgery on mortality in Swedish obese subjects[J]. N Engl J Med,2007,357(8):741-52.
[26]Adams TD,Gress RE,Smith SC,et al. Long-term mortality after gastric bypass surgery[J]. N Engl JMed,2007,357(8):753-61.
[27]刘静,赵冬,王薇,等. 中国多省市心血管病危险因素队列研究与美国弗莱明翰心脏研究结果的比较[J]. 中华心血管病杂志,2004,32(2):167-72.
[28]国家“十五”攻关“冠心病、脑卒中综合危险度评估及干预方案的研究”课题组. 国人缺血性心血管病发病危险的评估方法及简易评估工具的开发研究[J]. 中华心血管病杂志,2003,31(12):893-901.
