核磁共振法分析酚氨咖敏药片中各组分含量
2014-10-20唐钢锋包慧敏朱万森
唐钢锋, 包慧敏, 赵 滨, 朱万森, 雷 杰
(复旦大学化学系,上海 200433)
0 引言
核磁共振(Nuclear Magnetic Resonance,NMR)波谱法用于有机化合物的结构解析已被人们所熟知[1]。在NMR技术的发展初期,主要用于小分子样品的定性分析,灵敏度低等问题限制其在定量分析方面的应用。近年来,由于仪器设备的快速发展,NMR定量的灵敏度和精确度等已经接近高效液相色谱等方法,成为一种日益成熟的仪器分析方法[2-6]。NMR定量的优点:测定过程中样品不受破坏;产生信号的核的数目与信号强度成正比,与核的化学性质无关;核磁信号峰的宽度远小于各信号之间的化学位移的差值,因而混合物中不同成分的信号间很少发生重叠,对于混合物或者复方制剂,一般无需分离即可测定;无需被测化合物的纯品作为对照标准,可以利用内标法来定量等。
在仪器分析实验教学和相关教材中,核磁实验主要是用于定性分析[7-9],或者是用于研究乙酰丙酮和乙酰乙酸乙酯等的互变异构现象,并确定两者的相对含量[10-13],至今还没有采用NMR对实际样品进行定量分析的教学实验。因此,引入NMR定量分析对仪器分析实验教学具有重要的现实意义。
在本实验中,首先分别测定氨基比林、对乙酰氨基酚和咖啡因纯品的1H-NMR图谱,学习结构解析;然后配制酚氨咖敏药片的模拟样,用1H-NMR测定方法的回收率;最后用市售酚氨咖敏药片作为未知样,同时测定其中氨基比林、对乙酰氨基酚和咖啡因3种主要成分的含量。
1 实验目的及内容
掌握核磁共振波谱法进行定性、定量分析的原理及基本方法,掌握核磁共振波谱仪的工作原理及基本操作。
原子核具有磁矩,当置于磁场中,则与磁场相互作用产生核自旋能量分裂,形成不同的核自旋能级。在射频辐射的作用下,可使特定结构环境中的原子核实现共振跃迁。将共振跃迁时吸收信号的频率和强度记录下来就得到核磁共振波谱图。
核磁共振波谱图上的吸收峰频率,即化学位移δ,是NMR谱图的重要参数之一。
对于1H谱图来说,由于氢原子核外面有电子云,对其周围的电子起了屏蔽效应。核周围的电子云密度越大,屏蔽效应就越大。核周围的电子云密度是受所连基团的影响,故不同化学环境的核,它们所受的屏蔽作用各不相同,它们的核磁共振信号亦就出现在不同的地方。这种由于化学环境不同而导致的位移就称为化学位移。由于屏蔽作用所造成的核感应磁场强度的变化量很小,难以精确地测出其绝对值,因而引入一个参考标准来对比,常用的标准物质是四甲基硅烷,它只有1个峰,屏蔽作用很强,一般质子的吸收峰都出现在它的左边,即低场方向。其他峰与四甲基硅烷之间的距离就是他们的化学位移值,用“δ”表示。
由于分子中各种基团都具有各自特定的化学位移,因此利用δ的大小可以判定谱峰所属的基团,又因为1H-NMR谱峰的面积是与样品各组分含氢核数目成正比,因此各谱峰面积之比就是氢的物质的量之比,因此即可进行定量分析。
酚氨咖敏片是用于医治感冒、发热、头痛、神经痛及风湿痛等的常见药品,其主要成分有以下三种:
(1)氨基比林(aminopyrine)。白色或几乎白色结晶性粉末;无臭,味微苦;遇光可变质;水溶液显碱性。本品在乙醇或氯仿中易溶,在水或乙醚中溶解。相对分子质量为231.30。

(2)对乙酰氨基酚(paracetamol)。白色结晶性粉末,无臭,味微苦;易溶于热水或乙醇,溶于丙酮,微溶于水。临床上有解热镇痛作用,用于感冒发烧、关节痛、神经痛、偏头痛、癌痛及手术后止痛等。相对分子质量为 151.16。
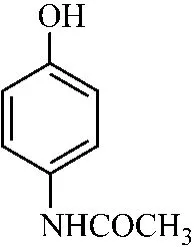
(3)咖啡因(caffeine)。咖啡因是从茶叶、咖啡果中提炼出来的一种生物碱,白色针状结晶,无臭、味苦;在热水或氯仿中易溶,略溶于水、乙醇、丙酮,微溶于石油醚。适度地使用有祛除疲劳、兴奋神经的作用,临床上用于治疗神经衰弱和昏迷复苏。相对分子质量为194.19。

3种组分在核磁共振谱中其特征峰(见表1)。

表1 3种组分在核磁共振谱中的化学位移及特征峰
内标法为NMR定量分析中常用的方法之一。在样品溶液中直接加入一定量内标物质后,进行NMR光谱测定,将样品指定基团上质子引起的吸收峰面积与由内标物质指定基团上的质子引起的吸收峰面积进行比较,即可算得样品的含量,样品中各组分的质量比分别等于其物质的量比。
本实验选取3-三甲基硅烷-1-丙磺酸钠作为内标物质,用核磁共振内标法测定酚氨咖敏片中各组分的含量。称取一定量药品(WS)与内标(WR)一同测量,其中氨基比林(12H)、对乙酰氨基酚(3H)和咖啡因(9H)的含量计算式如下:
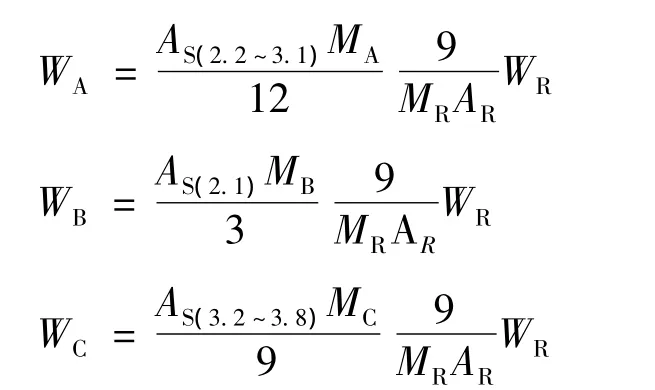
其中:MA、MB、MC、MR分别为氨基比林、对乙酰氨基酚、咖啡因和内标物的相对分子质量;AS为样品峰面积;AR为内标物峰面积。
2 仪器和试剂
仪器:核磁共振仪,电子天平(感量为0.1 mg),离心机(≥4 000 r/min),移液枪(0.5 mL、1 mL),容量瓶(10 mL)。
试剂:氨基比林,对乙酰基氨基酚,咖啡因,3-三甲基硅烷-1-丙磺酸钠,重水。
3 实验步骤
(1)样品溶液的配制及测定。用重水配制氨基比林、对乙酰基氨基酚、咖啡因的标准溶液,分别测定其1H NMR谱。
(2)混合标准样品的配制。准确称取氨基比林100.0 mg,对乙酰基氨基酚 100.0 mg,咖啡因 25.0 mg,内标(3-三甲基硅烷-1-丙磺酸钠)50.0 mg于 10 mL容量瓶内,用重水定容,振荡溶解后备用。
(3)方法回收率的测定。取上述混合标准样品溶液0.5 mL于NMR样品管中,预热数分钟后,按照仪器使用步骤进行测定。
(4)样品预处理及测定。取一片酚氨咖敏药片准确称重,在研钵中将药片研成细粉状。
准确称取研细的药片40.0 mg(WS)左右,置于5 mL离心管,加入重水0.5 mL,加入3-三甲基硅烷-1-丙磺酸钠重水溶液(20.0 mg/mL)0.2 mL。振荡摇匀,40℃水浴加热5 min,离心分离。取其上层清液于NMR样品管内,测定其1H-NMR谱(见图1)。
4 数据处理
(1)标出3个化合物的1H-NMR谱中主要峰的化学位移,进行结构解析并归属。
(2)对混合标准溶液和酚氨咖敏片谱图中的内标峰及样品 δ2.2 ~3.1、δ2.1、δ3.2 ~3.8 的共振峰进行积分,记录峰面积,计算方法回收率及酚氨咖敏片各组分的含量。
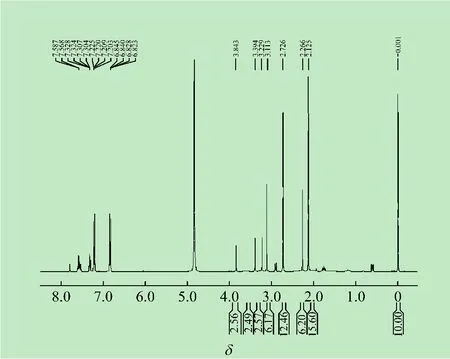
图1 酚氨咖敏药片的1H-NMR谱
5 结语
本实验为多组分实际样品的分析,不仅利用化学位移进行定性分析,而且利用峰面积进行了定量分析,涵盖了核磁共振波谱法的主要知识点[14-15]。实验开设以来,深受学生欢迎。开设初期,采用的溶剂是氘代氯仿,内标物为六甲基二硅氧烷,由于对乙酰氨基酚在氘代氯仿中的溶解度不好,导致其定量结果不理想,因此我们重点测定氨基比林和咖啡因两者的含量。在后来的实验教学中,陆续尝试了不同的溶剂,最后选择用重水做溶剂,3-三甲基硅烷-1-丙磺酸钠做内标,可以同时准确测定氨基比林、对乙酰氨基酚和咖啡因三者的含量。
[1] 范康年.谱学导论[M].2版.北京:高等教育出版社,2011:112-187.
[2] 孝延文,关剑秋,吕景英.碳-13核磁共振定量测定葡萄糖及果糖的含量[J].分析化学,1992,20(3):255-258.XIAO Yan-wen,GUAN Jian-qiu,L Jing-ying.Determination of glucose and fructose by carbon-13 nuclear magnetic resonance[J].Chinese Journal of Analytical Chemistry,1992,20(3):255-258.
[3] 于小波,沈文斌,相秉任.定量核磁共振技术及其在药学领域中的应用进展[J].药学进展,2010,34(1):17-23.YU Xiao-bo,SHEN Wen-bin, XIANG Bing-ren. Advances in application of quantitative nuclear magnetic resonance technique in pharmaceutical filed[J].Progress in Pharmaceutical Sciences,2010,34(1):17-23.
[4] 张 烨,刘小鹏,张友杰.水溶性维生素核磁共振定量分析的研究[J].波谱学杂志,2011,28(3):357-365.ZHANG ye,LIU Xiao-peng,ZHANG You-jie.Studies of NMR quantitative analysis for water-soluble vitamins[J].Chinese Journal of Magnetic Resonance,2011,28(3):357-365.
[5] Maniara G,Rajamoorthi K,Rajan S,et al.Method Performance and Validation for Quantitative Analysis by 1H and 31P NMR Spectroscopy.Applications to Analytical Standards and Agricultural Chemicals[J].Analytical Chemistry,1998,70(23):4921-4928.
[6] Talebpour Z,Haghgoo S,Shamsipur M.1H nuclear magnetic resonance spectroscopy analysis for simultaneous determination of levodopa,carbidopa and methyldopa in human serum and pharmaceutical formulations[J].Analytica Chimica Acta,2004,506(1):97-104.
[7] 张剑荣,余晓冬,屠一锋,等.仪器分析实验[M].2版.北京:科学出版社,2009:108-115.
[8] 浙江大学化学系组编,雷群芳主编.中级化学实验[M].北京:科学出版社,2005:149-153.
[9] 徐家宁,朱万春,张忆华,等.基础化学实验(下册)[M].北京:高等教育出版社,2006:260-266.
[10] 北京大学化学与分子工程学院分析化学教学组.基础分析化学实验[M].3版.北京:北京大学出版社,2010:217-224.
[11] 陈培榕,李景虹,邓 勃.现代仪器分析实验与技术[M].2版.北京:清华大学出版社,2006:229-260.
[12] 杨万龙,李文友.仪器分析实验[M].北京:科学出版社,2008:266-280.
[13] 雷 杰,樊惠芝,张晋芬,等.国内综合院校仪器分析实验课程现状的分析和思考[J].湖南师范大学自然科学学报,2011,34:348-350.Lei Jie,Fan Hui-zhi,Zhang Jin-fen,et al.Analysis and reflection about instrumental analysis experiment at different universities[J],Journal of Natural Science of Hunan Normal University,2011,34:348-350.
[14] 吴性良,朱万森.仪器分析实验[M].2版.上海:复旦大学出版社.2008:152-156.
[15] 吴性良,孔继烈.分析化学原理[M].2版.北京:化学工业出版社,2010:330-357.
