腹膜后去分化脂肪肉瘤的CT特征
2014-10-17吴秀丽季文斌樊树峰
吴秀丽 陈 进 季文斌 樊树峰
浙江省临海市台州医院放射科,浙江临海 317000
去分化脂肪肉瘤(dedifferentiated liposarcoma,DDL)是脂肪肉瘤一种亚型,占脂肪肉瘤的15%~25%,多发生在腹膜后,也可见于四肢、躯干和阴囊、精索,可在20~92岁发病,其恶性程度取决于去分化区域的多少,文献报道其术后局部复发率达41%~52%,远处转移率达15%~20%[1-4]。术前准确诊断对治疗方案的选择和预后都有重要影响[5]。本文报道3例腹膜后DDL的CT表现,对照病理、相关文献和手术治疗效果,分析了腹膜后DDL的CT特征,旨在提高术前诊断水平,为制定治疗方案提供依据。
1 资料与方法
1.1 一般资料
收集浙江省临海市台州医院2007年1月~2013年4月经手术病理证实的腹膜后去分化型脂肪肉瘤3例,男2例,女 1例,年龄45~55岁,平均 51岁。临床表现为腹部肿块,并出现腹痛和胃肠道压迫症状等。3例均系原发初诊,均行CT平扫+增强扫描及手术切除,其中1例于术后7个月复发,再次手术后2个月CT随访发现再次复发;1例术后2个月CT随访发现右侧髂腰肌与腹壁交界处稍低密度结节,1年半CT随访该病灶大致同前;1例多发病灶者术后1个月CT随访局部未见复发,1年后腹部超声随访未见转移征象。
1.2 检查设备和方法
使用GE公司16层Lightspeed CT扫描仪检查。检查前1 d嘱患者多饮水,进少渣饮食,并口服缓泻剂,前晚 8~10 h用开塞露通便,并保持肠道清洁。3例患者均行螺旋CT平扫加增强扫描,扫描范围从膈顶至耻骨联合水平,扫描条件为:120 kV,160 mA,准直器宽度0.625 mm,重建层厚0.5 cm。将CT薄层图像内插至ADM 4.1工作站行后处理,利用多平面重建等方法,并根据病变观察的需要,对感兴趣区进行多角度重点观察。增强双期扫描:经肘静脉以2.0~3.0 mL/s的速率注入非离子型对比剂碘帕醇液70~80 mL,注药后25~30 s行动脉期扫描,55~60 s行静脉期扫描。
2 结果
2.1 病例1
患者,女,53岁,CT平扫示下腹部及盆腔一巨大占位,形态不规则,呈分叶状,大小约15.2 cm×13.1 cm×11.0 cm,边界大部较清,病灶密度不均匀,CT值-75.8~39.2 Hu,低密度脂肪成分呈条带状位于肿块周边(图1a),未见明显液化坏死区及钙化影,增强扫描脂肪成分未见强化(图1b、c),软组织肿块不均匀、持续、渐进性强化,部分呈结节状、片絮状明显强化,CT值达99.4 Hu,部分呈轻度强化。术后病理示去分化脂肪肉瘤。术后7个月CT复查(图1d)示肿瘤复发,大小约 22.0 cm×18.0 cm×12.0 cm,CT表现大致同前。于再次手术后1.5个月CT复查,右侧腹腔肿块复发,大小约5.0 cm×3.8 cm×4.0 cm,并侵犯部分肠壁。
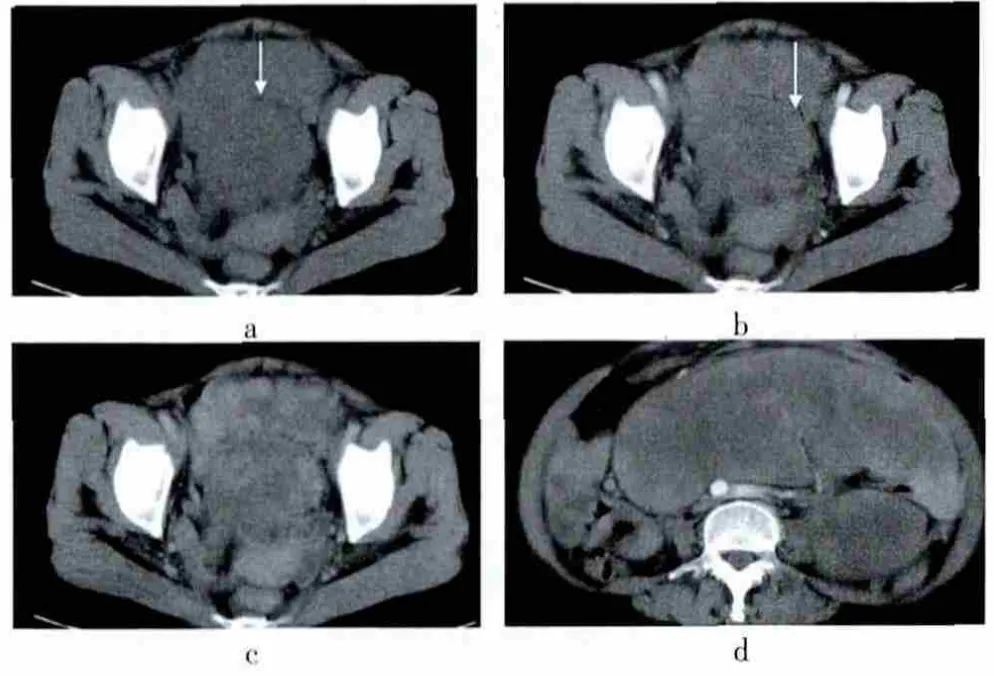
图1 病例1 CT图像
2.2 病例2
患者,男,45岁,CT平扫示右下腹,腰大肌与髂腰肌之间一类椭圆形巨大占位,大小约11.5 cm×8.5 cm×7.0 cm,形态较规则,无分叶,CT 值 24.8~49.2 Hu,右侧腰大肌弧形受压(图2a),右侧髂腰肌与肿块分界不清,可见肿块周围“假包膜”(图2b),增强后明显不均匀强化,CT值37.0~80.0 Hu,肿块右侧间隙见增粗紊乱血管影。术后病理示异型细胞增生,核大深染,梭形、卵圆形或不规则形弥漫片状排列,其间见多量多核瘤巨细胞,部分似蛛网状,部分区间质黏液变性,部分区坏死,考虑DDL。术后2个月CT复查示右侧髂腰肌与腹壁交界处类圆形软组织密度影(图2d),直径约 2.3 cm,边界尚清,平均 CT值约 28 Hu,增强扫描实质部分呈环形明显强化,CT值约71.0 Hu。
2.3 病例3
患者,男,55岁,CT平扫示下腹部及盆腔见多发团块状影(图3a~c),与右肾下极分界不清,密度不均匀,最大者大小约 8.2 cm×10.2 cm×11.0 cm,绝大部分呈软组织密度,平均CT值约34.8 Hu,见少量低密度脂肪成分位于周边,CT值约-62.4 Hu,另见多发脂肪密度肿块,部分内可见分隔状、絮状影,肿块似有融合,边界尚清晰,最低CT值约-90 Hu,增强后肿块左上部分明显不均匀强化,团块右侧见血管(来源于左肾门)包绕,CT矢状面重建显示肿块使左肾受压、上移(图3d)。膀胱直肠陷窝见片状水样密度影。术后病理示:左上较大肿块内瘤细胞大部分呈梭形,排列密集,部分区脂肪母细胞增生,坏死灶形成,考虑DDL;小肿块见脂肪母细胞增生,考虑高分化脂肪肉瘤。术后1个月CT随访局部未见复发,1年后腹部超声随访未见转移征象。
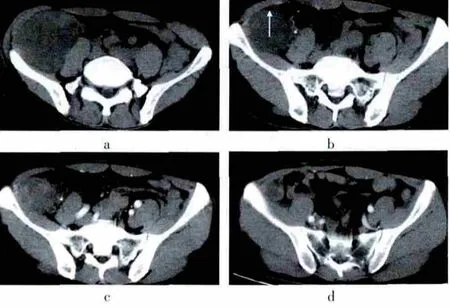
图2 病例2 CT图像

图3 病例3 CT图像
3 讨论
3.1 DDL临床与病理
脂肪肉瘤为起源于原始间叶组织的恶性软组织肿瘤,临床少见。一般认为脂肪肉瘤有高分化脂肪肉瘤、DDL、黏液性/圆形细胞脂肪肉瘤、多形性脂肪肉瘤。
DDL是一种含有两种不同分化和形态结构的脂肪肉瘤,分化性成分多为分化良好的脂肪瘤样脂肪肉瘤,去分化成分为非脂肪性梭形细胞肉瘤,多呈多形性未分化肉瘤(多形性恶性纤维组织细胞瘤)或纤维肉瘤(包括黏液纤维肉瘤)形态,也可含有异源性成分,如横纹肌肉瘤、平滑肌肉瘤、软骨肉瘤、骨肉瘤或血管肉瘤,部分病例中可见类似神经或脑膜上皮样的漩涡样结构。脂肪肉瘤与去分化成分之间多有清楚的界限,或呈镶嵌状,少数情况下可见到逐渐移行的现象。发病人群与高分化脂肪肉瘤相同,未见性别差异,约90%发病时即为DDL,10%为高分化脂肪肉瘤复发时发生去分化[6]。局部复发率为41%~52%,远处转移率为15%~20%。肿瘤所处的部位具有预后意义,位于腹膜后者预后最差[4]。治疗上应被视作中至高度恶性的肉瘤处理,对放疗和化疗均不敏感,以外科手术切除为主[5]。另外需要注意的是,DDL复发时可以全部由高分化成分构成[6]。
3.2 DDL的CT表现
由于腹膜后间隙较大,故DDL发现时肿块一般较大,可自上腹部向盆底部延伸,占据大部分腹盆腔区域,对周围脏器呈压迫推移为主,占位效应明显。文献报道,肿瘤内坏死出血较常见,可伴骨化或钙化[7]。本组3个病例中影像上均未见明确坏死出血及骨化或钙化征象,2例病理切片可见坏死组织,可能系坏死组织成分较少,影像学表现不明显。文献报道由于肿瘤呈离心式球形生长,周围软组织受压至细胞萎缩,使肿瘤呈现出一个似有边界的肿块,受压组织水肿、心血管增生与正常组织之间形成一层“假包膜”[8]。本组病例中2例影像呈软组织密度成分与脂肪密度成分,二者分界截然,可见肿块周围“假包膜”,与文献报道相符。当脂肪密度成分较少且位于肿块周边时,由于分化良好的脂肪密度成分与软组织密度成分间分界截然,需与腹腔内正常脂肪组织相鉴别,但肿瘤组织内的脂肪密度成分位于“假包膜”内,而腹腔内正常脂肪组织位于“假包膜”外,对感兴趣区行CT薄层扫描及多方位重建后处理可从轴位、冠状位、矢状位三个方位观察病灶的形态及结构,对于显示肿块“假包膜”及肿瘤内脂肪密度成分有很大帮助,应注意观察。CT增强扫描显示去分化成分显著不均匀强化,而分化良好的脂肪瘤样区域强化极轻微[3],其增强方式与文献具有一致性。
3.3 鉴别诊断
DDL临床和影像学易误诊为其他软组织肿瘤,主要与腹膜后其他间质来源肉瘤(如恶性纤维组织细胞瘤、平滑肌肉瘤等)相鉴别。恶性纤维组织细胞瘤CT上常表现为界限不清的软组织肿块影,坏死常见,钙化为其特征性表现,当CT表现为多发团块状或环形偏心性钙化时首先考虑本病。平滑肌肉瘤发生于腹膜后者少见,多有包膜而边界清晰,坏死、囊变较常见,当坏死面积很大时可类似囊肿,较早发生广泛转移。恶性神经源性肿瘤多位于脊柱旁或邻近腹主动脉及下腔静脉,一般较大,边界不清,瘤内常见出血、坏死、囊变或钙化,血供丰富,且周围一般不含低密度脂肪组织。对于含极少或无脂肪组织成分的DDL,则鉴别困难。对于含明确脂肪组织的肿瘤,还需与畸胎瘤相鉴别,但畸胎瘤除含有软组织及脂肪成分外,其内可见骨骼、牙齿等成分,在CT上表现为高密度影,一般不难鉴别。
综上所述,本研究认为,CT能对腹膜后脂肪肉瘤准确定位,能明确肿瘤特征、范围及与周围组织关系。当腹膜后占位,内含明确脂肪组织成分及软组织成分,二者分界截然,并可见肿块周围“假包膜”,增强扫描软组织成分呈明显不均匀强化,应考虑到本病的可能性。由于该病对放化疗不敏感,且复发率较高,治疗上强调首次根治性手术切除较重要[5],故术前对该病准确诊断具有重要意义。
[1]李龙,李湘竑.腹膜后巨大脂肪肉瘤1例并文献复习[J].中华实用诊断与治疗杂志,2012,26(9):884-885.
[2]刘彤华.诊断病理学[M].北京:人民卫生出版社,2013:839.
[3]郝玉娟,罗成华.腹膜后脂肪肉瘤的诊治现状及进展[J].外科理论与实践,2012,17(4):398-400.
[4]王坚,朱雄增.软组织肿瘤病理学[M].北京:人民卫生出版社,2008:224-226.
[5]张忻平,吴国强,吕晨光.腹膜后巨大去分化脂肪肉瘤一例[J].解放军医药杂志,2011,23(6):84.
[6]程虹,金木兰,李增山,等.软组织与骨肿瘤病理学和遗传学[M].北京:人民卫生出版社,2006:36-37.
[7]刘权,彭卫军,王坚.腹膜后去分化脂肪肉瘤的CT诊断[J].中华放射学杂志,2004,38(11):1208-1209.
[8]崔力方,罗成华,张继新,等.腹膜后去分化脂肪肉瘤临床病理分析[J].实用肿瘤杂志,2012,27(6):620-622.
