糖尿病大鼠肺脏微循环通透性的变化及其意义
2014-10-17彭丽媛王海澜翟芳龙谢再明王明君
彭丽媛 王海澜 翟芳龙 谢再明 王明君
1.遵义医学院附属深圳市龙岗中心医院,广东深圳 518116;2.广东省深圳市儿童医院,广东深圳 518000
糖尿病的患病率日益增加,它可使心血管、肾、视网膜、神经等全身多个组织器官的结构与功能发生变化,由于它的致残、致死性并发症,目前已成为全球最关注的健康问题之一。20世纪70年代,Yeh等[1]首次提出肺脏可能是糖尿病的靶器官之一。糖尿病引起肺脏损害的假设在之后的国内外研究中得到了肯定[2-3],并且也越来越受到人们的重视。然而到目前为止,糖尿病引起肺功能损害的原因仍未完全明确。糖尿病对心血管、肾、视网膜、神经等组织器官损害的基础病变是糖尿病微血管病变,而肺组织存在着丰富的结缔组织和血管系统,因此肺部微血管改变亦是糖尿病肺脏损害的病理基础,故而设计了本课题,旨在为临床提供糖尿病肺病的形态学依据,也为临床上预防和治疗糖尿病肺病提供新思路。
1 材料与方法
1.1 动物
选用健康雄性SD大鼠,体重200~240 g,平均(220±20)g,共72只,购于广东省动物实验中心,大鼠适应性喂养1周,动物房采用昼夜交替,时间为12 h/12 h,保证室内温度(22±2)℃,严格遵照遵义医学院的实验室管理制度要求。
1.2 药品与仪器
链脲菌素(STZ):美国 Sigma 公司,cas 18883-66-4,由上海宝曼生物公司提供;多聚甲醛、伊文思蓝(E vans blue,EB)、甲酰胺均由上海宝曼生物公司提供。血糖仪及试纸、电子天平、平头针、头皮针、输液架、自动脱水机、自动包埋机、离心机、石蜡切片机、恒温水浴箱、烤箱、722分光光度计、荧光显微镜、大鼠固定器。
1.3 方法
1.3.1 实验性糖尿病大鼠模型的制备
健康雄性SD大鼠适应性喂养1周后,禁食不禁水12 h,以65 mg/kg的剂量经腹腔一次性注入新鲜配制的STZ溶液来制备糖尿病模型。72 h后,采取尾静脉取血测血糖,血糖>16.7 mmol/L则入选为糖尿病模型。正常组的大鼠则腹腔内注射柠檬酸-柠檬酸钠缓冲液。成模后大鼠给予自由饮食,不用任何药物干预。
1.3.2 实验动物的分组
SD大鼠中随机选取12只作为正常组,腹腔注射等体积的柠檬酸-柠檬酸钠缓冲液;为防止大鼠造模失败及实验过程中死亡而造成的数据缺失,实验组大鼠的实际数量为67只,将它们全部造模后剔除造模不成功的大鼠,造模成功的大鼠则继续饲养,在0、2、4、8、12周时间点,分别随机选取12只作为该组的实验动物。各个实验组再随机分为两个区组,区组1的大鼠行心脏灌注,取下肺组织称其干湿重;区组2大鼠则尾静脉注入伊文思蓝,循环1 h后行心脏灌注,再在分光光度计下测肺组织的OD值、制作石蜡切片后在荧光显微镜下观察其荧光量。
1.3.3 干湿重法测肺脏组织的含水量
麻醉成功后,将大鼠仰卧固定于实验台上,心脏灌注生理盐水直至右心房流出液呈无色、肺脏变白、肝脏和肾脏变裸色、可视血管均呈白色为止,再灌注室温4%多聚甲醛60 mL,直至大鼠身体变硬为止。取下肺组织,称其湿重。再置于58℃烘箱中烘烤72 h至恒重,称其干重。按Elliot公式计算每毫克肺组织的含水量:肺组织含水量=(湿重-干重)/湿重×100%,用组织含水量的差异来表示肺微血管通透性的变化。
1.3.4 伊文思蓝灌注法测肺组织微血管的通透性
1.3.4.1 肺组织EB含量的测定
1.3.4.1.1绘制标准曲线 取1mg EB置于EP管中,加甲酰胺至10 mL,混匀后从中取出0.8 mL置于EP管中,再加甲酰胺至10 mL,此作为第1管,此时其浓度为8 μg/mL;从第1管中取5 mL,加入甲酰胺至10 mL,作为第2管,其浓度为4 μg/mL;再从第2管中取5 mL加入甲酰胺至10 mL,作为第3管,浓度为2 μg/mL……照此类推,共9管。将各管液体置于50℃水浴箱48 h后,以甲酰胺作为空白对照溶液,用722 N可见分光光度计在620 nm处测定各管溶液的吸光度 (即OD值),从而计算出回归方程:Y=22.938X-0.1066,(R2=0.999)。 见图1。
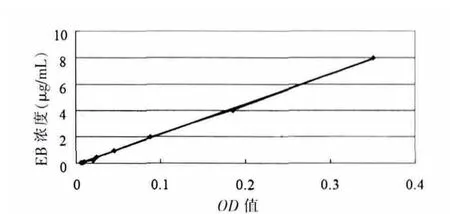
图1 EB标准曲线
1.3.4.1.2 EB含量的测量 参照相关文献方法[4],大鼠经尾静脉以1.5 mL/kg的浓度注入3%EB溶液,循环1 h后,麻醉、心脏灌注,取下左肺组织,称重,置入3 mL甲酰胺溶液中,在50℃恒温水浴箱中孵育48 h以使肺组织中的伊文思蓝充分溶解在甲酰胺中,再以4000 r/min的速度离心20 min。取上清液,722分光光度计下测肺组织的OD值,在标准曲线上计算出每份肺组织的EB浓度。再将它与质量相比,可得每克肺组织的 EB量,即:每克肺组织 EB量(μg/g)=EB浓度(μg/mL)×3 mL/重量(g)。
1.3.4.2 石蜡荧光
如前所述,参照文献方法[5],尾静脉注入 EB循环1 h后,麻醉大鼠,行心脏灌注,取下右肺组织后置于4%多聚甲醛溶液中固定12 h,自动脱水机脱水并自动包埋机包埋后再制成石蜡病理切片(防脱玻片),烤片2.5 h,置梯度酒精脱蜡、水化,直接甘油封片,立即在荧光显微镜绿色激发光下观察EB在肺组织中的分布。相同曝光条件下,拍照记录。
1.4 统计学方法
采用统计软件SPSS 17.0对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病模型制备的结果
对67只大鼠进行造模,其中1只造模不成功予以剔除,在饲养过程中死亡大鼠数量为5只,分别是在造模后 3 d(1 只)、2 周(2 只)、8 周(1 只)、12 周(1只)。实验过程中观察发现:正常大鼠反应灵敏、活动灵活、毛发光泽,血糖水平为(5.93±1.58)mmol/L;而造模后的大鼠反应迟钝、活动少、毛发疏松,体重不增甚至下降,且随着糖尿病病程的延长,上述症状逐渐加重,糖尿病组的血糖均>16.7 mmol/L。
2.2 区组1的大鼠肺组织含水量的比较
根据Ellliot公式计算各组大鼠肺组织的含水量,结果显示:与正常组比较,0周组、2周组糖尿病大鼠肺组织的干湿重稍有增加,但差异无统计学意义(P>0.05)。而4周组、8周组和12周组糖尿病大鼠出现了组织干湿重明显增加,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠肺组织含水量测定结果(g,±s)
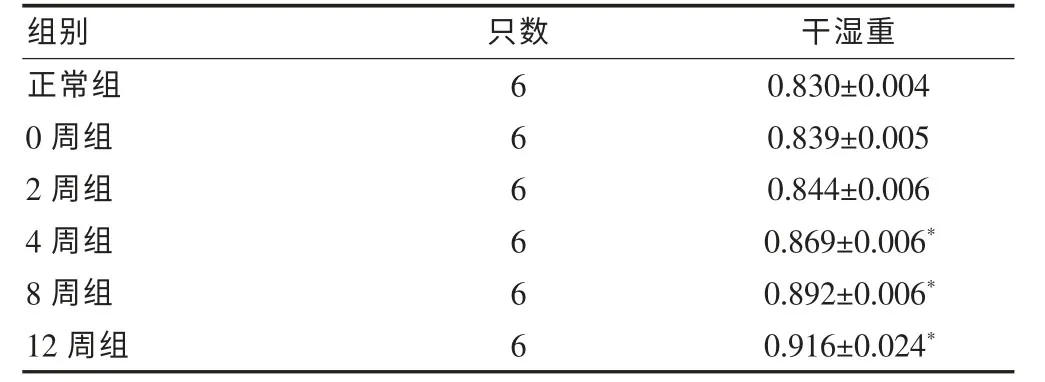
表1 各组大鼠肺组织含水量测定结果(g,±s)
注:与正常组比较,*P<0.05
组别 只数 干湿重正常组60.830±0.004 0周组60.839±0.005 2周组60.844±0.006 4周组60.869±0.006*8周组60.892±0.006*12周组60.916±0.024*
2.3 区组2的大鼠肺组织EB含量的测定
对各组大鼠肺组织EB的含量进行测定,统计分析如下:与正常组相比较,0周组、2周组糖尿病大鼠肺组织EB含量稍有增加,但差异无统计学意义(P>0.05)。从4周开始,糖尿病大鼠出现肺组织EB含量明显增加,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠肺组织 EB含量测定结果(μg/g,±s)

表2 各组大鼠肺组织 EB含量测定结果(μg/g,±s)
注:与正常组比较,*P < 0.05;EB:伊文思蓝
组别 只数 EB含量正常组67.793±0.342 0周组68.078±0.295 2周组68.562±0.630 4周组614.901±0.581*8周组618.855±3.153*12周组628.608±1.777*
2.4 区组2的大鼠肺组织的石蜡荧光
荧光显微镜下观察各组大鼠的肺组织石蜡切片,可见正常大鼠的肺组织肺泡结构正常;随着病程的进展,糖尿病组大鼠的肺泡结构破坏、萎陷,肺泡腔缩小、数量增多且肺泡隔增厚;与正常相比较,0、2周组糖尿病大鼠的肺组织红色荧光量较少,而4、8、12周糖尿病大鼠的肺组织则呈现较强的红色荧光。见图2(封三)。

图2 肺组织EB灌注后的石蜡荧
3 讨论
通过对比糖尿病大鼠不同时间点的肺脏微血管通透性的变化,来研究肺脏微血管通透性改变与糖尿病肺病的关系,结果表明:糖尿病导致大鼠肺脏微血管通透性发生了变化。
微血管病变是糖尿病累及全身多个重要脏器的特征性病理变化[6-7]。肺脏是一个微血管极为丰富的器官。有研究显示肺炎[8]、肺间质纤维化[8]、慢性阻塞性肺疾病[9]、肺结核[10]等多种肺部疾病均与糖尿病病程和血糖控制不良有关。关于糖尿病肺病的发病机制,目前认为与肺微血管病变、氧化应激、炎症、机体免疫力下降、自主神经病变有关。文献报道糖尿病肺脏微血管病变病理改变主要为基底膜增厚、管腔阻塞,管壁硬化、透明性变,肺泡上皮增厚,肺泡隔透明性变、硬化,肺泡腔巨噬细胞和代谢产物积聚,肺泡-毛细血管弥散膜增厚,通气/灌注失衡[2]。肺泡隔上皮细胞基板融合部以及肺泡毛细血管内皮细胞基板增厚,可能由糖尿病导致的微血管内皮细胞损伤及血管通透性增加而引起[11-12]。陈莹莹等[13]通过比较糖尿病C57/BL6小鼠与对照小鼠气管切开后自主呼吸通气4 h的肺微血管通透性变化,结果显示糖尿病小鼠肺损伤可能与肺微血管通透性增加有关。而在本研究中,观察了不同糖尿病病程的肺脏组织微血管通透性的变化,采用的反映肺脏微血管的通透性大小的指标是现今应用较广泛的肺脏组织干湿重、EB法在分光光度计下测肺组织的OD值以及荧光显微镜下测肺组织的荧光量。其中,干湿重法是一个相对直观的反应组织含水量多少的指标,它可间接反映微血管通透性的变化。而EB法测微血管通透性大小的原理是其与白蛋白的紧密结合,当微血管通透性发生变化时,它可通过增大的细胞间隙到组织中,测量其组织中的含量即可分别定量和定性通透性大小。为了减少误差,本研究采用心脏灌注以减少取材时血管内EB含量对结果的影响。
本研究采用干湿重法、EB灌注法来反映肺微血管通透性的大小,结果表明,糖尿病大鼠4周时已可见明显的微血管通透性的变化和肺泡结构破坏、萎陷,肺泡腔缩小、数量增多和肺泡隔增厚,且随着病程的进展而不断加重。其原因是糖尿病引起肺泡结构变化、肺泡隔增厚和基质增多,使肺泡气体弥散距离及阻力增加,影响肺泡的气体交换功能,从而引起组织缺氧的发生。长期处于高糖状态会导致肺泡内血管内皮结构的改变,使肺部肺毛细血管壁的通透性增加,血浆及蛋白分子漏出量增加,组织蛋白使结缔组织显著增生,肺泡弹性降低,从而导致肺泡的通气功能及弥散功能障碍。
通过观察不同病程的糖尿病大鼠肺脏微血管通透性的变化,本研究发现糖尿病导致了大鼠肺脏微血管通透性发生了变化。这不仅丰富了糖尿病肺病的发病机制的研究,同时也为其防治提供依据。当然,改变肺通透性能否使糖尿病肺病得以改善,这仍有待进一步的研究。
[1]Yeh HC,Punjabi NM,Wang NY,et al.Cross-sectional and prospective study of lung function in adults with type 2 diabetes:the Atherosclerosis Risk in Communities (ARIC)study[J].Diabetes Care,2008,31(4):741-746.
[2]甄月巧,杨篷,杨震,等.2型糖尿病患者肺功能变化及相关风险因素分析[J].中国糖尿病杂志,2013,21(1):36-38.
[3]Baughman P,Marott JL,Lange P,et al.Combined effect of lung function level and decli ne increases morbidity and mortality risks[J].Eur J Epidemiol,2012,27(12):933-943.
[4]Lu W,Chen Y,Xia Z,et al.Modified Evans blue fluorimetry for determination of pulmonary vascular permeability in rats sustaining burns,and delayed fluid resuscitation of burn shock[J].Burns,1997,23(6):490-492.
[5]刘清君.正己烷对血-神经屏障通透性及神经生长因子与其受体影响的研究[D].北京:中国疾病预防控制中心,2007:1-93.
[6]Tesfaye S,Selvarajah D.Advances in the epidemiology,pathogenesis and management of diabetic peripheral neuropathy[J].Diabetes Metab Res Rev,2012,28(1):8-14.
[7]El Boghdady NA,Badr GA.Evaluation of oxidative stress markers and vascular risk factors in patients with diabetic peripheral neuropathy [J].Cell Biochem Funct,2012,30(4):328-334.
[8]Ehrlich SF,Quesenberry CJ,Van Den Eeden SK,et al.Patients diagnosed with diabetes are at increased risk for asthma,chronic obstructive pulmonary disease,pulmonary fibrosis,and pneumonia but not lung cancer[J].Diabetes Care,2010,33(1):55-60.
[9]欧阳张宁.糖尿病对慢性阻塞性肺疾病患者肺功能血气分析的影响[J].四川医学,2013,34(1):81-83.
[10]邹立群,徐爱晖.肺结核病合并2型糖尿病患者临床特征分析[J].临床肺科杂志,2010,15(4):525-526.
[11]杜玉茗,王海英,吴晶.老年糖尿病及其慢性并发症对医院感染的影响[J].中国老年学杂志,2008,28(10):1026-1027.
[12]卢一,谢冰.诱导型一氧化氮合成酶与视网膜新生血管形成的关系[J].中国斜视与小儿眼科杂志,2012,20(1):48-48,34.
[13]陈莹莹,龚平,陈畅,等.机械通气对糖尿病小鼠肺微血管通透性的影响[J].中华麻醉学杂志,2012,32(1):89-92.
