建立人肝微粒体—小鼠3T3成纤维细胞模型评价5—羟基雷公藤内酯醇代谢产物的细胞毒性
2014-10-17李华徐佳刘海燕
李华+徐佳+刘海燕
摘 要 目的:以环磷酰胺(cyclophosphamide,CPA)和他莫昔芬(tamoxifen,TMX)为模型药物,建立人肝微粒体-小鼠3T3成纤维细胞模型,并用该模型评价5-羟基雷公藤内酯醇(T8)代谢产物的细胞毒性。方法:采用人肝微粒体(加或不加NADPH)-小鼠3T3成纤维细胞模型,测定吸光度(A值)并计算细胞孵育液的EC50值和EC50 shift,以EC50 shift评价代谢产物毒性。结果:模型药物CPA和TMX及创新药物T8的EC50 shift分别为0.34、>4.7和1.2,表明CPA和TMX的代谢物会分别增加和降低细胞毒性,而T8代谢产物不影响或稍许降低对细胞的毒性。结论:本实验成功建立人肝微粒体-小鼠3T3成纤维细胞模型,这为T8进入体内的安全性提供了一定依据,也为候选化合物开发初期在不合成代谢物的情况下初步评价代谢物的细胞毒性提供了一种体外方法。
关键词 人肝微粒体 3T3成纤维细胞 细胞毒性 环磷酰胺 他莫昔芬 5-羟基雷公藤内酯醇
中图分类号:R992; R965.3 文献标识码:A 文章编号:1006-1533(2014)19-0074-05
Evaluation of the cytotoxicity of 5-hydroxytriptolide metabolites
with human liver microsome and mouse 3T3 fibroblast experimental system
LI Hua, XU Jia, LIU Haiyan*
(Central Research Institute, Shanghai Pharmaceuticals Holding Co., Ltd., Shanghai 201203, China)
ABSTRACT Objective: To evaluate the cytotoxicity of 5-hydroxytriptolide (T8) metabolites by establishing human liver microsome (HLM) and mouse 3T3 fibroblast experimental system with cyclophosphamide (CPA) and tamoxifen (TMX) as model toxicants. Methods: Absorbance (A value) was determined based on HLM incubation systems (with or without NADPH) and the 3T3 fibroblast experimental system and the EC50 value and EC50 shift were calculated. The cytotoxicity of metabolites was evaluated by EC50 shift. Results: The EC50 shift for model toxicant CPA and TMX and novel compound T8 were 0.34, >4.7 and 1.2, respectively, which demonstrated that the cytotoxicity could be increased or reduced by the metabolites of CPA and TMX, respectively while could not be affected or slightly reduced by the metabolites of T8. Conclusion: A human liver microsome and mouse 3T3 fibroblast experimental system was successfully established, which can provide a certain basis for the safety of T8 in human body as well as an in vitro method for the preliminary evaluation of the cytotoxicity of metabolites without synthesis of possible metabolites in the early development phase of drug candidates.
KEY WORDS human liver microsome; 3T3 fibroblast cell; cytotoxicity; cyclophosphamide; tamoxifen; 5-hydroxytriptolide
在化合物筛选过程中,尽早评价化合物进入体内后可能产生的毒性,有助于尽快发现候选化合物。与在动物体内评价化合物毒性的实验方法相比,体外实验所需化合物量相对较少,通量较高,更便于化合物初期筛选。化合物进入体内后主要通过肝脏代谢产生代谢物,而肝脏代谢对化合物毒性的影响主要有两种方式:①相对没有毒性的化合物通过肝脏代谢产生毒性代谢物,毒性代谢物通过体循环进入其他器官而产生细胞毒性,称为“代谢增毒”,如药物环磷酰胺(cyclophosphamide,CPA)[1-4],作为临床常用的烷化剂类免疫抑制剂,可用于治疗各种自身免疫性疾病。CPA进入体内经CYP2B6代谢产生对肿瘤细胞有细胞毒作用的代谢物,然而代谢物也会通过体循环进入其他组织产生细胞毒作用。②药物本身具有细胞毒性,通过肝脏代谢产生相对没有毒性的代谢物,称为“代谢减毒”,如药物他莫昔芬(tamoxifen,TMX)[5-8],作为一种选择性雌激素受体调节剂用于治疗乳腺癌和卵巢癌,可直接对细胞产生细胞毒作用,TMX经CYP2D6和CYP3A4代谢产生无细胞毒性的活性代谢物。
(5R)-5-羟基雷公藤内酯醇(简称T8)是由上海医药集团股份有限公司中央研究院开发的用于治疗类风湿性关节炎的一类创新药物[9],目前已完成I期临床试验,正筹备开展II期临床试验。T8人体拟用药剂量低(≤1 mg),进入人体后主要通过I相代谢消除,产生多种代谢产物,包括多个脱氢和单氧化代谢产物,因此较难通过合成代谢物的方式评价代谢产物毒性。本文通过所建立的方法研究T8代谢产物对细胞的毒性,以期为T8进入体内的安全性评价提供一定依据。
材料与方法
材料
药品与试剂
人肝微粒体、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)购自美国BD公司;Balb/c 小鼠3T3成纤维细胞株购自中科院上海细胞所;高糖DMEM培养基、谷氨酰胺、双抗(添加青霉素10 000 U·L-1, 链霉素10 000 mg·L-1)、小牛血清(NHCS)、Hank缓冲液、0.25%胰蛋白酶-EDTA、十二烷基硫酸钠(SDS)购自美国Gibco公司;Cell Counting Kit-8(CCK-8)购自日本同仁化学研究所;CPA购自美国Sigma公司;TMX为USP标准品;T8(图1)由上海医药集团股份有限公司中央研究院合成室提供;乙腈购自德国Merck公司;试验用水为灭菌去离子水。
耗材
96孔培养板(美国Corning公司);0.22 mm无菌针头过滤器(德国Merck Millipore公司);2 ml一次性使用无菌注射器(上海米沙瓦医科工业有限公司)。
试验仪器
Logic A2生物安全柜(美国Labconco公司);CO2恒温培养箱、恒温孵育器、CBS-47液氮罐和Varioskan Flash酶标仪(美国Thermo Fisher Scientific公司);TS100 型倒置显微镜(日本Nikon公司);3K15离心机(美国Sigma公司);ZHWY-103B多振幅轨道式恒温培养振荡器(上海智城分析仪器制造有限公司)。
方法
溶液配制
CPA作为“代谢增毒”的模型药物,用乙腈配制浓度为6 mol·L-1的储备液及系列工作溶液:0,0.05,0.15,0.3,0.5,0.6,1,1.5,3,6 mol·L-1。TMX作为“代谢解毒”的模型药物,用乙腈配制浓度为120 mmol·L-1的储备液及系列工作溶液:0,0.3,0.6,1.5,2.5,6,10,20,40,120 mmol·L-1。待测物T8用乙腈配制浓度为500 mmol·L-1的储备液及系列工作溶液:0,0.1,1,5,10,20,50,100,250,500 mmol·L-1。
人肝微粒体孵育
人肝微粒体孵育体系分为两种:①加入辅酶NADPH发生氧化还原反应产生代谢物;②不加辅酶NADPH。用高糖DMEM培养基将人肝微粒体稀释到1.25 mg·ml-1,NADPH稀释到10 mmol·L-1,现用现配。最终反应体积为200 ml,人肝微粒体最终作用浓度为1 mg·ml-1,NADPH为1 mmol·L-1,化合物工作液加入2 ml。37 ℃孵育3 h,每一作用浓度3样本,深孔板离心(6 000 g,15 min)后每样本取175 ml上清,3样本合并。孵育液经无菌过滤器过滤,用细胞培养液等体积(1∶1)稀释后进行细胞培养。
细胞培养
将3T3细胞接种于T-75组织培养曲颈瓶中,置37 ℃含5% CO2的恒温培养箱中培养。待细胞生长密度达60%以上时,进行传代。将原培养瓶中的培养基倒出,加入 0.05%胰蛋白酶-EDTA消化,盖过瓶底,37 ℃下消化至显微镜下观察细胞呈圆形,渐渐浮起。加10% NBCS-DMEM终止消化,用吸管吹打混匀,冲洗壁上细胞,直至显微镜下观察细胞已全部浮起,离心去上清,沉淀制成6×104细胞ml-1的悬液,按100 ml/孔接种于96孔细胞培养板中,20~24 h后加入给药溶液100 ml/孔,孵育48 h后进行CCK-8实验。评价3T3细胞活性采用SDS [10],用培养液配制成SDS浓度为10 mg·ml-1的储备液和工作液:10,20,30,40,50,60,75,100 mg·ml-1,如上述方法进行细胞给药。
CCK-8实验
吸弃给药溶液,加入含10%(v/v)CCK-8 的Hank缓冲液(100 ml/孔),温孵适当时间后用酶标仪于450 nm测定吸光度(A值)。
EC50 shift计算和数据处理
细胞活率按下式计算:
(1)
(1)中?值为每个浓度下平行3孔A值的平均值,空白对照组为不含药物的细胞孵育液;实验组为不同药物、不同浓度下的细胞孵育液。
EC50 shift = EC50(+NADPH)/EC50(-NADPH) (2)
(2)中EC50为3T3细胞活率被抑制50%时的作用药物浓度;EC50(+NADPH)为加入NADPH的人肝微粒体孵育液对3T3细胞活率抑制50%时的作用药物浓度;EC50(-NADPH)为不加NADPH的人肝微粒体孵育液对3T3细胞活率抑制50%时的作用药物浓度,本方法初步设定按以下方式判断代谢物细胞毒性:①EC50 shift≥2,产生的代谢物会减少细胞毒性;②1≤EC50 shift<2,产生的代谢物不影响或会稍许减少细胞毒性;③EC50 shift≤0.5,产生的代谢物会增加细胞毒性;④0.5 统计分析 用Origin 8.0统计分析软件作图并计算EC50。 试验结果 3T3细胞活性评价
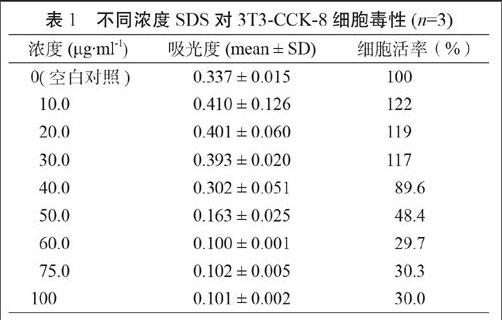
不同浓度SDS对3T3-CCK-8细胞毒性实验结果见表1。计算得到SDS的EC50为49.1 mg·ml-1,与文献结果一致[10],表明3T3细胞活性正常,可用于评价化合物细胞毒性。
“代谢增毒”模型药物CPA
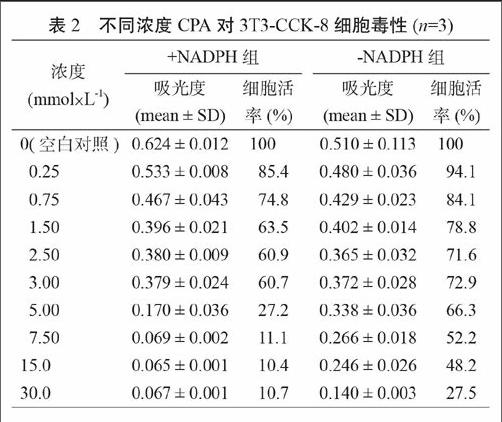
不同浓度CPA对3T3-CCK-8细胞毒性实验结果见表2。计算得到EC50(+NADPH)约为3.35 mmol·L-1,EC50(-NADPH)约为9.89 mmol·L-1,EC50 shift约为0.34,表明CPA代谢物会增加细胞毒性。这与CPA进入人体后通过CYP2B6代谢产生有细胞毒作用代谢物的结果一致。
“代谢减毒”模型药物TMX
不同浓度TMX对3T3-CCK-8细胞毒性实验结果见表3。计算得到EC50(+NADPH)大于600 mmol·L-1,EC50(-NADPH)约为127 mmol·L-1,EC50 shift大于4.7,表明TMX代谢物会降低细胞毒性。这与TMX可直接对细胞产生细胞毒作用,通过CYP2D6和CYP3A4代谢产生相对无毒性活性代谢物的结果一致。
T8代谢产物对细胞的毒性评价
不同浓度T8对3T3-CCK-8细胞毒性实验结果见表4。计算得到EC50(+NADPH)约为0.801 mmol·L-1,EC50(-NADPH)约为0.692 mmol·L-1,EC50 shift约为1.2,表明母药T8对细胞有毒性,T8的代谢产物不影响或稍许降低对细胞的毒性作用。
讨论
化合物开发初期若通过合成代谢物的方法考察代谢产物细胞毒性既费时且成本又高。目前有文献报道[11~13]采用冻存肝细胞和不具有代谢功能的小鼠3T3细胞共孵育方法研究代谢物对细胞的毒性,Li等[13]以CPA和TMX分别作为“代谢增毒”和“代谢解毒”的模型药物,但采用的人肝细胞和共孵育胶原包被IdMOC-96孔板价格昂贵,实验通量较低,对初期筛选而言成本很高。本实验采用可以发生I相代谢但价格相对实惠的人肝微粒体代替冻存人肝细胞孵育代谢物,同样以CPA和TMX作为模型药物建立了方法,并通过3T3细胞EC50 shift评价代谢物毒性,该模型成功验证了CPA代谢物可增加细胞毒性,TMX代谢物可降低细胞毒性。
T8是由我院开发的用于治疗类风湿性关节炎的一类创新候选药物,目前已完成I期临床试验,正筹备开展II期临床试验。研究表明T8进入人体后主要通过I相代谢消除,产生多种代谢物,包括单氧化、环氧开环形成二醇和脱氢等,但没有相对比例较高的代谢物,很难通过合成代谢物的方式评价其代谢物毒性,本文建立的方法适于这种情况下的代谢物的细胞毒性评价。T8在临床II期拟用最高剂量为1 mg,临床I期试验结果显示,1 mg剂量连续给药14 d后,T8的Cmax平均值为16.2 ng·ml-1,约为43 nmol·L-1。介于上述考虑,本次试验将T8的作用浓度范围设为0.000 5~2.50 mmol·L-1。实验结果显示T8的EC50 shift约为1.2,这表明T8经代谢之后产生的代谢物不改变或会稍许降低细胞毒性,这为T8进入人体后的安全性提供了依据。
本方法采用人肝微粒体孵育代谢物主要针对由CYP450酶代谢的化合物,如果研究化合物主要通过II相代谢产生代谢物,就要在孵育体系上作相应调整。另外,有些化合物的溶解度比较差,不能实现预设的最高作用浓度,在试验中要注意观察并及时调整。本文建立的评价代谢物细胞毒性的体外实验方法成本低,通量高,易操作,有利于初期筛选,并为候选化合物在不合成代谢物的情况下评价代谢物毒性提供了参考方法。
参考文献
Chang TK, Weber GF, Crespi CL, et al. Differential activation of cyclophosphamide and ifosphamide by cytochromes P-450 2B and 3A inhuman liver microsomes[J]. Cancer Res, 1993, 53(23) : 5629-5637.
McErlane V, YakkundiA, McCarthy HO, et al. A cytochrome P450 2B6 meditated gene therapy strategy to enhance the effects of radiation or cyclophosphamide when combined with the bioreductive drug AQ4N[J]. J Gene Med, 2005, 7(7): 851-859.
Bacon AM, Rosenberg SA. Cyclophosphamide hepatotoxicity in a patient with systemic lupus erythematosus[J]. Ann Intern Med, 1982, 97(1): 62-63.
Singh G, Saxena N, Aggarwal A, et al. Cytochrome P450 polymorphism asa predictor of ovarian toxicity to pulse cyclophosphamide in systemic lupuserythematosus[J]. J Rheumatol, 2007, 34(4): 731-733.
Al-Akoum M, Dodin S, Akoum A. Synergistic cytotoxic effects of tamoxifen and black cohosh on MCF-7 and MDA-MB-231 human breast cancer cells: an in vitro study[J]. Can J Physiol Pharmacol, 2007, 85(11): 1153-1159.
Cruz Silva MM, Madeira VM, Almeida LM, et al. Hemolysis of human erythrocytes induced by tamoxifen is related to disruption of membrane structure[J]. Biochim Biophys Acta, 2000, 1464(1): 49-61.
Petinari L, KohnL K, de Carvalho JE, et al. Cytotoxicity of tamoxifen in normal and tumoral cell lines and its ability to induce cellular transformation in vitro[J]. Cell Biol Int, 2004, 28(7): 531-539.
Kasahara T, Hashiba M, Harada T, et al. Change in the gene expression of hepatic tamoxifen-metabolizing enzymes during the process of tamoxifen-induced hepatocarcinogenesis in female rats[J]. Carcinogenesis, 2002, 23(3): 491-498.
徐佳, 向志雄, 刘海燕. 5-羟基雷公藤内酯醇不是P-糖蛋白底物或抑制剂[J]. 上海医药, 2013, 34(13): 56-61.
Yang XF, Zhang WG, Yang Y, et al. Preliminary study on neutral red uptake assay as an alternative method for eye irritation test[C]. Tokyo: Proc. 6th World Congress on Alternatives & Animal Use in the Life Sciences, 2007: 509-514.
Bhatia SN, Yarmush ML, Toner M. Controlling cell interactions by micropatterning in co-cultures: hepatocytes and 3T3 fibroblasts[J]. J Biomed Mater Res, 1997, 34(2): 189-199.
Toussaint MJ, Nederbragt H. Lack of effect of extracellular matrix or 3T3 feeder layer on the maintenance of differentiation or survival time of cultured rat hepatocytes[J]. Toxicol In Vitro, 1995, 9(1): 83-90.
Li AP, Uzgare A, LaForge YS. Definition of metabolism-dependent xenobiotic toxicity with co-cultures of human hepatocytes and mouse 3T3 fibroblasts in the novel integrated discrete multiple organ co-culture (IdMOC) experimental system: results with model toxicants aflatoxin B1, cyclophosphamide and tamoxifen[J]. Chem Biol Interact, 2012, 199(1):1-8.
(收稿日期:2013-12-03)
