化学添加剂对水合物生成和储气的影响*
2014-10-16张庆东李玉星王武昌
张庆东 李玉星 王武昌
(中国石油大学(华东)储运与建筑工程学院)
水合物是水与CH4、C2H6、CO2或H2S等小分子在适宜的温度压力环境下生成的非化学计量笼型化合物[1-2]。以水合物方式实现气体的储存是一种固态储存方式,1 m3的水合物可储存150~180 m3气体[3]。利用水合物储存天然气[4-5]有很大的吸引力,它易于生产、储存,成本低,安全性高,可以大幅提高天然气储存的规模和效率。此外,水合物在回收和储存CO2[6]、污水处理、海水淡化、混合气体分离、水溶液浓缩以及水合物蓄冷等[7-8]领域具有广阔的应用前景。然而,由于目前水合物具有生成压力较高、生成温度较低、诱导时间过长、储气密度较小等缺点,限制了水合物的大规模工业化应用。
传质和传热问题是影响水合物生成速率的主要因素。增大气液接触面积,如搅拌[9]、液体分散于气相(喷雾)[10-11]、气体分散于液相(鼓泡)[12]等可以促进传质传热过程。提高气体压力,降低系统温度,有利于水合物的快速生成,但这无疑会增大水合物生成的成本,不利于水合物生成的规模化发展。研究[13-15]发现,向水合物生成体系中加入一些适当的添加剂可以大大降低水合物生成压力。Saito等[13]和Deugd等[14]发现,T HF和丙酮可以有效降低甲烷气体水合物生成压力,促进水合物的生成。Kalogerakis[16]等发现表面活性剂对甲烷水合物生成具有促进作用,并且发现低浓度的表面活性剂对水合物热力学无影响,但却增大了气体的溶解度并加快了水合物的生成速率。H.Ganji[17-18]等人研究了表面活性剂对水合物生成的影响,发现500 mg/L的SDS使水合物形成速率增加35倍,储气能力增加一倍。Kazunori等[19]讨论了表面活性剂对一个静态气-液体系中水合物形成的影响,Rogers课题组[20]提出了利用表面活性剂SDS促进乙烷水合物的生成,考察了多种阴离子型表面活性剂对水合物生成的影响,发现浓度为242 mg/L及以上的SDS富水溶液能够形成增溶乙烷气体的胶束,提高其在水中的溶解度,从而促进水合物生成。本文通过实验研究了不同添加剂SDS和T HF对CO2水合物生成速率、储气密度和表观水合数的影响。
1 实验装置及材料
1.1 实验装置
采用自行设计的水合物反应系统进行水合物生成动力学研究,如图1所示,一共由7个子系统组成,分别为供气系统、配液系统、注液系统、天然气水合物生成反应装置、温控系统、温度和压力测量系统和计算机数据采集系统。
为了适应试验的需要,专门设计制造了容积比较小的水合物生成装置——高压反应釜,它由不锈钢材料制成,内部容积可变,本实验中设定为680 c m3,最大承压15 MPa;温度由低温恒温槽控制,可以快速开启。截止阀与反应釜连通的管线长1.3 m,内径2 mm,容积为4.084 mL;搅拌用磁力搅拌器,最大扭矩为0.213 N·m,最大转速为2 510±1.0%r/min。温度由低温恒温槽控制,温度范围:-30~100℃,温度波动度:±0.05℃,显示分辨率:0.1。低温恒温槽用于给小反应釜控制温度,可用于水合物形成过程中的温度控制。反应釜内温度由Pt 100温度传感器实时测量,测温范围:-50~150℃,准确度:±0.2%,读数±0.2℃;压力由罗斯蒙特3051型差压式压力变送器实时测量,精度0.075%,量程比100∶1,表压量程从0~0.12 k Pa至13.8 MPa。
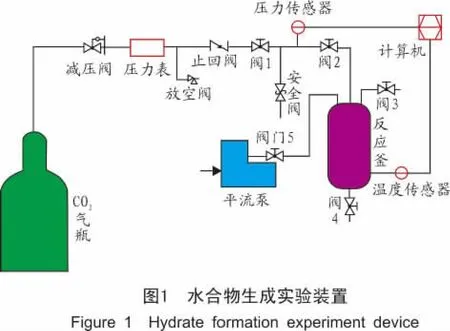
1.2 实验材料及步骤
实验材料主要有CO2、SDS、T HF和去离子水。其规格参数如表1所示,其中去离子水为实验室自制一次蒸馏水。

表1 实验用材料Table 1 Experimental materials
十二烷基硫酸钠(SDS)是一种人工合成的阴离子表面活性剂,常被用作实验室水合物快速生成的添加剂。表面活性剂SDS溶于水后,能够显著降低水的表面张力,改变气液界面状态,从而产生增溶、润湿、乳化、起泡等效果。Zhong等[21]研究发现:在温度为20℃时,SDS在纯水中的CMC(临界胶束浓度)为0.27%(w),它能促进其他气体在水中溶解;在NGH生成体系中加入SDS可以有效缩短诱导时间,加快水合物生成速率。本实验选取SDS作为体系的表面活性剂。
四氢呋喃(THF)是一种水溶性聚合物,常温下为液态,常作为促进水合物快速生成的热力学促进剂。T HF可以和水在任意浓度下生成II型水合物,并且只占据水合物晶格中的大型空穴。Deugd等[14]研究发现,T HF可以有效地降低水合物的相平衡生成压力。
1.3 实验方法及步骤
1.3.1 实验方法
本实验采用定容体系,即控制反应釜的容积不变,实验初始时通入一定压力气体,然后关闭进气阀门,用数据采集卡采集实验过程中不同时刻系统气体压力时值,通过对压力变化的处理分析,判断各种条件对水合物生成速率、水合物含气率的影响。
由于CO2在水中溶解度较大,为了减小由于CO2溶解造成的系统气体压力下降,导致实验结果不准确,实验时,预先在温度20℃、压力2.0 MPa条件下将CO2气体溶解,使其在系统液相达到饱和。控制温度为20℃、压力为2.0 MPa是为了防止CO2在此过程中生成水合物,影响后续水合物快速生成实验的准确性。同时,2.0 MPa的压力低于实验设定温度4.5℃下水合物生成相平衡的压力(2.1 MPa),确保在随后的降温过程中没有水合物生成。
由于在静态条件下气体通过气液界面扩散到液相内部比较缓慢,为了加快CO2溶解速度,专注于CO2水合物生长阶段的研究,本实验采取了用磁力搅拌来促进CO2溶解,并通过采用相同转速避免了因转速不同对实验结果造成的影响。
1.3.2 实验步骤
(1)用去离子水清洗反应釜3次并晾干;(2)打开数据采集软件采集数据,注入200 c m3的水溶液,使用真空泵对反应釜抽真空约5 min;(3)在温度20℃下开启进气阀,向反应釜内充入压力为2.0 MPa的CO2气体,打开磁力搅拌器,促进CO2气体溶解饱和;(4)待CO2溶解饱和、釜内压力维持在2.0 MPa不再变化后,关闭进气阀门,开启恒温水浴循环,对反应釜快速降温至4.5℃;(5)待釜内温度恒定在4.5℃后,开启进气阀门,向反应釜内充气至实验压力4.0 MPa后停止注气,此时作为记录数据的起始时刻。
整个实验过程中水浴温度保持4.5℃不变。各实验工况列于表2。

表2 实验工况Table 2 Experimental conditions
2 实验结果和机理分析
2.1 水合物储气密度和表观水合数的定义
表面活性剂浓度对CO2气体水合物的储气性能有很大影响,水合物储气性能通常以一定条件下的储气密度或含气率(V0/V)来表示,与储气密度相关的水合数nH通常定义为水合物中水与气体的摩尔分数。对于Ⅰ型水合物,其理论值为136/24。在本文中,表观水合数即反应釜内水与生成水合物所消耗的气体的摩尔分数,定义为n,则n为:

式中,mw和mNG分别为生成水合物所消耗水和气体的质量,g;Mw和MNG分别为水和CO2气体的摩尔质量,g/mol。
天然气水合物的储气密度可以通过下式计算:

式中,V和V0分别为反应釜内水和反应的气体在标况下的体积,c m3;VH为水合物的体积,c m3。
2.2 单组分添加剂对CO2水合物生成的影响
搅拌下添加单组分添加剂时,CO2水合物生成过程中反应釜内气体压力随时间的变化曲线,如图2所示。水合物生成过程中气体的消耗率即水合物的平均形成速率[22],用一定时间内反应釜中气体的压降来表示。

从图2可以看出,实验开始后各系统压力均出现一定压降,这是由于CO2在液相溶解造成的。随着CO2溶解达到饱和,A压力逐渐趋于稳定,系统压降较小,表明气体消耗量较少,水合物生成量较小。实验B、C、D、E的系统压力曲线在CO2溶解饱和后突然上升,然后又迅速下降,经历较大压降后趋于稳定。实验过程中压力突然上升,是因为水合物大量生成时放出大量热量,导致系统温度升高,气体膨胀导致系统压力升高。随着水合物的生成,CO2不断被消耗,气体压力逐渐降低。
在SDS浓度小于300 mg/L时,随着SDS浓度的增加,系统气体压力曲线斜率逐渐增大,最终平衡压力逐渐降低;当SDS浓度超过300 mg/L时,随着其浓度的增加,气体压力曲线斜率逐渐减小,最终平衡压力升高。通过实验F发现,单组分添加剂T HF对CO2水合物的促进作用并不明显[23]。

图3给出了反应温度T=277.65 K,初始压力p=4.0 MPa的条件下,水合物的储气密度与SDS水溶液浓度的关系。由图3可以看出,当SDS水溶液浓度小于300 mg/L时,随着SDS溶液浓度的增大,水合物的储气密度逐渐增加;超过300 mg/L后,随着SDS溶液浓度的增大,水合物的储气密度逐渐减小。
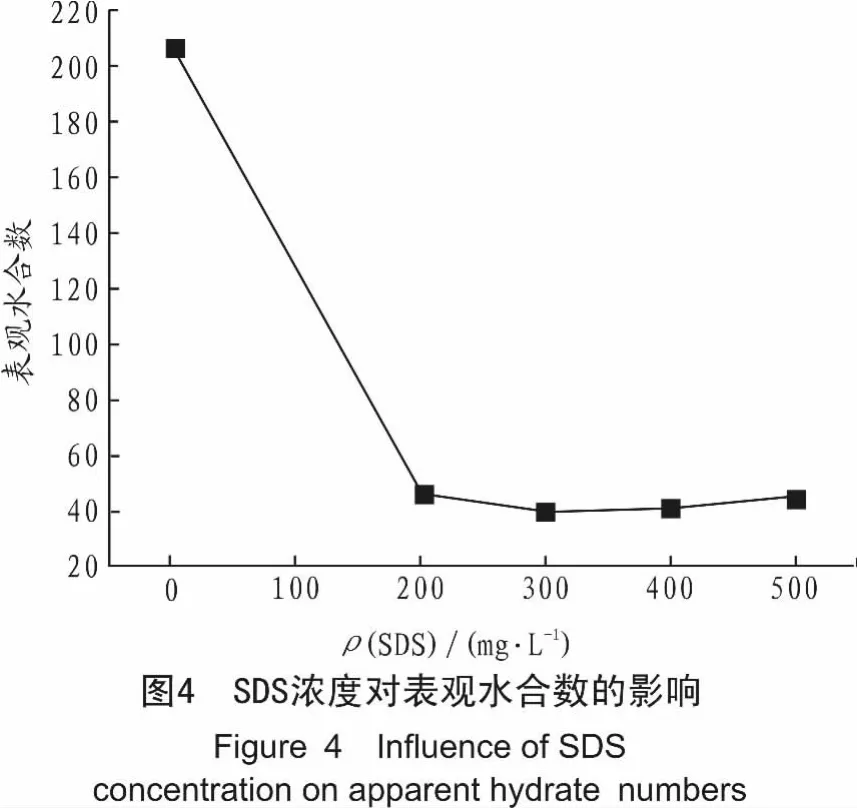
图4给出了温度T=277.65 K,初始压力p=4.0 MPa条件下,表观水合数与SDS水溶液浓度的关系。由图4可以看出,对于SDS水溶液体系,当浓度低于300 mg/L时,表观水合数随浓度的增大而减小;当浓度高于300 mg/L时,表观水合数随浓度的增大而稍有增加。
通过实验A、B、C、D和E可发现:在临界胶束浓度以下,随着SDS浓度的增加,系统压力曲线斜率不断增大,水合物生成速率不断增大;在临界胶束浓度以上,随着SDS浓度的增大,系统最终压力增大,表观水合数增大,储气密度降低,表明水合物的相平衡化学位和相平衡压力增大,过多的SDS抑制了水合物的生成速率,降低了水合物的储气密度和生成量。
2.3 复合添加剂对CO2水合物生成的影响
SDS和T HF两种添加剂的单独作用机理不同,本文将300 mg/L的SDS与1%的T HF进行混合添加剂的实验,以便充分利用其不同的作用效果。
由图5可以看出,单独添加T HF的实验F系统的压降不大,水合物生成量较小,这与龚果清等人所得结论[24]相符;实验G相较于实验C,系统压力曲线斜率更大,最终平衡压力更低。
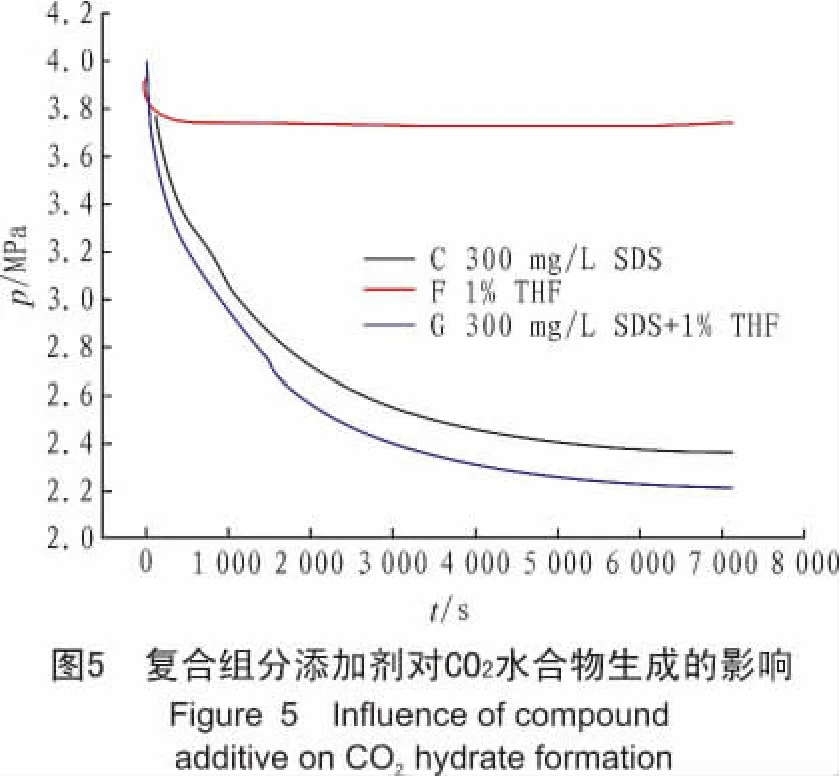
表3给出了复合添加剂、单组分添加剂下CO2水合物储气密度和表观水合物。根据表3可以看出,SDS和1%THF的复合添加剂可以提高水合物的储气密度,增强水合物储气能力,减小水合物的表观水合数,其作用效果优于单独添加剂的作用效果。
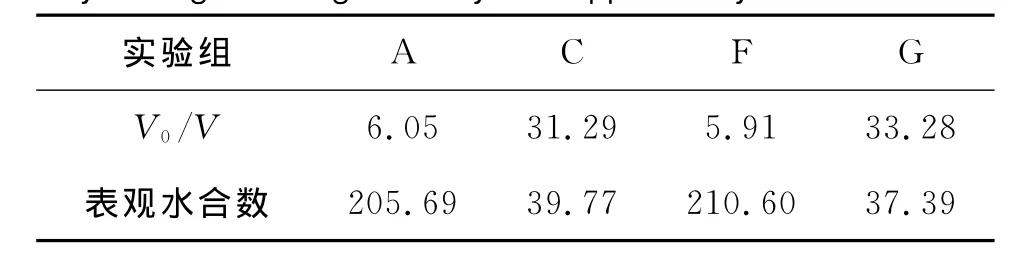
表3 不同组分添加剂对CO2水合物储气密度和表观水合数的影响Table 3 Influence of different components additive on CO2 hydrate gas storage density and apparent hydrate numbers
通过实验C、F和G可以看出,单组分添加剂T HF对水合物生成的促进效果并不明显;单组分添加剂SDS可以促进CO2气体的溶解,促进水合物的快速生成;复合添加剂SDS和THF对CO2气体水合物生成促进效果非常明显,大幅提高了水合物生成速率,并且降低了水合物生成相平衡压力,提高了水合物的生成量和储气密度,减小了表观水合数。
2.4 机理分析
CO2水合物的成核和生成发生在溶液中CO2过饱和处。纯水的表面张力较大,CO2气体难以通过气液界面进入液相,只能在气液界面处形成过饱和溶液,不利于水合物的成核,增大了成核的诱导时间,难以形成水合物。表面活性剂SDS可以降低气液界面处的表面张力,减小CO2气体通过气液界面进入液相的阻力,促进液相中泡沫的形成,增大气液接触面积。泡沫生成时,伴随着液体表面积增加,体系能量也相应增加,从能量观点考虑,低表面张力对于泡沫形成比较有利。根据Laplace公式,液膜Plateau交界处与平面膜之间的压差与表面张力成正比,表面张力低则压差小,因而排液速度较慢,液膜变薄较慢,有利于气泡稳定;根据表面张力公式δ=R*Δp/4和气泡的比表面积公式i=3/R,在气泡内外压差Δp一定时,表面张力δ越小,气泡半径R越小,比表面积i越大,单位质量的气体与液体的接触面积越大。
加入SDS后,在临界胶束浓度以下,随着SDS浓度的增加,液体表面张力逐渐降低,CO2通过气液界面的阻力逐渐降低,促进了泡沫生成和泡沫比表面积的增大,增大了气液接触面积,提高了CO2过饱和度,增大了水合物成核的几率,缩短了水合物生成过程的诱导时间,同时提高了水合物形成过程中传质过程的进行,增大了水合物生成速率。当溶液中SDS浓度超过表面活性剂的临界胶束浓度时,溶液的表面张力逐渐升高,气泡生成量减少。
对于组分水,其相平衡的约束条件为:

式中,μw,H为水在水合物相中的化学位;μw,L为水在富水相中的化学位。
过多的SDS增大了水在富水相中的化学位μw,L,提高了水合物相平衡化学位和相平衡压力,降低了水合物的生成量。
T HF可以和水在常压下生成II型水合物,其水合物生成温度高于CO2水合物的生成温度。加入少量T HF后,在相同温度压力条件下,T HF更容易成核形成水合物,THF水合物的形成为CO2水合物的形成提供了晶核,缩短了诱导时间,提高了CO2水合物的生成速率,并且降低了CO2水合物的相平衡压力。复合物添加剂T HF和SDS可以降低液体的表面张力,促进CO2气体的溶解,增大气液接触面积,降低水合物的相平衡压力,缩短水合物形成的诱导时间,提高水合物生成速率和储气量。
3 结论
通过多组水合物快速生成实验,研究了T HF和SDS对CO2水合物生成的影响,得出如下结论:
(1) 表面活性剂SDS可以降低液相的表面张力,减小气体通过气液界面进入液相的阻力,促进气泡的生成,提高气液接触面积,加强水合物生成时的传质过程,提高水合物的生长速率和储气密度。
(2) 较高的活性剂浓度会增大液体的化学位,提高水在水合物相中的化学位,提高水合物的相平衡压力,减少水合物的生成量,降低水合物储气密度。
(3) 复合添加剂SDS和T HF可以降低液相表面张力,促进气液传质作用,缩短水合物成核诱导时间,提高水合物形成速率,增大水合物储气密度和生成量,减小表观水合数,降低CO2相平衡压力。
[1] Sloan E D.Clathrate Hydrates of Natural Gases[M].New York:Marcell Dekker,1998:55-92.
[2] 樊栓狮.天然气水合物储存与运输技术[M].北京:化学工业出版社,2004:9-11.
[3] 陈光进,孙长宇,马庆兰.气体水合物科学与技术[M].北京:化学工业出版社,2008.
[4] Javan mardi J,Nasrifar K,Najibi S H,et al.Econo mic evaluation of natural gas hydrate as an alternative f or natural gas transportation[J].Applied Ther mal Engineering,2005,25(11-12):1708-1723.
[5] 孙志高,刘成刚,周波.水合物储存气体促进技术实验研究[J].石油与天然气化工,2011,40(4):337-338.
[6] Saji A,Yoshida H,Sakai H,et al.Fixation of car bon dioxide by clathrate hydrate[J].Energy Conversion and Management,1992,33(5-8):643-649.
[7] Ngan Y T,Englezos P.Concentration of mechanical pulp mill effluents and Na Cl solution t hr ough propane hydrate f or mation[J].Industrial & Engineering Che mistr y Research,1996,35(6):1894-1990.
[8] Douzet J,Dar bouret M,Lalle mand A,et al.Rheological st udy of TBAB hydrate slurries as secondary t wo-phaserefrigerants f or an air conditioning application at the industrial scale[C]//Proceedings of t he 6t h Inter national Conference on Gas Hydrates.Vancouver,British Colu mbia,Canada,2008.
[9] Englezos P,Kalogerakis N,Dholabhai P D,et al.Kinetics of f or mation of met hane and et hane gas hydrates[J].Che m.Eng.Sci.,1987,42(1):2647-2658.
[10] Fuku moto K,Tobe J,Oh mura R,et al.Hydrate f or mation using water spraying in a hydrophobic gas:A preli minary study[J].AICh E Jour nal,2001,47(3):1899-1904.
[11] 肖杨,刘道平,杨群芳,等.雾流方式制备水合物反应器的模型及分析[J].石油与天然气化工,2008,37(2):97-100.
[12] Maini B B,Bishnoi P R.Experi mental investigation of hydrate f or mation behavior of a nat ural gas bubble in a si mulated deep sea envir on ment[J].Chem.Eng.Sci.,1981,36(1):183-189.
[13] Saito Y,Kawasaki T,Okui T,et al.Methane storage in hydrate phase with water soluble guests[C]//Second International Conference on Natural Gas Hydrates.Toulouse,France,1996:459-465.
[14] Deugd R M,Jager M D,Arons J S.Mixed hydrates of met hane and water-sol uble hydr ocar bons modeling of empirical results[J].AICh E J,2001,47(3):693-704.
[15] 戴兴学,杜建伟,唐翠萍,等.化学类添加剂抑制天然气水合物形成的实验研究[J].石油与天然气化工,2011,40(1):11-14.
[16] Kalogerakis N,Ja maluddin A K M,Dholabhai P D,et al.Effect of surfactants on hydrate f or mation kinetics[C]//paper presented at t he SPE Inter national Sy mposiu m on Oilfield Che mistry.New Orleans,La,U.S.A,1993.
[17] Ganji H,Manteghian M,Rahi mi Mofrad H.Effect of mixed compounds on methane hydrate f or mation and dissociation rates and storage capacity[J].Fuel Processing Technology,2007,88(9):891-895.
[18] 赵建忠,石定贤,赵阳升.喷射方式下表面活性剂对水合物生成实验研究[J].天然气工业,2007,27(1):114-116.
[19] Kazunori Okutanil,Yui Kuwabara,Yasuhiko H Mori.Surfactant effects on hydrate for mation in an unstirred gas/liquid system:Amend ments to t he previous study using HFC-32 and sodiu m dodecyl sulfate[J].Chemical Engineering Science,2007,62(14):3858-3860.
[20] Rogers R,Yevi G Y,Swal m M.Hydrates f or storage of nat ural gas[C]//Pr oceedings of t he 2nd Inter national Conference on Nat ural Gas Hydrates.France:Toulouse,1996:423-429.
[21] Zhong Y,Rogers R E.Surfactant effect on gas hydrate f or mation[J].Chem.Eng.Sci.,2000,55(19):4175-4187.
[22] 刘妮,张国昌,Rogers R E.二氧化碳气体水合物生成特性的实验研究[J].上海理工大学学报,2007,29(4):405-408.
[23] 刘妮,Zhang Guochang,Rogers R E.添加剂对CO2水合物生成的影响[J].天然气工业,2008,27(12):104-106.
[24] 龚果清,刘妮,刘道平,等.SDS和THF对二氧化碳水合物形成的影响[C]//中国制冷学会.中国制冷学会2007学术年会论文集.北京:中国制冷学会,2007:5.
