粪肠球菌体外根尖生物膜模型的建立及形态学研究
2014-10-13曹日丹侯本祥
曹日丹 侯本祥
首都医科大学附属北京口腔医院牙体牙髓科,北京 100050
粪肠球菌是根管治疗失败患牙最常分离出的细菌之一,被认为是导致根管治疗后疾病的重要因素。研究[1-3]显示,80%以上的慢性根尖周炎和持续性根尖周炎患牙的根尖牙骨质表面存在细菌生物膜。对根尖生物膜的形成及致病机制的研究[4-6]发现,粪肠球菌的生物膜结构可能使细菌具有更强的致病性,且很难被彻底清除,但具体机制仍有待深入研究。目前,建立粪肠球菌根管内生物膜模型的报道较多[5,7-11],而对根尖生物膜模型的研究则非常罕见。本研究的目的是建立粪肠球菌根尖生物膜的体外模型,为粪肠球菌在根尖周炎中致病机制的研究奠定基础。
1 材料和方法
1.1 仪器和试剂
离体人牙;粪肠球菌(粪肠球菌标准株ATCC 29212,北京口腔医学研究所保藏管理中心),CDC培养基;碘化丙啶(propidium iodide,PI)、刀豆球蛋白A异硫氰酸荧光素(ConA- fl uorescein isothiocyanate,ConA-FITC)荧光染液(Sigma公司,美国);激光共聚焦培养皿(MatTek公司,美国),生化培养箱,扫描电子显微镜(scanning electron microscope,SEM)、激光共聚焦扫描电子显微镜(confocal laser scanning microscope,CLSM)(Leica公司,美国);Photoshop CS5图像分析软件,Leica Q win图像分析软件。
1.2 离体牙的选择及处理
选取因正畸减数需要而新鲜拔除的人单根管前磨牙24颗,要求根尖发育完全,根面无龋坏,无根裂或牙根外吸收。剔除根尖1/3过度弯曲的牙齿,清除样本表面的牙周膜。
1.3 根尖生物膜模型的建立
1.3.1 根尖样本的制作 将离体牙标本截去牙冠并拔髓,用ProTaper镍钛系统冠向下方法进行根管预备,预备至F2后用质量分数15%的乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)溶液5 mL作用3 min,5.25%次氯酸钠溶液和生理盐水交替超声荡洗5 min,热牙胶根管充填,充填后拍摄X线片,若恰填则证明根管封闭可靠。截取离体牙7 mm长度的牙根,将其固定于树脂基底座上,将金属结扎丝末端也固定于树脂基底座上,上方连接于玻璃瓶胶塞内,悬吊根尖样本;将玻璃瓶胶塞中穿入注射针头,使瓶内与厌氧罐中气压一致(图1);样本紫外线消毒后置于无菌厌氧血琼脂CDC液体培养基中37 ℃下厌氧培养2 d,若液体培养基澄清,说明样本消毒彻底,4 ℃存放备用。
1.3.2 粪肠球菌菌液培养 粪肠球菌解冻复苏,于生化培养箱中37 ℃下厌氧培养,然后分离纯化,增菌并收集菌膜,置于无菌CDC液体培养基中,调整菌液密度为1×108CFU·mL-1,备用。细菌在CDC琼脂板培养基上生长,形成菌落呈乳脂状白色者为粪肠球菌菌落。
1.3.3 实验分组 将24例离体牙根尖样本随机分为8组,即SEM观察1、2、7 d组和对照组,CLSM观察1、2、7 d组和对照组,每组3颗。实验组浸泡于粪肠球菌ATCC 29212菌液中(37 ℃,厌氧环境),采用连续培养法,每2 d用新鲜的CDC液体更换菌液,建立根尖生物膜模型。分别于培养1、2、7 d取根尖样本,置于无菌EP管中,1 mL PBS缓冲液冲洗3次;对照组样本浸泡于无菌CDC液体培养基中(37 ℃,厌氧环境)7 d,处理步骤同实验组。

图1 粪肠球菌根尖生物膜模型建立装置Fig 1 Device for Enterococcus faecalis bio fi lm formation
1.4 根尖生物膜形态学观察
1.4.1 SEM观察 将每组中的3例根尖组织样本于2%戊二醛溶液中4 ℃固定1 h,然后于梯度乙醇中脱水,临界点干燥,样本表面喷金,置于SEM下观察,每例样本在SEM下随机选取3个视野进行观察,共9个视野。
1.4.2 CLSM观察 将每组中的3例根尖组织样本于2%戊二醛溶液中4 ℃固定1 h,-80 ℃冰冻,用50 μmol·mL-1ConA-FITC染色,室温下染色5 min,然后PBS缓冲液洗涤,15 μmol·L-1PI室温下染色5 min,标本在PBS缓冲液中洗涤,CLSM分别观察生物膜逐层扫描图像和叠加图像。每例样本在CLSM下随机选取3个视野进行观察,共9个视野。在CLSM下,细菌被PI染成红色,细胞外基质被ConA-FITC染成绿色。
1.5 图像分析
使用Photoshop CS5软件计算放大3 000倍的SEM视野图像中的生物膜覆盖率(%),用Leica Q Win软件计算CLSM样本表面的生物膜覆盖面积(μm2)。采用SPSS 17.0统计学软件进行分析,SEM观察样本表面生物膜覆盖率的差异采用单因素方差分析,组间均数的比较采用t检验,检验水准为双侧α=0.05。
2 结果
2.1 SEM观察不同时间生物膜的形成过程及覆盖率
2.1.1 不同时间生物膜形成过程的观察 通过SEM观察,1 d组样本表面的大部分区域未发现细菌附着,可见单层次散在分布的细菌,细菌之间无细胞外基质连接(图2A);2 d组样本表面可见细菌单层散在分布,细菌之间出现细胞外基质连接,大部分区域仍未发现细菌附着(图2B);7 d组可见表面有大量细菌附着,细菌呈群落分布,形成多层次的空间结构,有大量细胞外基质包绕,并形成亲水通道(图2C);对照组表面无细菌及细胞外基质附着(图2D)。

图2 不同时间粪肠球菌生物膜的形态 SEMFig 2 Enterococcus faecalis bio fi lm structure in different times SEM
2.1.2 不同时间生物膜覆盖率的比较 SEM观察1、2、7 d组的表面生物膜覆盖率分别为3.16%±2.23%、5.80%±3.27%、17.23%±1.52%,平均9.04%±6.87%;对照组表面无细菌及细胞外基质附着。随着培养时间的增加,样本表面的生物膜覆盖率也增加。经统计学分析,数据均满足正态分布特征,且方差齐;经单因素方差分析,7 d组与1 d组之间、7 d组与2 d组之间的差异有统计学意义(P<0.05),而1 d组与2 d组之间的差异无统计学意义(P>0.05)。
2.2 CLSM观察不同时间生物膜的形态和结构
2.2.1 不同时间生物膜的形态和荧光面积 随培养时间增加,PI染色的红色荧光面积增加,ConA-FITC染色的绿色荧光面积从无到有,生物膜荧光总面积增加(表1和图3)。1 d组样本表面细菌散在分布,无细胞外基质(图3A);2 d组样本表面细菌增多,无细胞外基质(图3B);7 d组表面有大量细菌,部分呈团状分布,周围有大量细胞外基质包绕(图3C);对照组表面无细菌及细胞外基质(图3D)。

表1 不同时间根尖生物膜的荧光面积Tab 1 Fluorescent stained area of apical bio fi lm in different times μm2
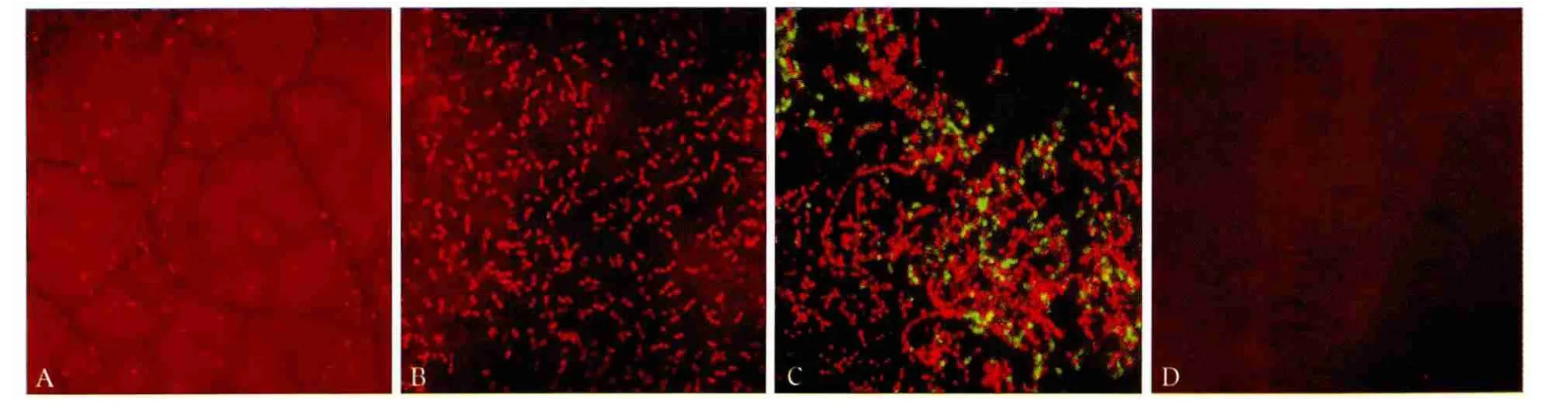
图3 不同时间粪肠球菌生物膜的形态 CLSM × 1 400Fig 3 Enterococcus faecalis bio fi lm structure in different times CLSM × 1 400
2.2.2 根尖生物膜逐层扫描观察 CLSM可以通过对样本表面进行水平逐层扫描,观察生物膜不同层面的图像,如生物膜内层和外层(图4);由于离体牙根尖样本表面不平整,与激光共聚焦培养皿底存在一定的倾斜角度,在逐层扫描时所看到的层面同时包含了生物膜内层和外层。对比7 d组生物膜的内层和外层可以看出,生物膜的内层有大量细菌密集存在,并且被细胞外基质包绕;在生物膜的外层细菌分布相对松散,细胞外基质成分较内层少,在生物膜的表面有少量浮游细菌存在。
粪肠球菌生物膜剖面的CLSM扫描图见图5:扫描层面均与荧光投照方向垂直,而观察图像的方向与荧光投照方向平行;因为样本表面与扫描层面存在一定的倾斜角度,扫描层面可以通过生物膜全层,因此从图5可以清晰地看出生物膜从内层到外层的结构。

图4 CLSM逐层扫描示意图Fig 4 Diagrammatic section of CLSM scanning

图5 粪肠球菌生物膜剖面的CLSM扫描图 CLSM × 1 400Fig 5 CLSM scanning cross-section of Enterococcus faecalis bio fi lm CLSM × 1 400
3 讨论
根管治疗后疾病[12]是指根管治疗后患牙的根尖周病变未愈合或出现新的病变,其临床表现主要为患牙根管治疗后疼痛持续存在或者根尖周病损经久不愈。
根尖生物膜的形成是根管治疗后疾病的主要原因。患牙感染根管内的细菌可以穿过根尖孔而进入根尖周组织,在根尖周病损内的牙根表面上形成细菌生物膜结构。Sunde等[13]采用外科手术方法取出根管治疗后疾病患牙的根尖进行SEM观察,发现根尖外表面的细胞外基质包绕了大量球菌,从而认为根管治疗失败的原因是根外感染。
本实验以粪肠球菌ATCC 29212为实验菌株,是因为粪肠球菌是根管治疗失败的感染根管中最常分离出的细菌。本研究建立的粪肠球菌根尖生物膜的体外模型,具有一定的代表性,在粪肠球菌生物膜的形态学研究以及根管治疗后疾病的致病机制研究中,具有重要的意义。
细菌生物膜是以细菌为主的微生物形成的生态群落,由细菌及细胞外基质组成,易于在惰性表面或坏死组织中生长,对抗生素及机体免疫反应具有抵抗性[4,14]。生物膜内细菌较其浮游状态时对抗生素的耐药性高100~1 000倍,这一特性是感染难以根除的重要原因之一[15]。
在本实验中观察到,随着培养时间的延长,生物膜中细菌及细胞外基质均明显增加,生物膜结构更加致密,体外培养7 d可以形成成熟的根尖生物膜结构。本实验观察到生物膜形成过程分为以下几个阶段:1)细菌在样本表面可逆吸附;2)细菌不可逆附着,在样本表面散在分布;3)细菌快速生长和繁殖,同时产生细胞外多糖及蛋白,生物膜开始形成;4)大量微生物附着,形成大的团簇样结构,并不断向外释放小团的细菌,定植在样本表面的其他部位。生物膜结构形成并且成熟后,感染范围持续扩大,感染不易清除[14]。
现有研究中生物膜模型建立方法主要参照以下条件:1)样本表面介质;2)样本放置方法;3)培养条件。建立生物膜模型主要选择96孔板和离体牙作为样本表面。96孔板皿底表面的粗糙度一致,但牙本质小管、牙骨质等表面结构无法模拟。本实验选用人离体牙根尖作为样本,在牙骨质表面建立根尖生物膜模型,将离体牙根尖以竖直悬吊的方式置于菌悬液中,使得生物膜形成的样本表面与重力方向平行,避免细菌由于重力作用沉降在样本表面。本研究在生物膜形成的连续培养过程中,循环提供营养物质,使粪肠球菌生长维持在恒定的温度和厌氧环境[16-18]。此模型能较稳定地控制生物膜形成的各项参数,具有良好的可重复性。
目前,SEM和CLSM是观察生物膜的主要方法。SEM观察法是目前应用最多的直观观察生物膜结构的方法[8,10]。SEM能够清晰观察到样本表面的微细立体结构,一直是研究生物膜组成及结构的主要方法;但SEM多用于观察表面结构,对于多层次的生物膜,则难以观察到生物膜的全层结构,对于成熟并复杂的生物膜结构,也难以分辨其内细菌和基质的构成。CLSM是一种高精度显微镜系统,在荧光成像基础上加装激光扫描装置,利用计算机进行图像处理,使用紫外光或可见光激发荧光探针,得到微细结构的荧光图像[19-20]。本研究使用两种荧光染液PI和ConA-FITC分别染生物膜的细菌和基质,观察生物膜的结构组成,为研究粪肠球菌生物膜在根尖周炎中的致病机制奠定了基础。
[1]Noiri Y, Ehara A, Kawahara T, et al. Participation of bacterial bio fi lms in refractory and chronic periapical periodontitis[J].J Endod, 2002, 28(10):679-683.
[2]Noguchi N, Noiri Y, Narimatsu M, et al. Identi fi cation and localization of extraradicular bio fi lm-forming bacteria associated with refractory endodontic pathogens[J]. Appl Environ Microbiol, 2005, 71(12):8738-8743.
[3]Leonardo MR, Rossi MA, Silva LA, et al. EM evaluation of bacterial bio fi lm and microorganisms on the apical external root surface of human teeth[J]. J Endod, 2002, 28(12):815-818.
[4]Peters LB, Wesselink PR, Moorer WR. Penetration of bacteria in bovine root dentine in vitro[J]. Int Endod J, 2000,33(1):28-36.
[5]Liu H, Wei X, Ling J, et al. Bio fi lm formation capability of Enterococcus faecalis cells in starvation phase and its susceptibility to sodium hypochlorite[J]. J Endod, 2010, 36(4):630-635.
[6]Denotti G, Piga R, Montaldo C, et al. In vitro evaluation of Enterococcus faecalis adhesion on various endodontic medicaments[J]. Open Dent J, 2009, 3:120-124.
[7]Ozdemir HO, Buzoglu HD, Calt S, et al. Effect of ethylene diaminetetraacetic acid and sodium hypochlorite irrigation on Enterococcus faecalis bio fi lm colonization in young and old human root canal dentin: in vitro study[J]. J Endod, 2010,36(5):842-846.
[8]Estrela C, Sydney GB, Figueiredo JA, et al. A model system to study antimicrobial strategies in endodontic bio fi lms[J].J Appl Oral Sci, 2009, 17(2):87-91.
[9]Arias-Moliz MT, Ferrer-Luque CM, Espigares-García M,et al. Enterococcus faecalis biofilms eradication by root canal irrigants[J]. J Endod, 2009, 35(5):711-714.
[10]Soares JA, Roque de Carvalho MA, Cunha Santos SM, et al. Effectiveness of chemomechanical preparation with alternating use of sodium hypochlorite and EDTA in eliminating intracanal Enterococcus faecalis bio fi lm[J]. J Endod,2010, 36(5):894-898.
[11]Yang SE, Cha JH, Kim ES, et al. Effect of smear layer and chlorhexidine treatment on the adhesion of Enterococcus faecalis to bovine dentin[J]. J Endod, 2006, 32(7):663-667.
[12]樊明文. 牙体牙髓病学[M]. 北京: 人民卫生出版社, 2012:343-345.
[13]Sunde PT, Olsen I, Debelian GJ, et al. Microbiota of periapical lesions refractory to endodontic therapy[J]. J Endod,2002, 28(4):304-310.
[14]Pinheiro ET, Gomes BP, Drucker DB, et al. Antimicrobial susceptibility of Enterococcus faecalis isolated from canals of root fi lled teeth with periapical lesions[J]. Int Endod J,2004, 37(11):756-763.
[15]郑建博, 王丽娜, 宋其义, 等. 再治疗根管粪肠球菌生物膜形成与临床表现相关性分析[J]. 华西口腔医学杂志,2012, 30(1):65-67.
[16]George S, Basrani B, Kishen A. Possibilities of gutta-perchacentered infection in endodontically treated teeth: an in vitro study[J]. J Endod, 2010, 36(7):1241-1244.
[17]郭惠杰, 岳林. 粪肠球菌在根管内定植模式的体外研究[J]. 北京大学学报: 医学版, 2009, 41(6):699-701.
[18]Bhuva B, Patel S, Wilson R, et al. The effectiveness of passive ultrasonic irrigation on intraradicular Enterococcus faecalis bio fi lms in extracted single-rooted human teeth[J].Int Endod J, 2010, 43(3):241-250.
[19]Kania RE, Lamers GE, van de Laar N, et al. Bio fi lms on tracheoesophageal voice prostheses: a confocal laser scanning microscopy demonstration of mixed bacterial and yeast biofi lms[J]. Biofouling, 2010, 26(5):519-526.
[20]Ordinola-Zapata R, Bramante CM, Graeff MS, et al. Depth and percentage of penetration of endodontic sealers into dentinal tubules after root canal obturation using a lateral compaction technique: a confocal laser scanning microscopy study[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2009, 108(3):450-457.
