胃癌患者血清抑癌基因启动子超甲基化测定的临床意义
2014-10-11朱立岳胡雷光翁丽贞上海市静安区中心医院复旦大学华山医院静安分院检验科200040
朱立岳,胡雷光,翁丽贞(上海市静安区中心医院/复旦大学华山医院静安分院检验科 200040)
胃癌是临床上较常见的恶性肿瘤之一,学者们一直致力于其发生、发展的研究。近些年来表观遗传学成为胃癌的热点研究领域,其研究致力于基因序列未发生变化,而表达水平改变的情况。其中基因启动子超甲基化是导致抑癌基因失活,表达下降的重要原因,最终导致癌症的发生,是表观遗传学重要的研究方向之一[1-2]。Ras相关区域家族基因1a(RASSFA1)基因、人类相关转录因子3(Runx3)基因、错配修复蛋白MutL同源物1(hmLH1)基因、多肿瘤抑制基因1(MTS1)也称P16基因、上皮E钙粘蛋白(E-Cadherin)基因、组织因子途径抑制物2(TFPI-2)基因启动子超甲基化与胃癌的关系相继被报道[3-11],这些研究发现胃癌组织中这6种基因的甲基化检出率较癌旁组织和正常组织高。说明这些基因启动子超甲基化与胃癌的发生、发展密切相关,是胃癌的重要抑癌基因,有可能成为胃癌诊断的分子标志物。以往研究在血清游离DNA中发现癌症相关的基因突变,证实了肿瘤细胞释放是血清游离DNA的主要来源之一[14]。如果能从胃癌患者血清中检测到抑癌基因启动子的超甲基化,将是一种无创的检测新方法,对胃癌的诊断及治疗具有重要意义。本文通过甲基化特异性聚合酶链反应(MSP)方法测定血清游离 DNA中 RASSF1A、RUNX3、hm-LH1、P16、E-Cadherin、TFPI-2基因启动子甲基化状态,分析血清中检出基因超甲基化与胃癌的关系,探讨其在胃癌诊断中的临床意义。
1 资料与方法
1.1 一般资料 随机选择本院2011~2013年进行胃镜检查的患者,32例为胃癌组,其中男18例,女14例,年龄37~75岁。29例作为萎缩性胃炎组,其中男13例,女16例,年龄34~74岁。随机选取同期胃镜检查排除浅表性胃炎的其他胃部疾患者30例为对照组,其中男15例,女15例,年龄33~73岁。所有研究对象均经病理诊断确诊,且排除其他部位肿瘤,未进行胃癌手术及放化疗。3组患者在性别、年龄等方面比较,差异无统计学意义(P>0.05),具有可比性。所有标本取材及测定数据的使用均经研究对象同意并签署知情同意书。
1.2 方法 取所有研究对象血液4mL,自然凝固后以相对离心力(RCF)1 000 ×g离心5min后分离血清,转移至冻存管中-70℃保存。
1.2.1 血清游离DNA抽提 使用微量样品基因组DNA提取试剂盒(天根生物科技有限公司,中国),提取400μL血清中的游离DNA。取得的DNA溶解于去离子双蒸馏水,置-20℃保存。
1.2.2 亚硫酸氢盐修饰DNA 使用紫外分光光度法测定血清游离DNA浓度,取500ng DNA使用EZ DNA Methylation-Gold Kit(ZYMO RESEARCH,USA),按试剂盒提供的说明书进行亚硫酸氢盐修饰和纯化。经此步骤获得的DNA序列被修饰,未甲基化的胞嘧啶(C)转变成尿嘧啶(U),甲基化的胞嘧啶(C)保持原样。修饰后DNA用15μL去离子双蒸馏水溶解,置-20℃保存备用。
1.2.3 MSP 按照修饰后的序列设计 RASSF1A、RUNX3、hmLH1、P16、E-Cadherin、TFPI-2基因甲基化引物,按照不被修饰的序列设计非甲基化引物。由上海生工生物工程技术服务有限公司合成引物,序列及PCR产物片段大小详见表1。PCR反应体系由预混合的日本TaKaRa公司生产的Taq Hot Start Version试剂盒提供。加入10nM甲基化上下游引物,2 μL经亚硫酸氢盐修饰后的DNA模板,总反应体积20μL。同时再取修饰后的DNA 2μL,同样的反应体系,加入10nM非甲基化上下游引物。反应均为94℃预变性5min;共扩增40个循环,变性94℃30s,退火温度详见表1,退火时间30s,延伸72℃30s;最后72℃延伸5min。每批测定均使用甲基化酶SssI修饰的和未被修饰的正常血清游离DNA作为阳性和阴性对照,用无菌双蒸水作为空白对照。最后取5μL PCR产物进行2%琼脂糖凝胶电泳,用凝胶成像系统分析结果。以甲基化特异性引物扩增出目的条带作为甲基化阳性的标志。将仅非甲基化特异性引物扩增出条带作为甲基化阴性的标志。PCR仪使用美国应用生物系统公司ABI 9700。

表1 甲基化及非甲基化引物序列、产物片段及退火温度
1.3 统计学处理 应用SAS8.02统计软件对数据进行分析,计数资料采用百分率表示,组间比较采用χ2检验;以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结 果
2.1 各组血清6种抑癌基因甲基化检测结果比较 血清RASSF1A、RUNX3、hmLH1、P16、E-Cadherin、TFPI-2基因启动子超甲基化在胃癌组阳性率分别为21.9%(7/32),40.6%(13/32),21.9% (7/32),34.4% (11/32),28.1% (9/32),28.1%(9/32);萎缩性胃炎组分别为3.5%(1/29),13.8%(4/29),0.0%(0/29),6.9%(2/29),3.5%(1/29),6.9%(2/29);对照组仅有1例检出RUNX3基因启动子甲基化阳性,阳性率为3.5%。6种基因启动子甲基化阳性率胃癌组均明显高于萎缩性胃炎组及对照组,差异有统计学意义(P<0.05)。
2.2 联合6个血清抑癌基因超甲基化对胃癌诊断的价值 血清 RASSF1A、RUNX3、hmLH1、P16、E-Cadherin、TFPI-2单个基因启动子超甲基化对胃癌的诊断灵敏度为21.9%~40.6%;特异性为91.5%~100.0%。胃癌组中至少检出1个基因甲基化阳性的有23例,联合血清中6种基因启动子甲基化可使诊断灵敏度提高,达到76.7%。联合6种基因启动子超甲基化特异性为86.4%,与RUNX3启动子超甲基化测定特异性比较,差异无统计学意义(P>0.05),与 RASSF1A、hm-LH1、P16、E-Cadherin、TFPI-2单个基因启动子超甲基化测定比较有所降低(P<0.05)。详见表2。
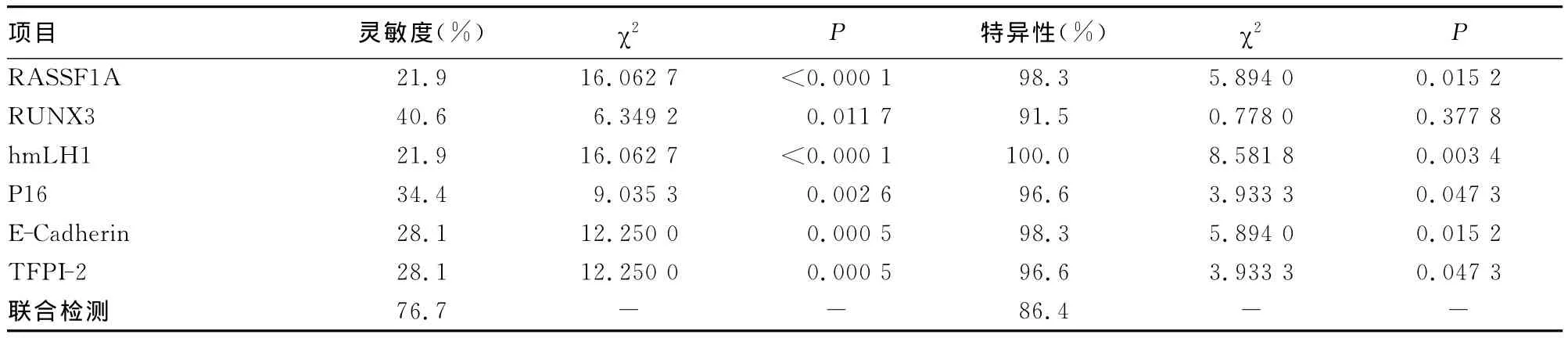
表2 联合检测与单独检测对胃癌诊断性能比较
3 讨 论
胃癌是我国常见的恶性肿瘤之一,发病率较高,严重危害着人类的健康和生命。虽然目前胃癌发生的机制仍不明确,但陆俊骏等[2]总结了表观遗传学的多项研究结果显示,胃癌的发生常伴随抑癌基因启动子的超甲基化,且早于胃癌病理学的改变。DNA甲基化是指在DNA甲基转移酶(DNMT)的催化下,将活性甲基从S-腺苷-2-甲硫氨酸转移到胞嘧啶5位碳原子上,形成5-甲基胞嘧啶的化学修饰过程。超甲基化在许多肿瘤的发生过程中是一个频发的早期事件,甲基化使抑癌基因失活、表达下降,在肿瘤的发生、发展中起重要作用[12]。目前认为抑癌基因启动子的超甲基化是除缺失、突变等DNA序列发生变化以外导致基因功能发生变化的重要原因[2]。
国内外学者汇总以往研究,总结了包括本实验研究的6个基因等数十个基因的超甲基化与胃癌有关,在胃癌组织中的阳性率较高,对胃癌的发生和演化过程意义重大[2,11,13]。本实验研究的RASSF1A基因有多个结构域,被认为是一种潜在的Ras癌蛋白效应分子,能与活化的Ras结合,通过调节凋亡及细胞周期信号通路作用,具有抑制细胞生长、促进细胞凋亡和衰老的作用[4]。RUNX3基因通过调节转化生长因子β(TGF-β)的生物活性,参与细胞分化、周期调控、凋亡和阻止细胞向恶性转化[5]。hmLH1基因作为DNA错配修复的重要基因,其表达下降导致错配修复缺陷,产生DNA微卫星参与癌症的发生[6]。p16基因在细胞增殖中起到负反馈调节的作用,其表达下降可使细胞无限制地过度增殖,使G1期未充分发育的细胞提前进入S期,导致癌症的发生[11]。E-Cadherin基因对维持细胞形态和调节细胞黏附具有重要作用,通过限制肿瘤细胞的侵袭行为来抑制肿瘤转移[8]。TFPI-2基因能抑制肿瘤细胞分泌的多种丝氨酸蛋白酶,从而抑制细胞外基质的降解,具有抗肿瘤和抑制肿瘤侵袭转移等生物学功能[9]。以上6种抑癌基因与胃癌的关系相继被报道,这些基因启动子超甲基化多见于胃癌组织,引起基因表达下降,进而影响肿瘤发生、发展[4-11]。
肿瘤相关的突变基因通过肿瘤细胞凋亡释放或肿瘤细胞直接入血的方式,被释放到外周血中,因此能从血清中能检测到肿瘤相关的特异性DNA[14]。较多学者采用 MSP方法检测超甲基化,其具有较高灵敏度,是一种简便有效的方法[15]。本实验结果显示,能通过MSP方法测定胃癌患者血清中抑癌基因启动子的超甲基化。在胃癌组血清中检出RASSF1A、RUNX3、hmLH1、P16、E-Cadherin、TFPI-2基因启动子超甲基化的阳性率分别为21.9%,40.6%,21.9%,34.4%,28.1%,28.1%,明显高于萎缩性胃炎组和对照组中的检出率,差异有统计学意义(P<0.05)。6种基因启动子甲基化检测在萎缩性胃炎的阳性率很低,与对照组相比,差异无统计学意义(P>0.05)。而以往的研究显示,抑癌基因甲基化从正常、萎缩性胃炎、胃癌的发展逐渐增加,是胃组织发生癌变前的早期事件[16]。但萎缩性胃炎患者血清中的检出率较低,推测这种现象可能与血清超甲基化的抑癌基因量较少有关。而肿瘤细胞的凋亡速度比较快及肿瘤细胞随血液转移进入血循环,导致释放到循环血液中的DNA量较多。推测血清中抑癌基因甲基化的测定,受到抑癌基因超甲基化的发生和组织细胞释放DNA进入血循环的量的影响。陆俊骏等[2]认为晚期肿瘤释放到循环血液中的DNA更多,且与肿瘤转移相关,说明血清抑癌基因超甲基化在肿瘤转移和病情监测方面的应用前景不容忽视。
本实验检测的血清6种抑癌基因超甲基化在胃癌组中的阳性率为21.9%~40.6%,单独1个基因超甲基化对胃癌诊断的灵敏度不高。陆俊骏等[2]也认为胃癌及其癌前病变存在多个基因的变化,单个基因的改变只存在于一部分肿瘤中,这与本实验的结果相符。但有76.7%的胃癌组患者至少检出1个抑癌基因启动子甲基化,多个基因超甲基化联合检测明显提高了对胃癌诊断的灵敏度。联合6项血清抑癌基因超甲基化诊断的特异性降为86.4%,说明6项基因启动子超甲基化联合检测更具使用价值,是一种无创的,有效的肿瘤筛选新方法。
目前通过5-氮胞苷(5-Aza-CdR)等去甲基化药物恢复抑癌基因的甲基化状态,恢复抑癌基因功能越来越得到临床重视[17]。Yamashita等[18]的研究筛选启动子超甲基化的胃癌细胞株,通过5-Aza-CdR处理后,DNA的甲基化均得到逆转,抑癌基因重新表达。但5-Aza-CdR不良反应大,临床应用应谨慎。血清抑癌基因的测定,能为选择靶向药物,监测药物疗效提供新的依据,在胃癌个性化治疗和疗效监测方面意义重大。
综上所述,通过MSP能从胃癌患者血清中检测到RASSF1A、RUNX3、hmLH1、P16、E-Cadherin、TFPI-2基因启动子超甲基化,阳性率高于萎缩性胃炎患者及健康对照者。6个基因启动子超甲基化联合测定较单独测定灵敏度更高,可作为筛选肿瘤的分子标志物进行胃癌早期诊断。在甲基化药物疗效预测和监测方面也具有很大的应用前景。为胃癌的诊断、治疗以及预后判断提供了新的方法或依据。
[1]张丽丽,吴建新.DNA甲基化--肿瘤产生的一种表观遗传学机制[J].遗传,2006,28(7):880-885.
[2]陆俊骏,钱烨,连强.胃癌遗传学及表遗传学研究进展[J].中国医药导报,2013,10(19):43-46.
[3]Sato F,Meltzer SJ.CpG island hypermethylation in progression of esophageal and gastric cancer[J].Cancer,2006,106(3):483-493.
[4]Wang YC,Yu ZH,Liu C,et al.Detection of RASSF1A promoter hypermethylation in serum from gastric and colorectal adenocarcinoma patients[J].World J Gastroenterol,2008,14(19):3074-3080.
[5]赵丹,郑威强,张万里.外周血RUNX3基因甲基化在胃癌中的临床价值[J].检验医学与临床,2013,10(18):2451-2452,2453.
[6]吴安城,刘希双,杨堃.错配修复基因hMLH1甲基化与胃癌的关系[J].世界华人消化杂志,2008,16(13):1407-1411.
[7]Tamura G.Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer[J].World J Gastroenterol,2006,12(2):192-198.
[8]姜蕊,赵春明,宋美娟,等.胃癌组织中E-cadherin基因启动子异常甲基化状态观察[J].山东医药,2011,51(50):4-6.
[9]Takada H,Wakabayashi N,Dohi O,et al.Tissue factor pathway inhibitor 2(TFPI2)is frequently silenced by aberrant promoter hypermethylation in gastric cancer[J].Cancer Genet Cytogenet,2010,197(1):16-24.
[10]吕萍,凌志强,余江流,等.胃癌组织中p16基因甲基化状态及临床意义[J].肿瘤学杂志,2013,19(5):332-335.
[11]赵成海,张宁,卜献民,等.胃癌多基因甲基化状态分析[J].世界华人消化杂志,2006,14(10):1004-1007.
[12]朱正纲,傅国辉,刘炳亚,等.分子标志物在胃癌发病机制及转化医学研究中的应用[J].上海交通大学学报:医学版,2012,32(9):1185-1197.
[13]Suzuki H,Tokino T,Shinomura Y,et al.DNA methylation and cancer pathways in gastrointestinal tumors[J].2008,9:1917-1928.
[14]马晓杰,李景鹏,赵勇.血浆中游离核酸:分子诊断的新靶点[J].生命的化学,2006,26(2):147-149.
[15]范保星.DNA甲基化检测方法[J].国外医学.遗传学分册,2002,25(2):99-101.
[16]Qu YP,Dang SW,Hou P.Gene methylation in gastric cancer[J].Clinica Chimica Acta,2013,42(4):53-65.
[17]周建生,杨生生,缪明永,等.DNA甲基化/去甲基化与癌症[J].生命的化学,2013(4):381-388.
[18]Yamashita S,Tsujino Y,Moriguchi K,et al.Chemical genomic screening for methylation-silenced genes in gastric cancer cell lines using 5-aza-2'-deoxycytidine treatment and oligonucleotide microarray[J].Cancer Sci,2006,97(1):64-71.
