老年2型糖尿病合并脑梗死患者血清代谢指标分析
2014-10-11田慧军康玲伶中国人民解放军第09医院神经内科北京0009承德医学院附属医院神经内科河北承德067000中山大学附属第一医院神经内科广州50080
田慧军,康玲伶,余 剑(.中国人民解放军第09医院神经内科,北京 0009 ;.承德医学院附属医院神经内科,河北承德 067000 ;.中山大学附属第一医院神经内科,广州 50080)
老年2型糖尿病(T2DM)患者合并脑梗死发病率较高,且发病风险与尿酸(UA)、脂质代谢紊乱密切相关。胆红素是一种天然的内源性抗氧化剂,具有消除氧自由基、抑制脂质过氧化、抗缺血/再灌注损伤和预防动脉粥样硬化等作用,因此近年来受到极大的关注。本研究分析了老年T2DM合并脑梗死患者血清胆红素、UA及血脂水平的变化,旨在探讨其在疾病发生、发展中的作用及临床应用价值,先将研究结果报道如下。
1 资料与方法
1.1 一般资料 将2008年1月至2012年6月确诊的52例T2DM合并脑梗死患者纳入T2DM合并脑梗死组,男34例、女18例,平均年龄(64.7±4.3)岁。同期确诊的22例单纯脑梗死患者纳入单纯脑梗死组,男16例、女6例,平均年龄(66.2±4.5)岁。同期确诊的无脑梗死T2DM患者28例纳入单纯T2DM组,男18例、女10例,平均年龄(66.7±3.9)岁。所有纳入患者年龄均大于60岁。T2DM诊断标准参照世界卫生组织1999年颁布的糖尿病诊断标准。脑梗死诊断标准参照1995年中华医学会第四次全国脑血管病学术会议修订的脑梗死诊断标准,并在患者发病3d内经CT扫描所证实。所有患者在纳入本研究前及在本研究进行过程当中,无明显肾脏疾病、未服用利尿药等影响UA代谢的药物,排除合并严重高血压及心脏、肝脏等主要脏器实质性或功能性病变的患者。患者性别、年龄、糖尿病病程、病情等基本资料组间比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 受试对象晚餐后禁食,停用相关药物(如胰岛素、降糖药、利尿剂、钙离子拮抗剂等),于晚餐后10~14h,即次日清晨采集静脉血,常规方法分离血清标本,以重氮法检测总胆红素(TBIL)与直接胆红素(DBIL)浓度,间接胆红素(NDBIL)浓度由TBIL浓度减DBIL浓度计算获得;采用酶法检测尿酸(UA)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平。
1.3 统计学处理 采用SPSS13.0软件进行数据处理和统计学分析。计量资料以表示,组间比较采用t检验。P<0.05为比较差异有统计学意义。
2 结 果
2.1 UA与胆红素代谢指标比较 与单纯脑梗死组和单纯T2DM组相比,T2DM合并脑梗死组血清TBIL、NDBIL水平明显降低,UA水平明显升高,比较差异有统计学意义(P<0.05);单纯脑梗死组与单纯T2DM组TBIL、NDBIL、UA水平比较差异无统计学意义(P>0.05)。见表1。
2.2 血脂代谢指标比较 与单纯脑梗死组和单纯T2DM组相比,T2DM合并脑梗死组TC、TG、LDL-C水平明显升高,HDL-C水平明显降低(P<0.05);单纯脑梗死组与单纯T2DM组上述血脂代谢指标水平比较差异无统计学意义(P>0.05)。见表2。
表1 UA与胆红素代谢指标比较()
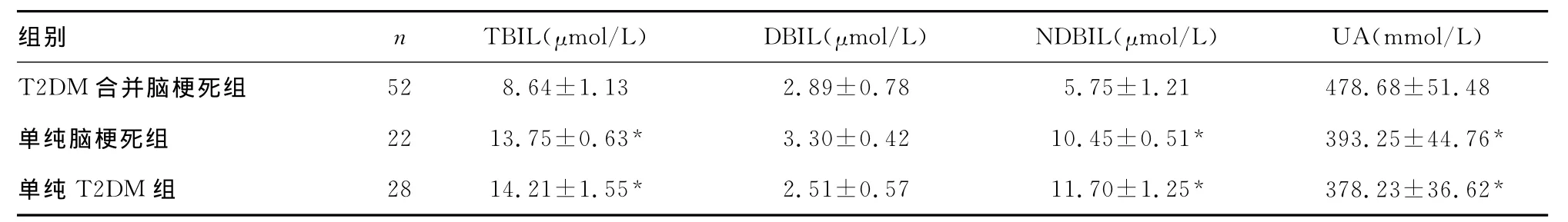
表1 UA与胆红素代谢指标比较()
注:T2DM合并脑梗死组比较,*P<0.05。
组别 n TBIL(μmol/L) DBIL(μmol/L) NDBIL(μmol/L) UA(mmol/L)T2DM 合并脑梗死组 52 8.64±1.13 2.89±0.78 5.75±1.21 478.68±51.48单纯脑梗死组 22 13.75±0.63* 3.30±0.42 10.45±0.51* 393.25±44.76*单纯T2DM组 28 14.21±1.55* 2.51±0.57 11.70±1.25* 378.23±36.62*
表2 血脂代谢指标比较(,mmol/L)
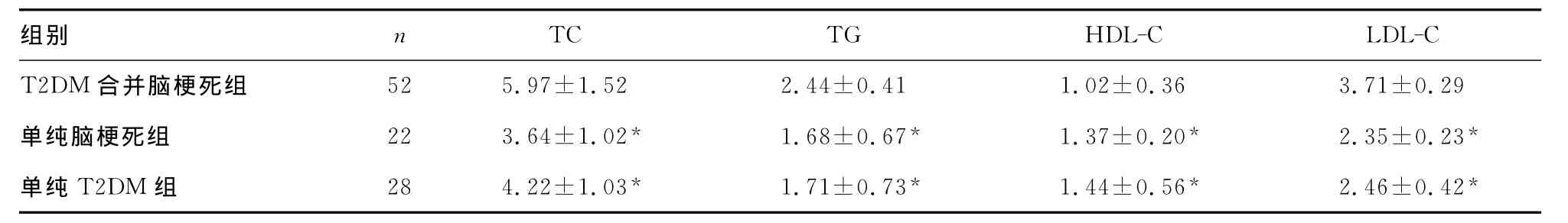
表2 血脂代谢指标比较(,mmol/L)
注:T2DM合并脑梗死组比较,*P<0.05。
TC TG HDL-C LDL-C T2DM合并脑梗死组组别 n 52 5.97±1.52 2.44±0.41 1.02±0.36 3.71±0.29单纯脑梗死组 22 3.64±1.02* 1.68±0.67* 1.37±0.20* 2.35±0.23*单纯T2DM组 28 4.22±1.03* 1.71±0.73* 1.44±0.56* 2.46±0.42*
3 讨 论
T2DM患者极易继发脑梗死,可能与T2DM导致脂代谢紊乱,进而诱发动脉粥样硬化,以及血液黏度增加等因素有关。动脉粥样硬化是脑梗死的重要病理基础。有研究发现,胆红素具有抗动脉粥样硬化的作用[1]。本研究结果显示,T2DM合并脑梗死患者血清TBIL和NDBIL水平明显低于单纯脑梗死患者和单纯T2DM患者(P<0.05),说明血清胆红素水平的降低可能与T2DM所致动脉粥样硬化的发生、发展有一定的相关性。由于T2DM患者血清胆红素水平降低,抗氧化活性减弱,氧化修饰低密度脂蛋白(ox-LDL)生成增多,加重血管内皮细胞损伤,加速动脉粥样硬化和血栓形成的进程,进而导致大血管及微血管病变。因此,可以推测血清胆红素水平降低可能是T2DM合并血管病变的独立危险因素之一。前瞻性研究结果显示,血清胆红素水平降低提示动脉粥样硬化发病风险升高,10μmol/L可能是判断动脉粥样硬化、心脑血管疾病发病风险高低的临界值[2]。
UA是嘌呤类物质在人体内代谢的终末产物,经肾脏排出体外。高尿酸血症与糖尿病、高脂血症、高血压等有可能导致动脉粥样硬化的疾病关系密切,但其间涉及的机制尚未完全明确[3]。本研究发现,T2DM合并脑梗死患者血清UA水平明显高于单纯脑梗死患者和单纯T2DM患者(P<0.05),表明血清UA水平增高与T2DM患者继发脑梗死存在一定程度的相关性。国外有研究显示,脑梗死患者外周血UA水平明显增高,升高程度与胰岛素抵抗、急性脑血管病变的发病率和病死率存在一定程度的相关性,认为高尿酸血症是T2DM患者继发脑梗死的重要危险因素[4-5]。UA水平升高可促进LDL-C氧化和脂质的过氧化,引起血管炎性反应,损伤血管内膜,促进血小板黏附和聚集,导致血栓形成[6]。美国第3次健康与营养状况调查(NHANESⅢ)结果表明,外周血 UA浓度超过416.5 μmol/L可能是脑梗死的独立危险因素[7]。降低外周血UA水平可能是预防和减少T2DM患者继发脑梗死的有效措施之一,但UA与动脉粥样硬化之间的相关性及二者间的具体影响及作用机制,仍需前瞻性研究的证实。
高血脂也可导致动脉硬化的发生,说明同时合并高尿酸血症、高血脂的T2DM患者更易继发动脉粥样硬化,从而导致心脑血管并发症发病风险增加[8]。60%的T2DM患者合并脂质代谢紊乱,而脂质代谢紊乱与脑血管病变关系密切[9]。本研究结果显示,T2DM合并脑梗死患者血清TC、TG、LDL-C水平均高于单纯T2DM患者和单纯脑梗死患者(P<0.05),提示血脂水平异常可能与T2DM患者继发血管疾病密切相关。尤其是TG水平升高,可促进LDL-C氧化生成ox-LDL,损伤血管内皮细胞,加重血管壁局部的炎性反应,降低粥样斑块的稳定。Law等[10]研究发现,外周血LDL-C水平下降1.0mmol/L,脑梗死发病率下降10%,如LDL-C水平下降1.8mmol/L,脑梗死发病率下降17%。与单纯T2DM和单纯脑梗死患者相比,T2DM合并脑梗死患者血清 HDL-C水平明显降低(P<0.05),提示HDL-C水平降低可能也是T2DM患者继发脑梗死的重要危险因素。TG水平增高,造成HDL-C水平下降,增加脂质在动脉管壁的沉积,加速动脉粥样硬化的形成。Sacco等[11]的研究发现,外周血HDL-C水平降低是老年人发生脑梗死的危险因子,HDL-C水平升高则可降低脑梗死的发病风险。因此,LDL-C、HDL-C均为用于判断T2DM患者是否存在血管病变发病风险的预测指标。
综上所述,血清胆红素水平降低、高尿酸血症及血脂代谢异常是T2DM合并血管病变的危险因素,与脑梗死的发生、发展有一定相关性。监测上述指标有助于正确判断T2DM患者的预后,预防脑梗死的发生。
[1]Erdogan D,Gullu H,Yildirim E,et al.Low serum bilirubin levels are independently and inversely related to impaired flow-mediated vasodilation and increased carotidintima-media thickness in both men and women[J].Atherosclerosis,2006,184(2):431-437.
[2]Schwertner HA.Bilirubin concentration,UGT1A1*28polymorphism,and coronary artery disease[J].Clinic Chemistry,2003,49(7):1039-1040.
[3]Carnethon MR,Fortmann SP,Palaniappan L,et al.Risk factors for progression to incident hyperinsulinemia:the atherosclerosis risk in communities study,1987-1998[J].Am J Epidemiol,2003,158(11):1058-1067.
[4]Sanchez-Moreno C,Dashe JF,Scott T,et al.Decreased levels of plasma vitamin C and increased concentrations of inflammatory and oxidative stress markers after stroke[J].Stroke,2004,35(1):163-168.
[5]Gariballa SE,Hutchin TP,Sinclair AJ,et al.Antioxidant capacity after acute ischaemic stroke[J].QJM,2002,95(10):685-690.
[6]Hammarsten J,Hogstedt B.Clinical,haemodynamic,anthropometric metabolic and insulin profile of men with high-stage and high-grade clinical prostate cancer[J].Blood Press,2004,13(1):47-55.
[7]Alexander CM,Landsman PB,Teutsch SM,et al.NCEP-defined metabolic syndrome,diabetes,and prevalence of coronary heart disease among NHANESⅢparticipants age 50years and older[J].Diabetes,2003,52(5):1210-1214.
[8]Engstrom G,Lind P,Hedblad B,et al.Effects of cholesterol and inflammation sensitive plasma proteins on incidence of myocardial infarction and stroke in men[J].Circulation,2002,105(22):2632-2637.
[9]Nakaya N,Kita T,Mabuchi H,et al.Large-scale cohort study on the relationship between serum lipid concentrations and risk of cerebrovascula disease under low-dose simvastatin in Japanese patients with hypercholesterolemia:sub-analysis of the Japan Lipid Intervention Trial(JLIT)[J].Circ J,2005,69(9):1016-1021.
[10]Law R,Wald NJ,Rudnicka AR.Quantifying effect of statins on low density lipoprotein cholesterol,ischaemic heart disease,and stroke:systematic review and meta-analysis[J].BMJ,2003,326(7404):1423-1430.
[11]Sacco RL,Benson RT,Kargman DE,et al.High-density lipoprotein cholesterol and ischemic stroke in the elderly:the Northern Manhattan Stroke Study[J].JAMA,2001,285(21):2729-2735.
