水溶性手性Salen-Mn(Ⅲ)的合成及其催化烯烃环氧化反应性能
2014-10-10马文婵杨瑞云张月成赵继全
马文婵,杨瑞云,张月成,赵继全
(河北工业大学 化工学院,天津 300130)
水溶性手性Salen-Mn(Ⅲ)的合成及其催化烯烃环氧化反应性能
马文婵,杨瑞云,张月成,赵继全
(河北工业大学 化工学院,天津 300130)
以2-叔丁基苯酚为原料,经甲酰化反应、氯甲基化反应以及N-甲基咪唑的季铵化反应制得引入咪唑盐基的水杨醛衍生物,将其分别与(1S,2S)-二苯基乙二胺和(1S,2S)-环己二胺缩合,得到相应的手性Salen配体,再与过渡金属Mn(Ⅲ)配位得到两种水溶性手性Salen-Mn(Ⅲ)配合物。采用1H NMR、FTIR和元素分析等手段对中间体及配合物进行了表征。以NaClO为氧化剂,考察了水溶性手性Salen-Mn(Ⅲ)配合物对苯乙烯、1,2-二氢化萘、α-甲基苯乙烯和顺式-β-甲基苯乙烯等非官能化烯烃不对称环氧化反应的催化性能。实验结果表明,水溶性手性Salen-Mn(Ⅲ)配合物比经典手性Salen-Mn(Ⅲ)配合物具有更高的活性和环氧化物选择性,但对映体选择性(ee值)有所降低。以苯乙烯的环氧化反应为例,相同反应时间内水溶性手性Salen-Mn(Ⅲ)配合物的活性和环氧化物选择性的增加值均接近10%,但ee值的下降值大于20%。
手性Salen-Mn(Ⅲ)配合物催化剂;水溶性;不对称环氧化反应;非官能化烯烃;次氯酸钠
手性环氧化物是非常重要的有机合成中间体,通过选择性开环使其在精细化学品以及药物合成方面具有广泛应用。获得手性环氧化物的最有效手段是烯烃的不对称环氧化反应。以手性金属配合物为催化剂的烯烃不对称环氧化反应可由相对较少的手性源得到较多的手性化合物,大幅降低了手性环氧化物的成本,因而受到广泛关注[1-6]。在众多的催化体系中,手性Salen-Mn(Ⅲ)配合物[7-8]是非官能化烯烃不对称环氧化反应最有效的催化剂。经典的手性Salen-Mn(Ⅲ)配合物容易制备,对多种非官能化烯烃的不对称环氧化反应显示出很高的活性和对映选择性,但对部分烯烃的不对称环氧化反应则活性较低,因此导致其在反应体系中停留时间过长发生二聚而失活[9]。由于此类不对称环氧化反应通常在两相体系中进行,若增加催化剂的水溶性,使其兼具相转移催化剂的功能,有望在一定程度上克服催化剂活性较低的问题。为此,人们通过在手性配体的骨架中引入叔胺或季铵盐以提高手性Salen-Mn(Ⅲ)配合物的水溶性[10-15]。这些配合物比非水溶性的经典手性Salen-Mn(Ⅲ)配合物在两相体系中显示出更高的活性。
本工作以2-叔丁基苯酚为原料,经甲酰化反应、氯甲基化反应以及N-甲基咪唑的季铵化反应制得引入咪唑盐基的水杨醛衍生物,再与两种手性1,2-二胺缩合得到相应的手性Salen配体,该配体与Mn(Ⅲ)配位得到两种含咪唑盐基的水溶性手性Salen-Mn(Ⅲ)配合物。以NaClO为氧化剂,考察了所合成的水溶性手性Salen-Mn(Ⅲ)配合物对苯乙烯等4种非官能化烯烃不对称环氧化反应的催化性能。
1 实验部分
1.1 试剂与仪器
2-叔丁基苯酚(纯度99%)、1,2-二氢化萘(纯度98%):Aldrich公司;环己二胺(纯度90%)、顺式-β-甲基苯乙烯(纯度98%)、α-甲基苯乙烯(纯度99%):Acros公司;(1S,2S)-二苯基乙二胺:纯度98%,成都丽凯手性技术有限公司;(1S,2S)-环己二胺:由环己二胺拆分[16]而得;苯乙烯:分析纯,天津市化学试剂一厂;N-甲基咪唑:纯度99%,拜耳上海颜料有限公司;乙酸锰、无水氯化锂:分析纯,天津市化学试剂三厂;轴向配体吡啶氮氧化物(PyNO):参考文献[17]的方法自制;其他试剂均为分析纯;溶剂在使用前均经干燥除水、蒸馏精制。
1H NMR表征在Brucker公司AC-P 400型核磁共振仪上进行,氘代二甲基亚砜或CDCl3为溶剂;FTIR表征在Brucker公司Vector 22型傅里叶变换红外光谱仪上进行,直接涂膜或KBr压片;采用Elementar公司 Vario El型元素分析仪对各化合物中碳、氢、氮的含量进行分析;采用瓦里安公司Cary 300型紫外-可见分光光度计(200~800 nm)测定配合物的UV-Vis光谱。
1.2 烯烃的不对称环氧化反应
将13%(w)NaClO水溶液与0.05 mol/L的磷酸氢二钠水溶液以体积比2∶5配成缓冲溶液,用1 mol/L的HCl溶液(或1 mol/L的NaOH溶液)调节pH至11.30,冷藏备用。取一定量的催化剂、底物和轴向配体PyNO溶于二氯甲烷中,降至设定温度,再加入上述缓冲溶液作为氧化剂开始反应。
采用山东鲁南瑞虹化工仪器有限公司SP-6800A型气相色谱仪对反应进程进行监测并对反应液组成进行分析,手性毛细管色谱柱(Cyclodex-β,30 m×0.25 mm×0.25 µm),按面积归一化法求出底物的转化率、目的产物的选择性及对映体选择性(ee值)。
1.3 配合物的合成与表征
1.3.1 水溶性手性Salen-Mn(Ⅲ)配合物的合成路线
水溶性手性Salen-Mn(Ⅲ)配合物的合成路线如图1。
1.3.2 中间体的合成与表征
3-叔丁基-2-羟基苯甲醛(Ⅱ)按文献[18]报道的方法合成。产物为淡黄色液体,收率40%。1H NMR(400 MHz,CDCl3,三甲基硅烷(TMS))表征结果(化学位移δ):11.79(s,1H;OH),9.88(s,1H;CHO),7.52(dd,J=7.6 Hz,J=1.2 Hz,1H;CH),7.39(dd,J=7.6 Hz,J=0.8 Hz,1 H;CH),6.93(t,J=7.6 Hz,1H;CH),1.42(s,9H;(CH3)3)。
3-叔丁基-5-氯甲基-2-羟基苯甲醛(Ⅲ)按文献[19]报道的的方法合成。产物为浅黄色晶体,收率88%,熔点61~63 ℃。1H NMR(400 MHz,氘代二甲基亚砜,TMS)表征结果(δ):11.90(s,1H;OH),9.98(s,1H;CHO),7.74(d,J=2 Hz,1H;CH),7.63(d,J=2.4 Hz,1H;CH),4.81(s,2H;CH2),1.39(s,9H;(CH3)3)。
3-叔丁基-5-(3'-(N-甲基咪唑))-2-羟基苯甲醛盐酸盐(Ⅳ)的合成:氮气保护下,于100 mL三口瓶中加入1.00 g(4.4 mmol)中间体Ⅲ和40 mL无水甲苯,磁力搅拌下,缓慢滴入含0.36 g(4.4 mmol)N-甲基咪唑的无水甲苯溶液,室温下搅拌4 h;氮气保护下压滤出溶剂,用无水甲苯洗涤5次,抽滤,得白色粉末状产物1.0 g,极易吸潮,收率74%。1H NMR(CDCl3)表征结果(δ):1.41(s,9H),4.01(s,3H),5.61(s,2H),7.18(d,J=5.13 Hz,2H),7.56(s,1H),7.85(s,1H),9.95(s,1H),11.11(s,1H),11.95(s,1H)。元素分析结果(w):计算值C 62.38%,H 6.96%,N 8.96%;实验值 C 62.23%,H 6.85%,N 9.07%。
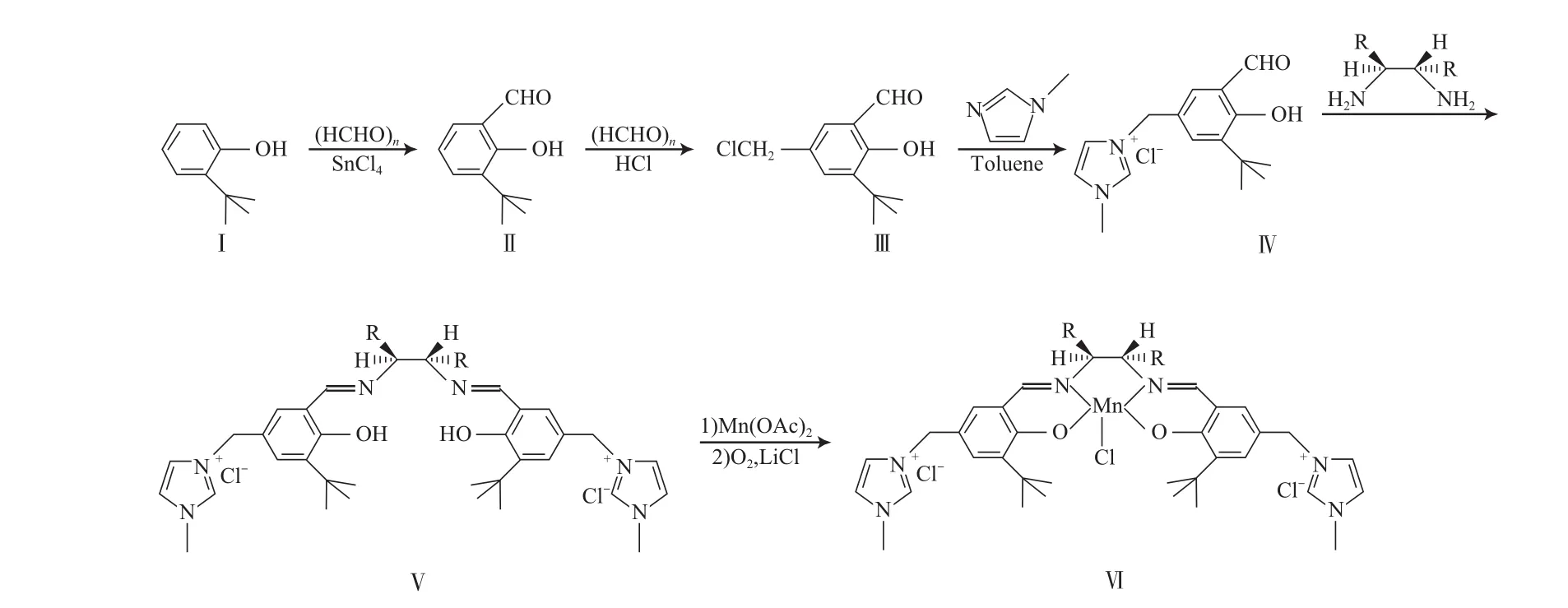
图1 水溶性手性Salen-Mn(Ⅲ)配合物的合成路线Fig.1 Synthesis route of water soluble chiral Salen-Mn(Ⅲ) complexes.
1.3.3 手性Salen配体的合成
配体Ⅴa的合成:氮气保护下,于100 mL三口瓶中加入1.00 g(3.2 mmol)中间体Ⅳ和30 mL无水乙醇,磁力搅拌下,缓慢滴入含0.14 g(1.2 mmol)(1S,2S)-环己二胺的无水乙醇溶液,室温下搅拌0.5 h,加热回流5 h,旋蒸除去溶剂,柱分离后得到亮黄色固体产物,收率61%。1H NMR(CDCl3)表征结果(δ):1.35(s,10H),1.46~1.92(m,3H),3.36(m,1H),4.04(s,3H),5.31(s,2H),6.94(s,1H),7.15(s,1H),7.32(s,1H),7.56(s,1H),8.25(s,1H),10.71(s,1H),14.25(s,1H)。元素分析结果(w):计算值C 65.26%,H 7.68%,N 12.06%;实验值 C 65.60%,H 7.53%,N 12.08%。
配体Ⅴb的合成:配体Ⅴb由中间体Ⅳ与(1S,2S)-二苯基乙二胺按上述方法合成。产物为亮黄色固体,收率57%。1H NMR(CDCl3)表征结果(δ):1.37(s,9H),4.03(s,3H),4.72(s,1H),5.36(d,J=14.27 Hz,1H),5.49(d,J=14.28 Hz,1H),7.16(s,1H),7.20(m,6H),7.35(d,J=2.01 Hz,1H),7.60(s,1H),8.36(s,1H),10.76(s,1H),14.12(s,1H)。元素分析结果(w):计算值C 69.12%,H 6.48%,N 10.80%;实验值 C 69.60%,H 6.86%,N 10.59%。
1.3.4 水溶性手性Salen-Mn(Ⅲ)配合物的合成
配合物Ⅵa的合成:氮气保护下,于100 mL三口瓶中加入0.24 g(0.34 mmol)配体Ⅴa,溶于30 mL无水乙醇后,加入0.17 g(0.69 mmol) Mn(OAc)2·4H2O;回流4 h后降至室温,加入0.043 g(1.02 mmol)无水氯化锂,在空气中搅拌3 h,蒸除溶剂,柱分离后得到棕色粉末产物,收率97%。FTIR(KBr)表征结果(波数/cm-1):3 399(s),2 948(m),1 618(s),1 544(w),1 432(m),1 267(w),571(m),482(w)。元素分析结果(w):计算值C 58.73%,H 6.12%,N 10.62%;实验值 C 58.20%,H 6.43%,N 10.72%。
配合物Ⅵb的合成:将配体换成Ⅴb,按上述方法合成配合物Ⅵb,产物为棕色粉末,收率99%。FTIR(KBr)表征结果(波数/cm-1):3 408(s),2 948(m),1 611(s),1 543(w),1 426(m),1 269(w),575(m),488(w)。元素分析结果(w):计算值C 62.88%,H 5.74%,N 9.40%;实验值C 62.62%,H 5.94%,N 9.53%。
2 结果与讨论
2.1 配合物的表征结果
经典的手性Salen-Mn(Ⅲ)配合物的结构如图2。与图2中的结构式相比,水溶性手性Salen-Mn(Ⅲ)配合物在水杨醛的C5位上引入了咪唑盐基(如图1)。
中间体Ⅱ和Ⅲ的1H NMR表征结果与文献[18-19]报道的结果一致。中间体Ⅳ的1H NMR表征结果与预期结构相符,元素分析的实验值与计算值一致。配体Ⅴa和Ⅴb的1H NMR表征结果与预期结构一致,元素分析的实验值与计算值相符,证明配体的合成成功。配合物Ⅵa和Ⅵb的FTIR谱图与预期结构一致,元素分析的实验值与计算值相符。
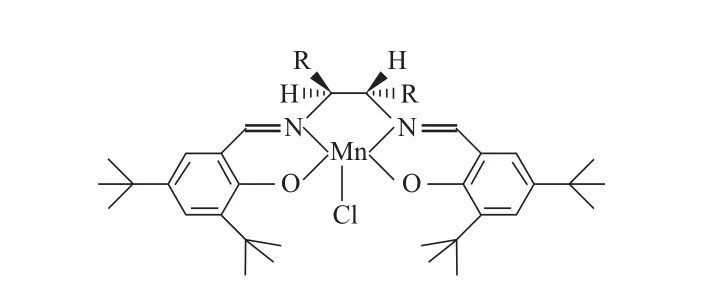
图2 经典的手性Salen-Mn(Ⅲ)配合物的结构Fig.2 Structure of a typical Salen-Mn(Ⅲ) complex.
配体Ⅴ和配合物Ⅵ的FTIR谱图见图3。由图3可看出,配体在3 412~3 421 cm-1处的强吸收峰为酚羟基的伸缩振动峰,1 627 cm-1附近的强吸收峰为键的伸缩振动峰,1 598~1 600 cm-1处的吸收峰为芳环的骨架振动峰,1 444~1 446 cm-1处的吸收峰为咪唑环上键的伸缩振动峰,1 269~1 274 cm-1处的强吸收峰为芳环上酚氧基C—O键的伸缩振动峰。形成配合物后,各吸收峰的位置均发生了相应的变化。与配体相比,配合物的键的伸缩振动峰均出现明显的红移,这是由于N原子参与配位减弱了键的强度,使其振动峰发生了红移[20];酚羟基的氧原子参加配位,电子进入Mn原子的d轨道,使得C—O键的强度减弱,也使其振动峰发生红移。与配体相比,配合物在571~575 cm-1和482~488 cm-1处出现新的吸收峰,分别归属于配合物分子中Mn—N键和Mn—O键的伸缩振动[21-22];此外,配合物中芳环的振动峰位置也与配体中的不同。这些结果均证明配合物的合成成功。
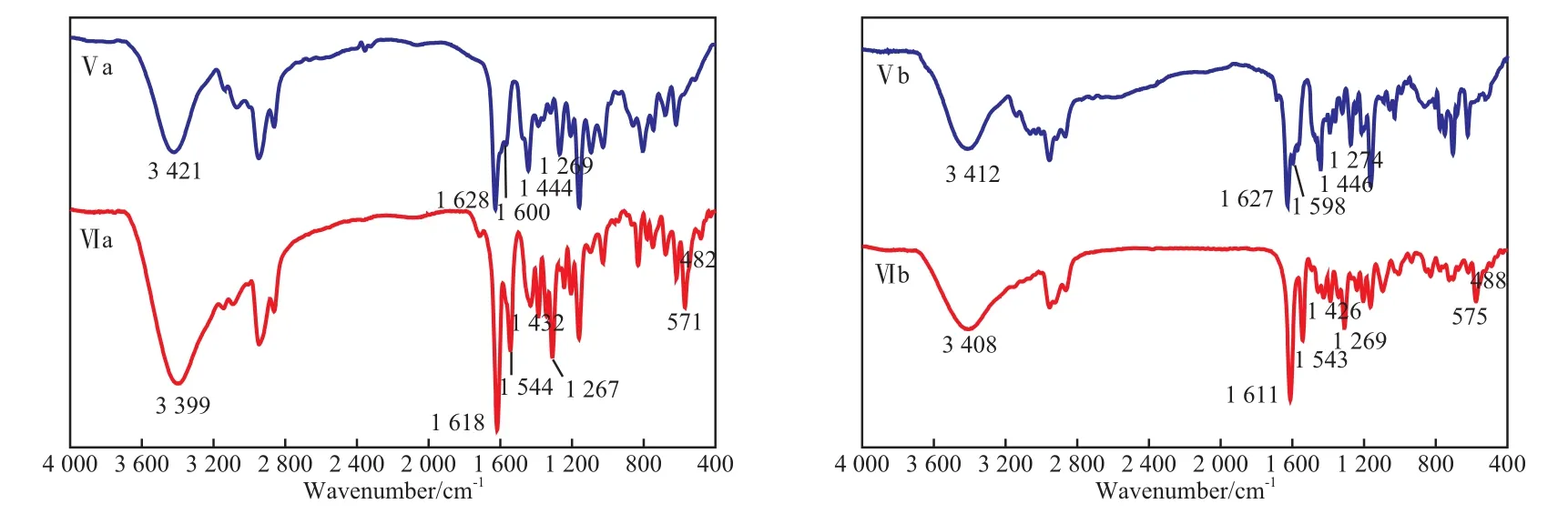
图3 配体与配合物的FTIR谱图Fig.3 FTIR spectra of the ligands and complexes.
配体Ⅴ和配合物Ⅵ的UV-Vis谱图见图4。由图4可看出,对于配体Ⅴa和Ⅴb,359,334 nm处出现的吸收带归属于键的跃迁,苯环的E2和B吸收带均有变化。形成配合物后,在可见光区均出现了明显的宽而弱的谱带(Ⅵa的414 nm处、Ⅵb的408 nm处),这些谱带归属于金属与配体间的d-d电荷迁移跃迁[23]。另外,键的n→π*跃迁吸收带出现了不同程度的蓝移,说明键的N原子参与了配位。形成配合物前后UV-Vis谱图的变化进一步证明了配合物的合成成功。
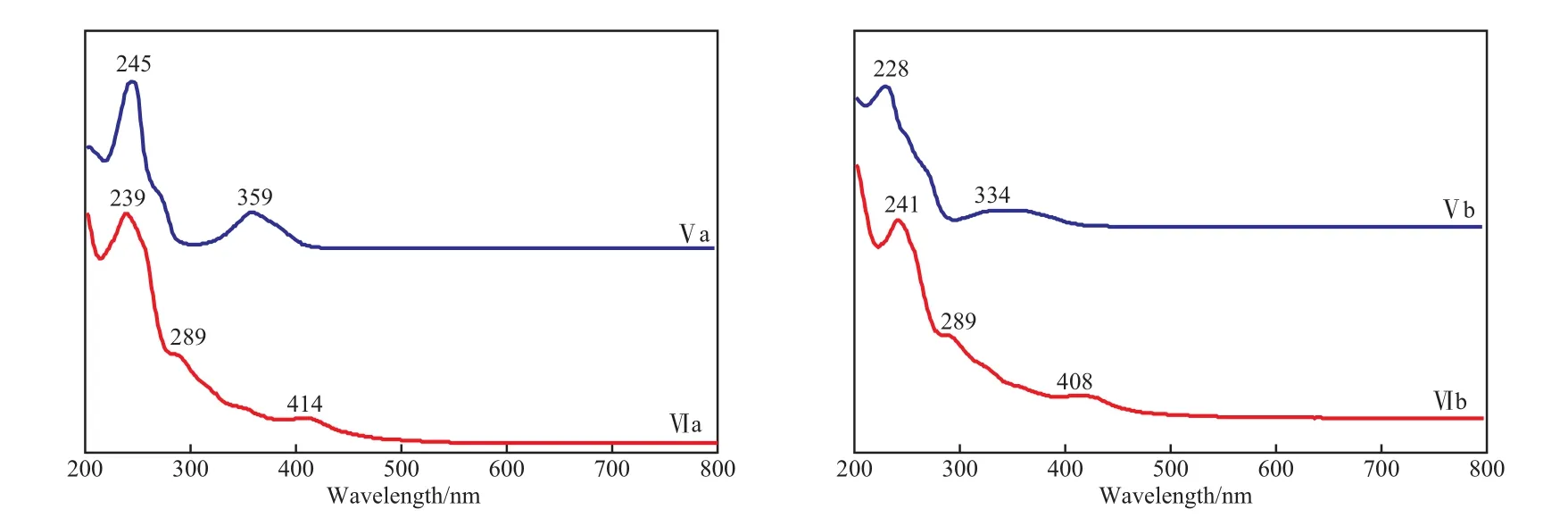
图4 配体与配合物的UV-Vis谱图Fig.4 UV-Vis spectra of the ligands and complexes.
2.2 配合物催化性能的考察
以NaClO为氧化剂,考察了配合物Ⅵa和Ⅵb对顺式-β-甲基苯乙烯、1,2-二氢化萘、苯乙烯和α-甲基苯乙烯不对称环氧化反应的催化性能,同时以苯乙烯为底物对比了Ⅵa和Ⅵb与经典Salen-Mn(Ⅲ)配合物A和B的催化性能,实验结果见表1。
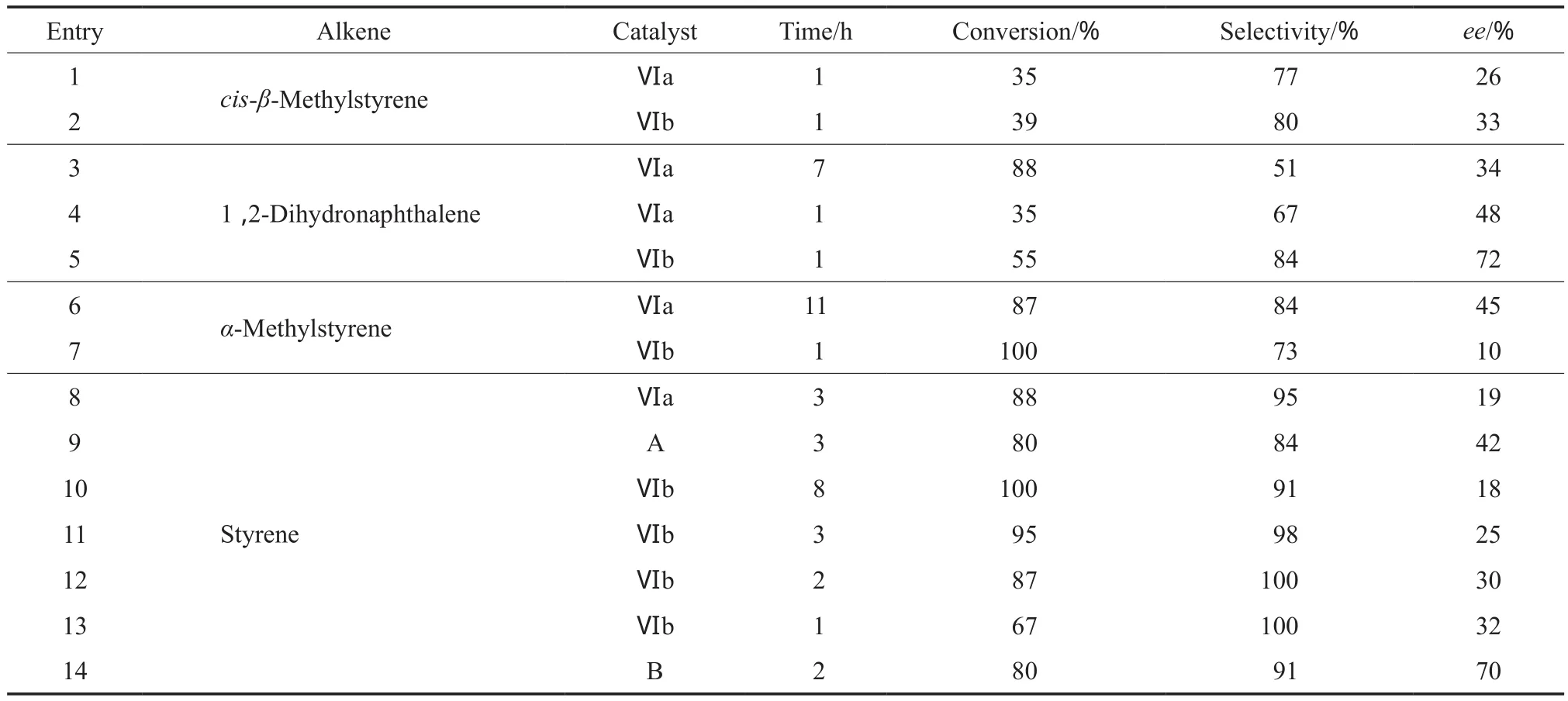
表1 配合物Ⅵa,Ⅵb,A,B催化的烯烃不对称环氧化反应结果Table 1 Asymmetric epoxidation of alkenes catalyzed by complexes Ⅵa,Ⅵb,A and B
公认的手性Salen-Mn(Ⅲ)配合物催化的烯烃不对称环氧化反应机理见图5[24]。如图5所示,氧化剂首先将Salen-Mn(Ⅲ)配合物(a)氧化为活性中间体——氧合Salen-Mn(Ⅴ)配合物(b);然后,氧合Salen-Mn(Ⅴ)配合物再与烯烃的双键作用生成四元环中间体(c);四元环中间体(c)再转化为三元环中间体(d);最后,三元环中间体(d)在释放出环氧化物的同时,氧合Salen-Mn(Ⅴ)配合物(b)被还原成Salen-Mn(Ⅲ)配合物(a)。
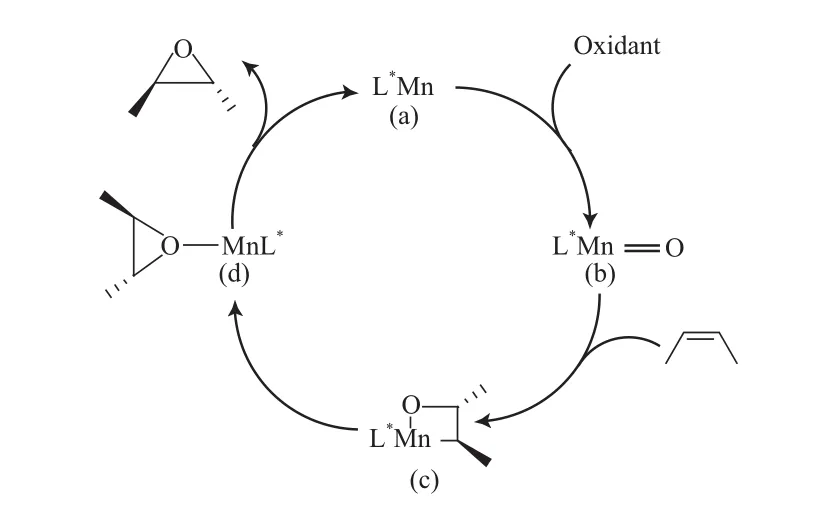
图5 Salen-Mn(Ⅲ)配合物催化的烯烃不对称环氧化反应机理Fig.5 Reaction mechanism of the asymmetric epoxidation catalyzed by Salen-Mn(Ⅲ) complex.
由表1可知,烯烃不对称环氧化反应进行的程度与催化剂和底物烯烃的结构相关。对于配合物Ⅵa和Ⅵb,从反应的转化率、环氧化物的选择性和ee值来看,Ⅵb的催化性能优于Ⅵa。这是由于Ⅵb的二胺桥部分含有两个苯基,彼此分离,因此在环氧化反应中既有利于烯烃分子与中间体的配位(见图5),又有利于辨别底物双键的两个面,导致反应速率和ee值更高。Ⅵa和Ⅵb与相应的经典催化剂A和B相比活性有所提高,但ee值却有所降低。如在相同条件下反应3 h,A为催化剂时苯乙烯的转化率、环氧化物的选择性和ee值分别为80%,84%,42%;而Ⅵa为催化剂时对应数值分别为88%,95%,19%(entries 9,10);配合物B与Ⅵb相比也有类似的结果(entries 12, 14)。这些结果表明,手性Salen-Mn(Ⅲ)配合物结构中并入咪唑盐基团后,使配合物具有部分相转移催化剂的作用,有利于两相反应中反应物料与催化剂的接触,因而促进环氧化反应的进行;另一方面,由于Salen-Mn(Ⅲ)配合物中C5位的叔丁基被咪唑盐基团取代,降低了配合物的空间位阻,进而降低了底物烯烃与中间体的对映选择性配位,因而降低了烯烃不对称环氧化反应的ee值。
分析底物烯烃的结构可知:其一,端烯烃比内烯烃更容易被环氧化。如以Ⅵb为催化剂,相同条件下反应1 h,顺式-β-甲基苯乙烯(内烯烃)的转化率为39%,而α-甲基苯乙烯(端烯烃)的转化率则达100%,但环氧化物的选择性和ee值则相反(entries 2,7)。很显然,端烯烃的空间位阻较小,有利于底物烯烃分子与中间体配位,使反应速率加快;但空间位阻小不利于潜手性烯烃分子与手性催化剂的选择性配位,因而ee值较低。其二,环烯烃比链烯烃更容易被环氧化。如以Ⅵb为催化剂,相同条件下反应1 h,顺式-β-甲基苯乙烯的转化率为39%,而1,2-二氢化萘的转化率则达55%,后者发生环氧化反应的选择性和ee值也比前者的高(entries 2,5)。这是因为1,2-二氢化萘与顺式-β-甲基苯乙烯相比,碳碳双键空间位阻小,更容易与中间体配位,而苯环的存在有利于对映选择性配位,因而反应的转化率和ee值均较高。其三,碳碳双键上取代基的电子效应和立体效应共同决定烯烃不对称环氧化反应的进行。如在相同条件下,苯乙烯环氧化反应的速率比顺式-β-甲基苯乙烯的快,但比α-甲基苯乙烯的慢;ee值比顺式-β-甲基苯乙烯的低,而比α-甲基苯乙烯的高(entries 2,7,13)。从电子效应考虑,甲基是给电子基,甲基的存在提高了碳碳双键上的电子云密度,有利于底物烯烃与中间体配位,促进反应的进行;从立体效应考虑,甲基的存在阻碍了底物烯烃与中间体的配位,不利于烯烃不对称环氧化反应的进行,降低了反应速率;但也正是由于空间位阻的增加,有利于底物烯烃与中间体的对映选择性,有利于ee值的提高。另外,延长反应时间可提高反应的转化率,但环氧化物的选择性和对映选择性均有所降低(entries 10-13)。
3 结论
1)通过在水杨醛C5位引入咪唑盐基合成了两种手性Salen配体,进而与Mn(Ⅲ)配位得到两种水溶性手性Salen-Mn(Ⅲ)配合物。
2)在以NaClO为氧化剂的非官能化烯烃的不对称环氧化反应中,水溶性手性Salen-Mn(Ⅲ)配合物比经典手性Salen-Mn(Ⅲ)配合物显示更高的活性和环氧化物选择性,但ee值有所降低。
3)烯烃结构中取代基的电子效应和立体效应共同决定不对称环氧化反应的结果:给电子基可加速反应的进行,空间位阻有利于ee值的提高。
[1] Katsuki T. Chiral Metallosalen Complexes:Structures and Catalyst Tuning for Asymmetric Epoxidation and Cyclopropanation[J].Adv Synth Catal,2002,344(2):131 - 147.
[2] Wang Xiaoe,Miao Chengxia,Wang Shoufeng,et al. Bioinspired Manganese and Iron Complexes with Tetradentate N Ligands for the Asymmetric Epoxidation of Ole fi ns[J].Chem-CatChem,2013,5(8):2489 - 2494.
[3] Hori K,Tamura M,Tani K,et al. Asymmetric Epoxidation Catalyzed by Novel Azacrown Ether-Type Chiral Quaternary Ammonium Salts Under Phase-Transfer Catalytic Conditions[J].Tetrahedron Lett,2006,47(18):3115 - 3118.
[4] Huang Jing,Fu Xiangkai,Wang Gang,et al. A High Ef fi cient Large-Scale Asymmetric Epoxidation of Unfunctionalized Olefins Employing a Novel Type of Chiral Salen Mn(Ⅲ)Immobilized onto Layered Crystalline Aryldiamine Modified Zinc Poly(Styrene-Phenylvinylphosphonate)-Phosphate[J].J Mol Catal A:Chem,2012,357:162 - 173.
[5] Huang Xuemei,Fu Xiangkai,Wu Xiaoju,et al. Novel Bis-Salen Mn(Ⅲ) Chiral Complexes of Rigid Structure Axially Coordinated with Bis-Diphenolate and Bis-Diamine for Epoxidation of Unfunctionalized Ole fi ns[J].Tetrahedron Lett,2013,54(31):4041 - 4044.
[6] 白鹏,李晓峰,朱良伟,等. 手性化合物1,1′-联二萘酚的合成及其在不对称氧化还原反应中的应用[J]. 石油化工,2005,34(9):891 - 897.
[7] Zhang Wei,Loebach J L,Wilson S R,et al. Enantioselective Epoxidation of Unfunctionalized Ole fi ns Catalyzed by (Salen)Manganese Complexs[J].J Am Chem Soc,1990,112(7):2801 - 2803.
[8] Irie R,Noda K,Ito Y,et al. Catalytic Asymmetric Epoxidation of Unfunctionalized Ole fi ns[J].Tetrahedron Lett,1990,31(50):7345 - 7348.
[9] Bryliakov K P,Kholdeeva O A,Vanina M P,et al. Role of MnⅣSpecies in Mn(Salen) Catalyzed Enantioselective Aerobic Epoxidation of Alkenes:An EPR Study[J].J Mol Catal A:Chem,2002,178(1/2):47 - 53.
[10] Sun Yan,Tang Ning. Enantioselective Epoxidation of Ole fi ns Catalyzed by Chiral Dimeric and Partially Water-Soluble Monomeric Salen-Mn(Ⅲ) Complexes in the Presence of Novel Co-Catalysts[J].J Mol Catal A:Chem,2006,255(1/2):171 - 179.
[11] Wang Dongping,Wang Mei,Zhang Rong,et al. Asymmetric Epoxidation of Styrene and Chromenes Catalysed by Dimeric Chiral(Pyrrolidine Salen)Mn(Ⅲ) Complexes[J].Appl Catal,A,2006,315:120 - 127.
[12] Wang Dongping,Wang Mei,Wang Xiuna,et al. In fl uence of the Built-in Pyridinium Salt on Asymmetric Epoxidation of Substituted Chromenes Catalysed by Chiral(Pyrrolidine Salen)Mn(Ⅲ) Complexes[J].J Mol Catal A:Chem,2007,270(1/2):278 - 283.
[13] Lou Lanlan,Yu Kai,Ding Fei,et al. Covalently Anchored Chiral Mn(Ⅲ) Salen-Containing Ionic Species on Mesoporous Materials as Effective Catalysts for Asymmetric Epoxidation of Unfunctionalized Ole fi ns[J].J Catal,2007,249(1):102 - 110.
[14] Luo Rongchang,Tan Rong,Peng Zhigang,et al. Stable Chiral Salen Mn(Ⅲ) Complexes with Built-in Phase-Transfer Capability for the Asymmetric Epoxidation of Unfunctionalized Ole fi ns Using NaOCl as an Oxidant[J].J Catal,2012,287:170 - 177.
[15] Tan Rong,Yin Donghong,Yu Ningya,et al. Ionic Liquid-Functionalized Salen Mn(Ⅲ) Complexes as Tunable Separation Catalysts for Enantioselective Epoxidation of Styrene[J].J Catal,2008,255(2):287 - 295.
[16] Schanz H J,Linseis M A,Gilheany D G. Improved Resolution Methods for (R,R)- and (S,S)-Cyclohexane-1,2-Diamine and (R)- and (S)-BINOL[J].Tetrahedron:Asymmatry,2003,14(18):2763 - 2769.
[17] Mckillop A,Kemp D. Further Functional Group Oxidations Using Sodium Perborate[J].Tetrahedron,1989,45(11):3299 - 3306.
[18] Casiraghi G,Casnati G,Puglia G,et al. Selective Reaction Between Phenols and Formaldehyde:A Novel Route to Salicylaldehyde[J].J Chem Soc,Perkin Trans1,1980:1862 - 1865.
[19] Kureshy R I,Khan N H,Abdi S H R,et al. A Highly Potential Analogue of Jacobsen Catalyst with in-Built Phase Transfer Capability in Enantioselectivity Epoxidation of Nonfunctionalized Alkenes[J].J Catal,2002,209(1):99 - 104.
[20] 何乐芹,赵继全,张雅然. 手性Salen Mn(Ⅲ)配合物催化NaClO不对称环氧化苯乙烯反应[J]. 应用化学,2006,23(6):688 - 690.
[21] 张雅然,赵继全,何乐芹,等. 新型席夫碱配体及其Mn3+,Fe3+,Ni2+,Cu2+配合物的合成与表征[J]. 无机化学学报,2005,21(12):1871 - 1874.
[22] 刘艳华,赵继全,焦永杰,等. Salen-Mn配合物催化空气环氧化烯烃反应[J]. 石油化工,2004,33(9):816 - 819.
[23] 袁瑞娟,阮文娟,朱必学,等. 手性双核Salen配合物的合成与谱学性质[J]. 无机化学学报,2004,20(4):444 - 459.
[24] Rukhsana I K,Noorul H K,Sayed H R,et al. Chiral Mn(Ⅲ)Salen Complex-Catalyzed Enantioselective Epoxidation of Nonfunctionalized Alkenes Using Urea-H2O2Adduct as Oxidant[J].J Catal,2003,219(1):1 - 7.
(编辑 安 静)
Preparation of Water Soluble Chiral Salen-Mn(Ⅲ) Complexes and Their Catalytic Performance in Epoxidation of Alkenes
Ma Wenchan,Yang Ruiyun,Zhang Yuecheng,Zhao Jiquan
(School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin 300130,China)
A salicylaldehyde derivative with a quaternary imidazole moiety was synthesized from 2-tert-butylphenol by the formylation,chloromethylation and quaternarization withN-methylimidazole. Two corresponding chiral Salen ligands were obtained by the respective condensation of the salicylaldehyde derivative with (1S,2S)-diphenylethylenediamine and (1S,2S)-diamnocyclohexane. Two water soluble chiral complexes were prepared by the respective complexation of the two chiral Salen ligands with Mn(Ⅲ). The chiral Salen-Mn(Ⅲ) complexes were employed as catalysts in the asymmetric epoxidation of unfunctional alkenes,namely styrene,1,2-dihydronaphthalene,α-methylstyrene andcis-β-methylstyrene,with NaClO as an oxidant.Compared with the corresponding typical chiral Salen-Mn(Ⅲ) complexes,the water soluble complexes showed high activity and selectivity in the epoxidation,but low enantioselectivity. For instance,both the activity and the selectivity of the water soluble chiral Salen-Mn(Ⅲ) complexes in the styrene epoxidation increased by about 10%,but the enantioselectivity decreased by more than 20%.
chiral Salen-Mn(Ⅲ) complex catalyst;water solubility;asymmetric epoxidation;unfunctional alkenes;sodium hypochlorite
1000 - 8144(2014)04 - 0394 - 07
TQ 203.2
A
2013 - 09 - 27;[修改稿日期]2013 - 12 - 25。
马文婵(1976—),女,河北省沧州市人,博士生,高级工程师。联系人:赵继全,电话 022 - 60202926,电邮zhaojq@hebut.edu.cn。
国家自然科学基金项目(21276061); 河北省自然科学基金项目(B2013202158)。
