介孔材料固定化酶的研究进展及其应用前景
2014-10-10杨启华
刘 佳,杨启华
(1. 中国科学院 大连化学物理研究所,辽宁 大连 116023;2. 中国科学院大学 化学与化工学院,北京 100029)
介孔材料固定化酶的研究进展及其应用前景
刘 佳1,2,杨启华1
(1. 中国科学院 大连化学物理研究所,辽宁 大连 116023;2. 中国科学院大学 化学与化工学院,北京 100029)
评述了介孔材料固定化酶的研究新进展,重点分析了酶分子被固载到介孔材料的纳米孔中后,载体孔径尺寸和纳米孔微环境对固定化酶催化活性及其稳定性可能产生的影响。同时,以水解酶和氧化还原酶为例,对介孔材料固定化酶在生物柴油制备、生物质转化、手性药物及精细化学品合成、生物燃料电池及生物传感器制备等领域的应用前景进行了展望。
生物催化;硅基介孔材料;酶固定化
酶是生物体细胞内产生的具有催化功能的特殊蛋白,在常温常压下可高效率、高专一性地催化各种生物化学反应,促进生物体的新陈代谢。模仿自然界,用以酶为催化剂的生物催化技术取代传统的化学品生产方式,是实现资源利用生态化和可持续发展的重要趋势。研究者们普遍认为,生物催化将是继医药和农业革命之后,生物技术革命的第三个浪潮,以生物催化为核心的工业生物技术在支撑社会进步和经济发展的技术体系中的地位已经被提到了空前的战略高度[1]。尽管酶的工业开发和利用是当代生物技术革命的重要课题,但目前可大规模生产和应用的商品酶只有数十种。天然酶在工业应用上受到限制的主要原因有:大多数酶脱离其生理环境后极不稳定,生产应用过程中的条件会使酶失活;酶的分离纯化工艺复杂,会对反应体系造成污染且无法实现连续化生产;酶制剂的成本较高[2]。为解决上述问题,酶的固定化技术应运而生。所谓酶的固定化是指将自由的酶分子束缚或限域在一定空间内,但仍保留其催化特性并可回收使用的一类技术[3]。固定化酶在技术上的显著优势使得该领域的研究受到广泛关注,氧化硅基介孔材料的出现为酶的固定化开辟了新的发展空间。氧化硅基介孔材料具有在2~50 nm内连续可调的孔径、较大的比表面积和孔体积、易调变的孔道化学组成、良好的生物兼容性及稳定性等优点,是固定化酶的理想载体[4-6]。1996年,Diaz等[7]研究组首次报道了几种球形蛋白(细胞色素C、木瓜蛋白酶和胰蛋白酶)在孔径为4 nm的有序介孔材料MCM-41上的物理吸附。十几年来,随着新型介孔材料的不断涌现、新的固定化酶反应体系的不断拓展以及对影响固定化酶性能的相关因素的逐渐深入探索,介孔材料固定化酶的研究领域取得了一系列进展。
本文通过概述影响固定化酶催化活性及其稳定性的关键因素,介绍了氧化硅基介孔材料固定化酶的研究进展,并对其在工业生物催化中的应用前景进行了展望。
1 介孔材料固定化酶的影响因素
1.1 孔径
大量研究表明,介孔材料纳米孔的孔径大小会对固定化酶的吸附量、活力保留及稳定性产生直接影响[8-9]。当载体的孔径远小于酶分子的直径时,酶分子不易被固载到载体的纳米孔中,而主要分布于载体的外表面,因此无法利用孔壁对酶分子起到保护作用。但当载体的孔径远大于酶分子的直径时,对于通过物理吸附作用(疏水作用、静电作用、氢键及范德华力)固载到纳米孔中的酶,酶与载体之间的弱相互作用难以有效地将酶分子稳定在纳米孔中,酶的流失较严重。因此,一般认为当介孔材料纳米孔的直径略大于酶的分子尺寸时,所得的固定化酶更容易表现出较高的稳定性[10]。
Takahashi等[11]分别以具有不同孔径的FSM-16,MCM-41,SBA-15介孔材料为载体,详细考察了介孔材料的孔径大小对其固载辣根过氧化物酶(HRP,分子直径约4.6 nm)的影响。研究结果表明,当以孔径较小的FSM-16介孔材料(孔径为2.7 nm)为载体时,酶的吸附量较低。他们认为这是由于酶分子无法进入载体的孔道内部,而仅吸附在介孔材料的外表面所致。Lykourinou等[12]研究发现,当载体的孔径(1.3 nm)略小于细胞色素C酶蛋白(2.6 nm×3.2 nm×3.3 nm)的分子尺寸时,细胞色素C酶蛋白可在发生一定的构型变化后进入到载体的纳米孔中。经荧光光谱表征,他们进一步发现存在于纳米孔中的细胞色素C酶蛋白的构型介于其天然构型与完全失活的构型之间。Liu等[13]研究发现,分子尺寸为3 nm×4 nm×5 nm的洋葱假单细胞菌脂肪酶(PCL)可通过简单的物理吸附作用进入孔口尺寸(小于4 nm)略小于PCL直径的FDU-12材料中,且所得的固定化酶可在外消旋苯乙醇的手性拆分反应中循环使用多次。
由此可以推测,当载体的孔径远小于酶分子尺寸时,酶通过解折叠等构型变化的方式进入纳米孔中会变得较困难,因此可以通过先吸附酶、后缩小孔口尺寸的方法来实现介孔材料对酶分子的封装。具体地说,首先选取孔径略大于酶分子直径的介孔材料作为载体,在将酶分子吸附到纳米孔中后,通过硅烷化处理大幅缩小载体的孔口直径,使其远小于酶分子的尺寸(同时大于底物及产物分子的尺寸),从而将酶分子物理限域在纳米孔内,防止其在反应过程中从纳米孔内流失到反应溶液中。Ma等[14-15]采用具有二维六方相直形孔道的MCM-41介孔材料作为载体,首先将猪胰腺脂肪酶(PPL)吸附到MCM-41介孔材料的纳米孔中,然后以乙烯基三甲氧基硅烷为硅烷化试剂,与MCM-41介孔材料孔口处的表面硅羟基进行反应,可有效地将载体的孔口尺寸从4.5 nm缩小到1.4 nm,从而将PPL封装在MCM-41介孔材料的纳米孔道中。循环实验证明,采用该方法得到的固定化酶具有更高的循环稳定性。但由于在封口过程中会产生甲醇等对酶的活性有毒害作用的试剂,经过封口处理的固定化酶活力仅为自由酶活力的40%。最近,Liu等[13]以具有三维联通笼形孔道结构的FDU-12材料(纳米笼直径为17 nm,孔口尺寸小于4 nm)为载体,以六甲基二硅氮烷(HMDS)为硅烷化试剂,在30 ℃的温和条件下对吸附有PCL的FDU-12载体进行封口(见图1)。
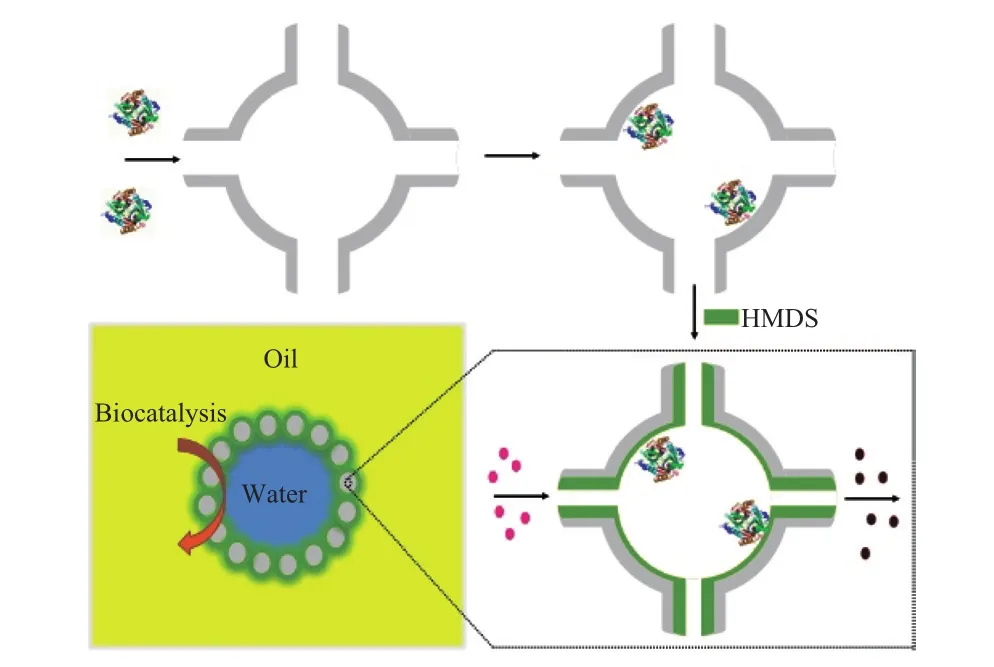
图1 酶分子在FDU-12材料的纳米笼内的封装及其在两相生物催化反应中的应用[13]Fig.1 Schematic diagram of encapsulating enzymes into the nanocage of FDU-12 for performing biphasic biocatalytic reactions[13].HMDS:hexamethyldisilazane.
UV-Vis表征结果显示,采用该方法可成功地将PCL封装在FDU-12的纳米笼内,有效抑制其在催化反应中的流失。同时由于FDU-12材料特殊的笼形孔道结构及封口过程中避免了甲醇等有害试剂的产生,该封装方法可有效地保持PCL的催化活性。活性测试结果表明,封口后PCL的活力为自由酶活力的1.7倍。此外,HMDS修饰不仅能将PCL封装在FDU-12材料的纳米笼中,同时还可将FDU-12材料的外表面由亲水性转变为双亲性,所得的固体催化剂颗粒可有效地稳定在水/油两相界面,为制备固体乳液(Pickering emulsion)及进行两相生物催化提供了一种新的途径(见图1)。
1.2 纳米孔微环境
酶分子对其周围环境条件非常敏感,酶所催化的生物化学反应都是在特定的微环境内发生的。在细胞中,酶分子周围的细胞液中除分散着各种各样的细胞器外,还充斥着大量的蛋白、核酸、多糖等,同时酶分子周围的微环境都具有特定的亲疏水性、氧化还原性、离子强度、pH等,这些特定的微环境是保证细胞内的酶具有高催化活性、高选择性及高稳定性的关键因素[16-18]。当酶分子被固载到介孔材料中后,介孔材料纳米孔内的环境就构成了固定化酶的微环境。研究结果表明,纳米孔微环境会直接影响酶与载体之间的相互作用、酶分子的构型及空间取向、酶分子构象变化的自由度以及酶分子活性中心附近的微环境等[8,19-20]。因此,载体纳米孔的微环境是否适宜直接决定着固定化酶的活性、稳定性及选择性,要获得高催化性能的固定化酶,就需对介孔材料纳米孔的微环境进行精心设计,以尽可能接近细胞内酶分子的微环境。
据研究,细胞质内大分子的总质量浓度高达300~400 g/L,占据细胞体积的20%~40%,细胞内的酶分子就是在这种拥挤的环境中完成催化反应的。Minton等[21-22]从1981年开始对这种拥挤的细胞内微环境及其对酶的构型、活性和稳定性的影响进行了一系列的研究,并提出大分子拥挤应当与pH、离子强度、溶液组成等一样被作为酶性能研究中的一项常规因素。虽然目前在酶溶液中添加惰性大分子试剂来模拟细胞中的拥挤微环境已经引起越来越多生物学家和化学家的重视,但在固定化酶的研究中,相关的文献报道还非常少,而且仅有的一些报道主要是针对包埋在硅胶中的酶分子进行的[23]。最近,Liu等[24]在研究通过利用聚合物分子对介孔材料纳米孔的修饰来控制固定化酶周围空间的拥挤程度时发现,提高固定化酶微环境的拥挤程度,可有效抑制高温引起的酶的解折叠,提高固定化酶的稳定性,但同时拥挤的微环境又会因干扰酶分子的二级结构而产生负面作用。此外,拥挤的纳米孔微环境可增强酶分子与底物的亲和能力,促使反应平衡向形成酶-底物复合物的方向移动,从而加快酶促反应速率,但又会因增加产物和底物在纳米孔道内的扩散阻力而使反应速率下降。总之,无论是对于酶的活性还是稳定性,拥挤的纳米孔微环境都是一把双刃剑。利用聚合物大分子对介孔材料的纳米孔进行修饰,可有效地模拟细胞中的拥挤微环境;同时,通过调变聚合物的引入量可精确控制固定化酶周围环境的拥挤程度,从而调变大分子拥挤效应所带来的两个相反作用的平衡,使固定化酶的活性和稳定性同时得到提高。
纳米孔内的化学微环境(如表面亲/疏水性等)也是影响固定化酶催化性能的重要因素。由于酶分子表面既有亲水性的极性氨基酸残基又有疏水性的非极性氨基酸残基,因此载体表面的亲/疏水性平衡直接决定着酶与载体之间疏水作用的强弱[9]。Park等[25]将青霉素G酰化酶(PGA)负载到一系列巯基、醛基、羧基、苯基、乙烯基修饰的SBA-15介孔材料中,发现乙烯基修饰的SBA-15介孔材料对PGA具有最高的吸附量及最低的米氏常数,表明疏水性的介孔材料表面可与PGA表面的疏水性基团形成强的疏水作用,且该作用对固定化PGA的活力产生了影响。以脂肪酶和PGA为例,通过调变载体表面的亲/疏水性可以调变酶分子活性构象与非活性构象之间的平衡,从而使固定化酶的催化活性产生较大差别。当酶的稳定性受酶的构象控制时,载体表面的亲/疏水性平衡也会对固定化酶的稳定性产生很大影响。如将碱性磷酸酶负载到非极性基团修饰的载体上时,其稳定性大幅降低,其原因可能是载体与酶分子之间的疏水作用导致酶分子从天然构象向松散的、不稳定的构象转变[26]。然而,当将脂肪酶分子负载到疏水性介孔材料中时,载体表面与脂肪酶分子表面的大面积的疏水作用可以增强酶分子的刚性,对酶分子的活性构象起到很好的稳定作用,因此所得固定化脂肪酶的热稳定性和循环稳定性均会显著提高。此外,由于酶分子表面亲/疏水性基团集中的区域不同,酶被吸附到亲/疏水性不同的载体上时可能会产生不同的空间取向,从而影响酶活性中心的可及性及固定化酶的催化活性[27]。
Liu等[28-29]研究表明,与有机小分子相比,采用聚合物大分子对纳米孔化学微环境进行修饰具有独特的优越性:1)与有机小分子官能团(如丙基、苯基、氨基、羧基等) 相比,聚合物对介孔材料的修饰更加多样化,也更加精细。通过调变聚合物单体的种类、相对比例及引入量,可对纳米孔表面的化学性质进行高度精确的微调控,从分子层次对固定化酶的化学微环境进行精确调变。如将具有不同亲/疏水性的环氧乙烷与环氧丙烷形成的长链嵌段聚合物化学键合到介孔二氧化硅的纳米孔内,从而对固定化脂肪酶微环境的亲/疏水性平衡进行精确调控[28]。研究发现,与亲水性和强疏水性的载体微环境相比,中等强度疏水性的载体微环境(水蒸气与苯蒸气的吸附摩尔比为0.41)对PCL最为适宜,这种微环境既能诱发PCL的界面激活作用,又不会破坏其活性中心,从而可以使PCL表现出最高的活力和稳定性。2)某些聚合物具有特殊的环境-响应性能,能够对外界环境中的微小刺激信号(如温度、pH、离子强度、磁场、光照、化学物质等)的变化产生快速响应,在结构物理性能及化学性能上发生突变。利用这一特殊性质,将环境-响应聚合物修饰到介孔材料中,可以实现对纳米孔微环境的原位调变。在众多具有环境-响应性能的聚合物中,聚N-异丙基丙烯酰胺(PNIPAM)是一种非常典型的温控-响应聚合物,它在最低临界温度(32 ℃)附近能发生可逆的体积相变行为。当温度低于32 ℃时,PNIPAM在水溶液中为伸展的链状,呈现亲水性;但当温度高于32 ℃时,PNIPAM在水溶液中会收缩团聚成小球状,呈现疏水性。在最近的研究中,Liu等[29]合成了PNIPAM-二氧化硅杂化介孔材料,通过化学键合在纳米孔内的PNIPAM的温控-响应收缩,可以原位地为固定化酶分子形成拥挤且疏水的微环境(见图2)。通过测试固定化酶的活性和稳定性发现,这种具有温控-响应性能的介孔材料可大幅提高PCL和南极假丝酵母菌脂肪酶B(CALB)的热稳定性。当在70 ℃下热处理2 h后,固载在温控-响应纳米孔内的PCL的活力不仅没有降低,反而比热处理前提高了15倍。同样,在70 ℃下热处理2 h后,固载在温控-响应纳米孔内的CALB在外消旋苯乙醇的动力学拆分中仍表现出远高于自由酶的催化活性。这可能是因为热处理引起孔道内的PNIPAM收缩,使纳米孔内微环境的疏水性显著增强,激发了固定化PCL的“界面激活”作用。此外,聚合物链缠绕和包裹住周围的酶分子,有效模拟了细胞内的拥挤微环境,避免酶分子因解折叠而失活,同时也为酶分子提供了一个隔绝外界极端环境的防护层。他们的研究表明,将温控-响应聚合物PNIPAM引入到介孔材料的纳米孔中,可以对固定化酶的催化性能产生十分有益的影响,为制备高效、高稳定性的多相生物催化剂提供了一种新的途径。
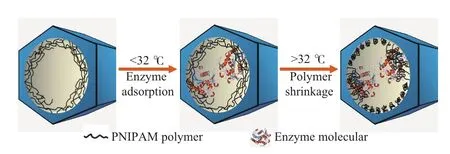
图2 PNIPAM聚合物在高温下对固定化酶起保护作用的示意[29]Fig.2 Illustration of the protective effect of PNIPAM polymer on immobilized enzymes at high temperature[29].PNIPAM:poly(N- isopropyl acrylamide).
2 介孔材料固定化酶在生物催化中的应用前景
最新的研究报告表明,2010年世界范围内工业用酶的市场已超过33亿美元,且会以每年7%~9%的增速在2015年达到45~50亿美元[30]。可以预计,介孔材料固定化酶研究工作的不断深入,可为制备高活性、高稳定性的多相生物催化剂提供新的有效途径,酶制剂的工业化应用也会取得更快、更大的发展。
2.1 固定化水解酶
由于水解酶在生物柴油、生物质转化、手性药物及精细化学品的合成等领域具有很高的应用价值,因此目前水解酶在介孔材料上的固定化研究备受关注。纤维素酶可以催化纤维素类生物质向葡萄糖转化,研究者们通过物理吸附或化学键合等方法,已成功地将纤维素酶固载到一系列介孔材料(如SBA-15、有机官能团修饰的FDU-12和MCF等材料)中。Chang等[31]将纤维素酶通过化学键合的方式固载到羧基修饰的孔径达40 nm的介孔材料中,用所得的固定化酶催化纤维素水解为葡萄糖的转化率高达80%,且在使用过程中该固定化酶表现出良好的稳定性。
与化学法生产过程相比,通过脂肪酶催化的酯交换工艺,将自然界产生的油料作物、动物油脂以及餐饮垃圾油等制成可代替石化柴油的再生性柴油燃料,具有条件温和、醇用量小、无污染排放等优点,是工业化生产的发展方向。Salis等[32]分别采用物理吸附和化学键合的方法将荧光假单胞菌脂肪酶固载到SBA-15介孔材料中,所得的固定化酶可在温和的反应条件下,7 h内将葵花籽油近100%地催化醇解转化。此外,他们还发现用化学键合法制得的固定化酶具有良好的稳定性,可以循环使用20次以上。
利用酶的高度立体选择性进行外消旋体拆分以获得光学纯的化合物是制备手性药物的重要途径。与自由酶相比,固定化酶具有可循环使用、操作稳定性好等特点,因此在手性药物的工业生产中具有更高的应用价值。光学纯扁桃酸是市场潜力巨大的药物和精细化工中间体,Itoh等[33-34]将脂肪酶固载到甲基丙烯酸修饰的SBA-15介孔材料中,对外消旋扁桃酸甲酯进行手性拆分(见图3)。以离子液体为反应溶剂,所得产物(R)-(-)-扁桃酸甲酯对映体过量值(ee)高达99%。手性N取代的苯基-α-氨基丙酸也是一类重要的手性合成中间体,特别是在农药领域,是很多手性农药合成中的关键中间体。以2-[(2-甲基-6-乙基)苯基氨基]丙酸(NEMPA)为模型化合物,Zheng等[35]采用手性选择性相反的两种脂肪酶催化串联反应,同时合成出光学纯的(S)-NEMPA和(R)-NEMPA,反应过程见图4。即以外消旋的2-[(2-甲基-6-乙基)苯基氨基]丙酸甲酯(NEMPA-ME)为底物,首先用固载在SBA-15介孔材料中的PCL催化外消旋的NEMPA-ME水解,得到光学纯的(S)-NEMPAME和(R)-NEMPA,ee>99%;然后以CALB为催化剂,将(S)-NEMPA-ME进一步转化为(S)-NEMPA,ee=98%。
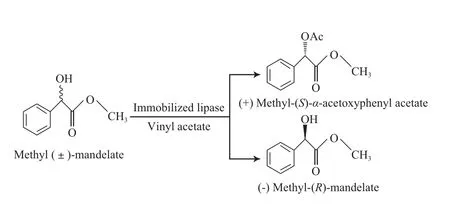
图3 固定化脂肪酶催化外消旋扁桃酸甲酯的手性拆分反应[33-34]Fig.3 Transesteri fi cation of methyl(±)-mandelate and vinyl acetate catalyzed by immobilized lipase[33-34].
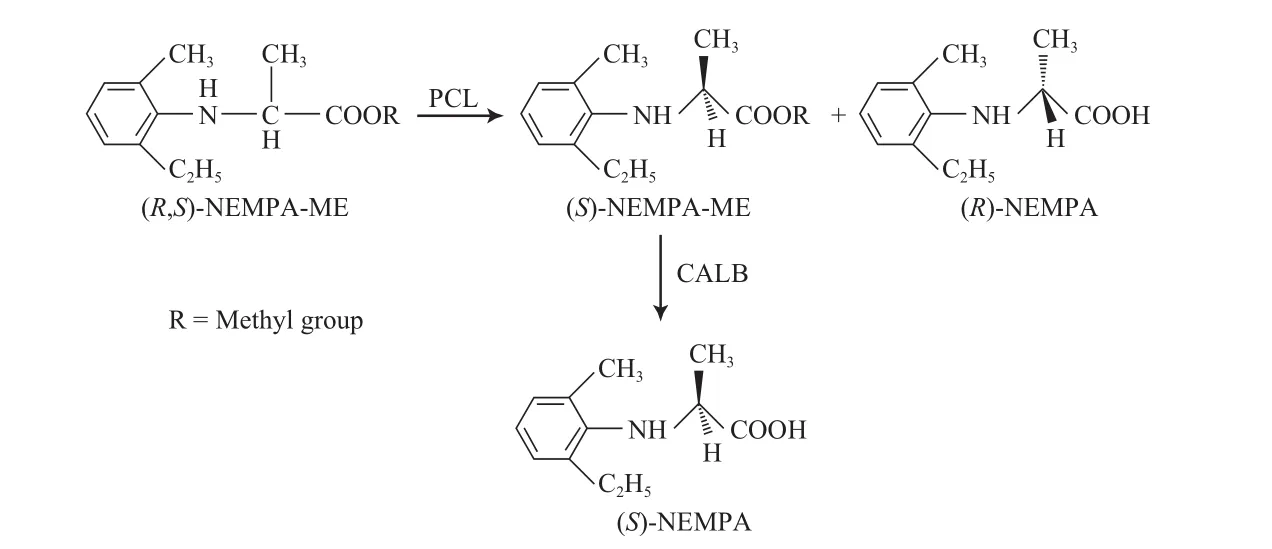
图4 固载在SBA-15介孔材料中的PCL和CALB共同催化的两步法制备光学纯NEMPA的过程[35]Fig.4 Preparation process of (S)-(-)-NEMPA by two-step resolution using lipase from Pseudomonas cepacia(PCL) and lipase B from Candida antarctica(CALB) immobilized on SBA-15[35].
2.2 固定化氧化还原酶
氧化还原酶是一种催化电子由一个分子(即还原剂,又叫氢受体或电子供体)传送至另一个分子(即氧化剂,又叫氢供体或电子受体)的酶。由于具有特殊的传递电子的性质,氧化还原酶在有机合成、生物降解、生物燃料电池及生物传感器等领域具有重要的应用价值。近年来,介孔材料对氧化还原酶的固定化也备受关注,已有多种氧化还原酶(如乙醇脱氢酶、单加氧酶、过氧化物酶、葡萄糖氧化酶(GOx)等)被成功地固载到介孔二氧化硅载体中[9]。Jung等[36]将GOx和氯过氧化物酶(CPO)共同固载在SBA-15和MCF介孔材料中,利用两种酶催化的串联反应来合成重要的药物中间体2-吲哚酮,反应过程见图5。
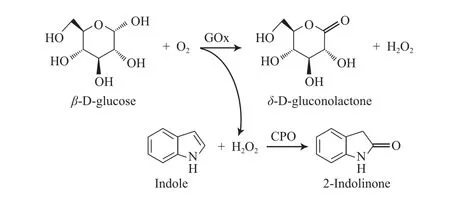
图5 共固定化于介孔材料中的GOx和CPO催化串联反应制备2-吲哚酮的过程[36]Fig.5 Oxidation of indole to 2-indolinone by cascade reaction using glucose oxidase(GOx) and chloroperoxidase(CPO) supported on mesoporous silica [36].
在该反应中,CPO为主酶,H2O2为氧化剂,催化吲哚转化为2-吲哚酮。而该过程中所需的H2O2可通过GOx催化的葡萄糖氧化反应进行原位再生。采用共固定化两种酶的方法,可有效地避免过量的H2O2对CPO的毒化作用,提高反应体系的催化效率和稳定性。同时,在进行适当的交联处理后,所得的共固定化酶的连续操作稳定性明显提高,可应用于固定床反应。
HRP也是一种常见的氧化还原酶,常被用于制备生物传感器及催化一系列有机反应,如N-和O-去烷基化反应、氧化耦合反应、选择性羟基化反应、氧原子转移反应等。Chouyyok等[37]将HRP固载到几种不同的介孔材料中,考察了体系的pH及载体的纳米孔结构对固定化HRP催化邻苯三酚氧化反应的影响。研究结果表明,固定化HRP在pH=8.0的体系中催化活性最适宜,且以MCF介孔材料为载体时,所得的固定化酶比以MCM-41和SBA-15介孔材料为载体时所得的固定化酶的稳定性更高。Phuoc等[38]研究了HRP和GOx在介孔材料中的共固定化,并以4-氨基安替比林和苯酚的偶联反应为模型反应,考察了HRP的催化性能(见图6)。在HPR催化反应过程中所需的H2O2氧化剂可以用GOx催化的葡萄糖氧化反应进行原位再生。研究结果表明,当HPR和GOx被共同固载在介孔二氧化硅纳米孔中后,两种酶的稳定性均得到明显提高,且与单一酶催化体系的活性相比,HRP和GOx在串联反应中的催化活性均没有明显下降。此外,他们还用血红蛋白替代HRP,所得的共固定化酶可以用来催化工业废水中常见的污染物多环芳烃(PAH)的氧化反应。他们发现以氧气为催化剂,当血红蛋白与GOx的摩尔比为1 000时,所得的共固定化酶可在常温常压下有效去除污水中的PAH(去除率为64%)。
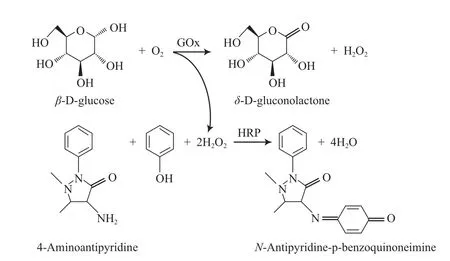
图6 共固定化在介孔二氧化硅中的GOx和HPR催化串联反应氧化4-氨基安替比林的过程[38]Fig.6 Oxidation of 4-aminoantipyridine through cascade reaction using GOx and horseradish peroxidase(HPR) encapsulated in mesoporous silica[38].
3 结语
酶的固定化能够实现酶的重复使用和连续化生产,同时可以改善酶的催化活性、稳定性和选择性,是现代生物技术及其工业化环节中的一项重要内容。氧化硅基有序介孔材料因其具有独特的孔结构和易于有机修饰改性的特点,是固定化酶的理想载体。一系列研究结果表明,当酶分子被固载到介孔材料中后,载体的孔径尺寸及纳米孔内的微环境会对固定化酶的活性和稳定性产生直接影响。因此对介孔材料进行理性设计和可控制备是获得具有高活性和高稳定的固定化酶的重要途径。利用聚合物大分子对介孔材料进行修饰有利于在纳米孔内模拟细胞中酶分子周围微环境的性质,从而提高固定化酶的催化性能,为解决生物催化剂工业应用瓶颈提供了一种新的手段。虽然目前有序介孔材料固定化酶的实际应用还较少,但其在生物柴油、生物质转化、手性药物及精细化学品合成、生物传感器、生物燃料电池、废水处理等领域具有广阔的应用前景。随着研究的不断深入,介孔材料固定化酶的使用将更加经济可行,表现出更多的传统化学催化所不可比拟的优越性。
[1] Tao Junhua,Kazlauskas R J. Biocatalysis for Green Chemistry and Chemical Process Development[M]. Hoboken:John Wiley & Sons,Inc,2011.
[2] Hartmann M,Jung D. Biocatalysis with Enzymes Immobilized on Mesoporous Hosts:The Status Quo and Future Trends[J].J Mater Chem,2010,20(5):844 - 857.
[3] Cao Linqiu. Carrier-Bound Immobilized Enzymes:Principles,Applications and Design[M]. Weinheim:WILEY-VCH,2008.
[4] Mateo C,Palomo J M,Fernandez-Lorente G,et al. Improvement of Enzyme Activity,Stability and Selectivity via Immobilization Techniques[J].Enzyme Microb Technol,2007,40(6):1451 - 1463.
[5] Hudson S,Cooney J,Magner E. Proteins in Mesoporous Silicates[J].Angew Chem,Int Ed,2008,47(45):8582 - 8594.
[6] Hanefeld U,Gardossi L,Magner E. Understanding Enzyme Immobilisation[J].Chem Soc Rev,2009,38(2):453 - 468.
[7] Diaz J F,Balkus K J. Enzyme Immobilization in MCM-41 Molecular Sieve[J].J Mol Catal B:Enzym,1996,2(2/3):115 - 126.
[8] Hartmann M,Xenia K. Immobilization of Enzymes on Porous Silicas-Bene fi ts and Challenges[J].Chem Soc Rev,2013,42(15):6277 - 6289.
[9] Zhou Zhou,Hartmann M. Progress in Enzyme Immobilization in Ordered Mesoporous Materials and Related Applications[J].Chem Soc Rev,2013,42(9):3894 - 3912.
[10] Lee Chia-Hung,Lin Tien-Sung,Mou Chung-Yuan. Mesoporous Materials for Encapsulating Enzymes[J].Nano Today,2009,4(2):165 - 179.
[11] Takahashi H,Li Bo,Sasaki T,et al. Catalytic Activity in Organic Solvents and Stability of Immobilized Enzymes Depend on the Pore Size and Surface Characteristics of Mesoporous Silica[J].Chem Mater,2000,12(11):3301 - 3305.
[12] Lykourinou V,Chen Yao,Vetromile C,et al. Immobilization of MP-11 into a Mesoporous Metal-Organic Framework,MP-11@mesoMOF:A New Platform for Enzymatic Catalysis[J].J Am Chem Soc,2011,133(27):10382 - 10385.
[13] Liu Jia,Lan Guojun,Peng Juan,et al. Enzyme Con fi ned in Silica-Based Nanocages for Biocatalysis in a Pickering Emulsion[J].Chem Commun,2013,49:9558 - 9560.
[14] Ma Hui,He Jing,Evans D G,et al. Immobilization of Lipase in a Mesoporous Reactor Based on MCM-41[J].J Mol Catal B:Enzym,2004,30(5/6):209 - 217.
[15] He Jing,Song Zhihong,Ma Hui,et al. Formation of a Mesoporous Bioreactor Based on SBA-15 and Porcine Pancreatic Lipase by Chemical Modification Following the Uptake of Enzymes[J].J Mater Chem,2006,16(44):4307 - 4315.
[16] Homouz D,Stagg L,Wittung-Stafshede P,et al. Macromolecular Crowding Modulates Folding Mechanism of Alpha/Beta Protein Apo fl avodoxin[J].Biophys J,2009,96(2):671 -680.
[17] Mukherjee S,Waegele M M,Chowdhury P,et al. Effect of Macromolecular Crowding on Protein Folding Dynamics at the Secondary Structure Level[J].J Mol Biol,2009,393(1):227 - 236.
[18] Tanizaki S,Clifford J,Connelly B D,et al. Conformational Sampling of Peptides in Cellular Environments[J].Biophys J,2008,94(3):747 - 759.
[19] Secundo F. Conformational Changes of Enzymes upon Immobilisation[J].Chem Soc Rev,2013,42(15):6250 - 6261.
[20] Rodrigues R C,Ortiz C,Berenguer-Murcia A,et al. Modifying Enzyme Activity and Selectivity by Immobilization[J].Chem Soc Rev,2013,42(15):6290 - 6307.
[21] Minton A P. The Effects of Volume Occupancy upon the Thermodynamic Activity of Proteins:Some Biochemcial Consequences[J].Mol Cell Biochem,1983,55(2):119 - 140.
[22] Zimmerman S B,Miton A P. Macromolecular Crowding:Biochemical,Biophysical and Physiological Consequence[J].Annu Rev Biophys Biomol Struct,1993,22:27 - 65.
[23] Ping Guanghui,Yuan Jianmin,Sun Zhengfei,et al. Studies of Effects of Macromolecular Crowding and Con fi nement on Protein Folding and Protein Stability[J].J Mol Recognit,2004,17(5):433 - 440.
[24] Liu Jia,Peng Juan,Shen Shuai,et al. Enzyme Entrapped in Polymer-Modified Nanopores:Macromolecular Crowding Effect[J].Chem Eur J,2013,19(8):2711 - 2719.
[25] Park M,Park S S,Selvaraj M,et al. Hydrophobic Mesoporous Materials for Immobilization of Enzymes[J].Microporous Mesoporous Mater,2009,124(1/3):76 - 83.
[26] Carrasco M S,Rad J C,Gonzalez-Carcedo S. Immobilization of Alkaline Phosphatase by Sorption on Na-Sepiolite[J].Bioresour Technol,1995,51(2/3):175 - 181.
[27] Galarneau A,Mureseanu M,Atger S,et al. Immobilization of Lipase on Silicas:Relevance of Textural and Interfacial Properties on Activity and Selectivity[J].New J Chem,2006,30(4):562 - 571.
[28] Liu Jia,Bai Shiyang,Jin Qianru,et al. Improved Catalytic Performance of Lipase Accommodated in the Mesoporous Silicas with Polymer-Modified Microenvironment[J].Langmuir,2013,28(25):9788 - 9796.
[29] Liu Jia,Bai Shiyang,Jin Qianru,et al. Enhanced Thermostability of Enzymes Accommodated in Thermo-Responsive Nanopores[J].Chem Sci,2013,3(12):3398 - 3402.
[30] Liese A,Hilterhaus L. Evaluation of Immobilized Enzymes for Industrial Applications[J].Chem Soc Rev,2013,42(15):6236 - 6249.
[31] Chang R H,Jang J,Wu K C W. Cellulase Immobilized Mesoporous Silica Nanocatalysts for Ef fi cient Cellulose-to-Glucose Conversion[J].Green Chem,2011,12(10):2844 - 2850.
[32] Salis A,Casula M F,Bhattacharyya M S,et al. Physical and Chemical Lipase Adsorption on SBA-15:Effect of Different Interactions on Enzyme Loading and Catalytic Performance[J].ChemCatChem,2012,24(3):322 - 329.
[33] Itoh T,Nishimura Y,Ouchi N,et al. 1-Butyl-2,3-Dimethylimidazolium Tetrafluoroborate:The Most Desirable Ionic Liquid Solvent for Recycling Use of Enzyme in Lipase-Catalyzed Transesterification Using Vinyl Acetate as Acyl Donor[J].J Mol Catal B:Enzym,2003,26(1/2):41 - 45.
[34] Itoh T,Ouchi N,Nishimura Y,et al. Novel Supporting Materials of Lipase PS Suitable for Use in an Ionic Liquid Solvent System[J].Green Chem,2003,5(5):494 - 496.
[35] Zheng Liangyu,Zhang Suoqin,Zhao Lifang,et al. Resolution ofN-(2-Ethyl-6-Methylphenyl)Alanine via Free and Immobilized Lipase from Pseudomonas Cepacia[J].J Mol Catal B:Enzym,2006,38(3):119 - 125.
[36] Jung D,Streb C,Hartmann M. Oxidation of Indole Using Chloroperoxidase and Glucose Oxidase Immobilized on SBA-15 as Tandem Biocatalyst[J].Microporous Mesoporous Mater,2008,113(1/3):523 - 529.
[37] Chouyyok W,Panpranot J,Thanachayanant C,et al. Effects of pH and Pore Characters of Mesoporous Silicas on Horseradish Peroxidase Immobilization[J].J Mol Catal B:Enzym,2009,56(4):246 - 252.
[38] Phuoc L T,Laveille P,Chamouleau F,et al. Phospholipid-Templated Silica Nanocapsules as Ef fi cient Polyenzymatic Biocatalysts[J].Dalton Trans,2010,39(36):8511 - 8520.
(编辑 李明辉)
Research Progress and Application Prospect of Enzyme Immobilization on Mesoporous Silica-Based Materials
Liu Jia1,2,Yang Qihua1
(1. Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian Liaoning 116023,China;2. School of Chemistry and Chemical Engineering,University of Chinese Academy of Sciences,Beijing 100029,China)
This paper reviewed the current status of the development of enzyme immobilization on mesoporous silica-based materials,in particular with focus on the main factors(pore diameter and nanopore microenvironment) influencing the catalytic properties of enzymes immobilized in nanopores of mesoporous supports. The application prospect of the immobilized enzymes in biodiesel production,biomass conversion,synthesis of fi ne chemicals and chiral pharmaceuticals,fabrication of biofuel cells and biosensors was also discussed using hydrolase and oxidoreductase as model enzymes.
biocatalysis;mesoporous silica-based materials;enzyme immobilization
1000 - 8144(2014)04 - 0357 - 07
TQ 426.97
A
2013 - 09 - 10;[修改稿日期]2013 - 12 - 26。
刘佳(1986—),女,河南省新乡市人,博士,电话0411 - 84379219,电邮 jialiu@dicp.ac.cn。联系人:杨启华,电话0411 - 84379552,电邮 yangqh@dicp.ac.cn。
国家自然科学基金资助项目(21273226)。
研究与开发
