离子液体促进剂对气体水合物生成液表面张力的影响
2014-10-09王树立赵苗苗周诗岽蔡道飞
王树立,张 琳,赵苗苗,周诗岽,蔡道飞,李 平
(1.常州大学石油工程学院,江苏 常州 213016;2.中国石化管道储运分公司,江苏 徐州 221008)
气体水合物(简称水合物)即气体分子和水分子在高压低温条件下相互作用而形成的一种不具有固定化学计量的笼形晶体化合物,水分子通过氢键连接在外围形成冰状的空腔结构,气体分子受到范德华力的约束填充于在网络孔穴中,空的气体水合物晶格是高效的分子水平的气体储存器[1]。许多基于气体水合物的新技术纷纷出现:混合气体分离技术[2]、水合物法储运天然气技术、CO2捕集技术[3]、工业废水处理和回收、住宅空调蓄冷技术以及海水淡化技术。这些新技术都需要以气体水合物高效生成为前提,然而现有的气体水合物生成速率低、储气密度不高。研究证明,添加表面活性剂可以有效解决以上问题。十二烷基硫酸钠(SDS)、十二烷基苯磺酸钠(SDBS)、十六烷基三甲基溴化铵(CTAB)等是研究较为广泛的促进剂[4-7],近几年,新型的Gemini表面活性剂以其超强的表面活性被广泛应用[8]。但由于表面活性剂种类繁多,性能也不同,表面活性剂的优势比较单一,效果仍不理想,无法直接应用于工业生产,故仍需继续开发更有效的水合物促进剂。
表面活性剂的促进机理仍存在争议,一种假设为表面活性剂可以大量形成胶束包裹客体分子从而促进水合物生成[9];另一种理论是表面活性剂降低反应溶液的表面张力,使气体和液体分子充分接触,进而加速了水合物的形成[10]。为揭示表面活性剂作用于水合物生成促进的真正原理,笔者以自制离子液体水合物促进剂,测定了275~283K 含[MIMPS]DBSA、[PIPS]DBSA、[PYPS]DBSA的水合物反应液的表面张力,得到其随浓度和温度的变化特点和不同水合物反应液的CMC,分析了离子液体水合物生成的机理,为建立含表面活性剂因子的水合物动力学模型提供依据。
1 实 验
1.1 试剂与装置
1-(3-磺酸基)丙基-3-甲基咪唑十二烷基苯磺酸盐([MIMPS]DBSA),w≥90.0%;1-(3-磺酸基)丙基吡咯烷十二烷基苯磺酸盐([PYPS]DBSA),w≥90.0%;1-(3-磺酸基)丙基哌啶十二烷基苯磺酸盐([PIPS]DBSA),w≥90.0%,自制。
TG-328A电光分析天平,使用精度为0.001 g,上海越平科学仪器有限公司;K11型全自动表面张力仪;t型热电偶为精度±0.05K的标准热电阻。
1.2 实验操作
表面张力采用 Wilhelmy盘法测定,测量前检查铂金板及溶液润湿情况,确保接触角为零,并选用去离子水校准,测得298K时表面张力为72.02mN/m。
实验前使用电光分析天平称量并配制离子液体水合物促进剂,将1-甲基咪唑(吡咯烷或哌啶)与1,3-丙烷磺酸内酯反应接入磺酸基团形成内鎓盐,用乙酸乙酯洗涤处理烘干后溶于水,加入十二烷基苯磺酸,经加热、过滤、蒸馏、提纯后得到具有表面活性功能的离子液体。将离子液体溶于水,得到浓度范围为100~900mN/m的水溶液。
对已配置好的溶液进行低温处理,开启恒温水浴温度和水循环系统,温度控制在275~283 K,使用t型热电偶插入测量室实时监测被测样品温度。测量时,感测铂金板浸入被测液体受到表面张力的作用,受力向下运动,当液体表面张力及其他相关的力与平衡力达到平衡时,铂金板停止运动。此时,得到液体的表面张力值,为保证测量准确性,每组工况重复操作2~3次。
2 结果与分析
2.1 [MIMPS]DBSA对水合物反应液表面张力的影响
气体水合物形成需要低温高压的条件,由于压力对表面张力的影响很小,因此实验忽略压力影响[11]。图1为各温度下[MIMPS]DBSA随浓度变化的情况。[MIMPS]DBSA可以大幅度降低水合物反应液的表面张力,随着[MIMPS]DBSA浓度c的增大,表面张力持续降低。这是由于离子液体具有表面活性,根据Gibbs公式,在恒温恒压下,当溶液浓度很小时,可用浓度c代替活度α2,即得可知,具有表面活性的物质吸附量为正,则的值为负,即表面张力随溶液浓度升高而降低。
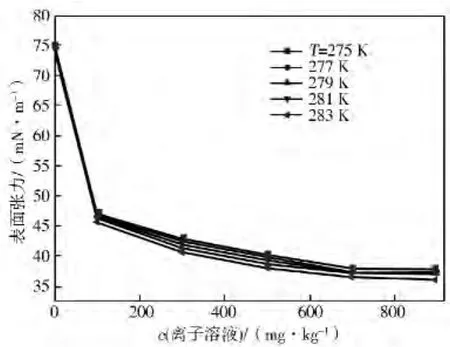
图1 含[MIMPS]DBSA水合物反应液表面张力随浓度的变化
由图1可知:浓度在0~100mg/kg区间,表面张力急剧降低,表面张力平均降幅达33.3%;浓度在300~700mg/kg区间,表面张力降低幅度减小,dγ/dc变小,平均降幅为21.3%。浓度≥700mg/kg时,表面张力仍有降低,但降低幅度很小,曲线趋于平缓;在≥900mg/kg后,表面张力增幅不超过0.013%,水合物反应液表面张力为(37.2±0.5)mN/m。由此确定含有[MIMPS]DBSA的水合物反应液CMC为900mg/kg,最多降低表面张力50.2%。
图2为含[MIMPS]DBSA水合物反应液表面张力与温度的关系。
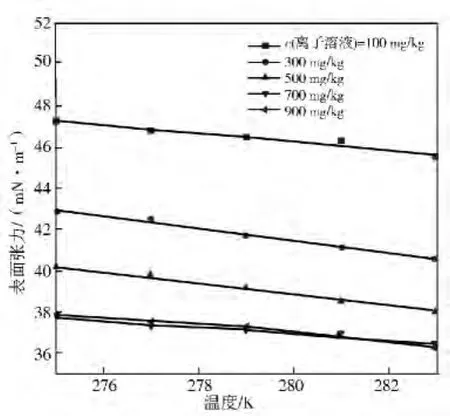
图2 含[MIMPS]DBSA水合物反应液表面张力与温度的关系
由图2结合表面热力学理论和线性拟合结果(图2虚线)得出表面张力与温度之间基本成线性关系,可由式(1)描述。

随着温度的升高,表面张力有所降低。在275~283K,温度对表面张力影响不大。从图1、图2可知:溶液浓度是影响含[MIMPS]DBSA水合物反应液表面张力的主导因素。因超过700 mg/kg后,水合物反应液表面张力降低效果很小。综合考虑用量和效果,以c=700mg/kg为最佳浓度。
2.2 [PIPS]DBSA 与[PYPS]DBSA 对水合物反应液表面张力的影响
对[PIPS]DBSA和[PYPS]DBSA 采取相同测量办法,得到水合物生成温度条件下含[PIPS]DBSA和[PYPS]DBSA的水合物反应溶液表面张力的变化曲线。由图3可知:加入[PIPS]DBSA后,反应溶液的表面张力明显下降,最大降幅达到51.2%。由曲线变化情况可知,水合物反应液表面张力变化分3个阶段,溶液浓度≤100 mg/kg阶段,表面张力下降速度快,dσ/dc变化大,处于该区间的[PIPS]DBSA对水合物生成诱导期的影响效果也最为明显。在100~300mg/kg区间,表面张力下降速率比第一区间有所缩短,但仍有19.6%的减小;当浓度为300~900 mg/kg时,表面张力仍有降低,但变化程度很微小,由曲线走势判断,[PIPS]DBSA的CMC≥1200mg/kg。
浓度一定时,含[PIPS]DBSA水合物反应溶液的表面张力随温度的关系如图4所示。由图4可以看出:在275~283K,表面张力随温度变化比较平缓,总体呈随温度升高而下降趋势,基本是线性减函数关系。
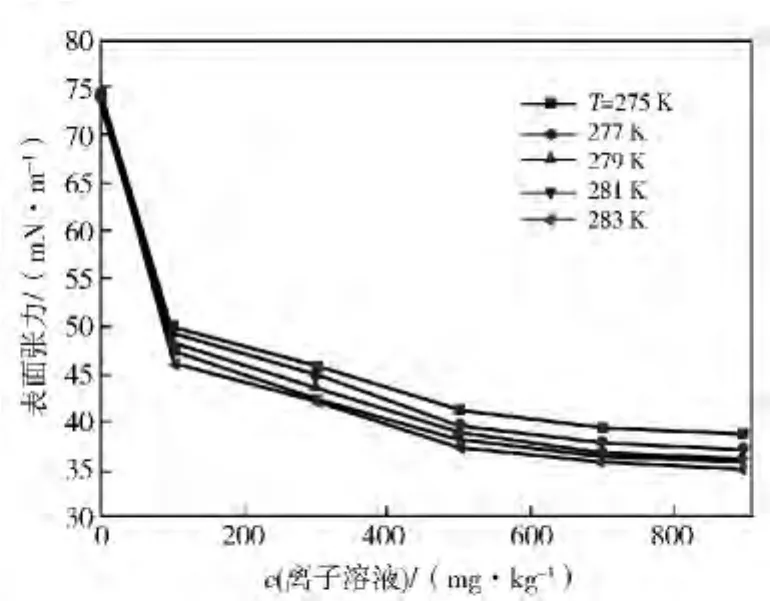
图3 含[PIPS]DBSA水合物反应液表面张力与浓度的关系
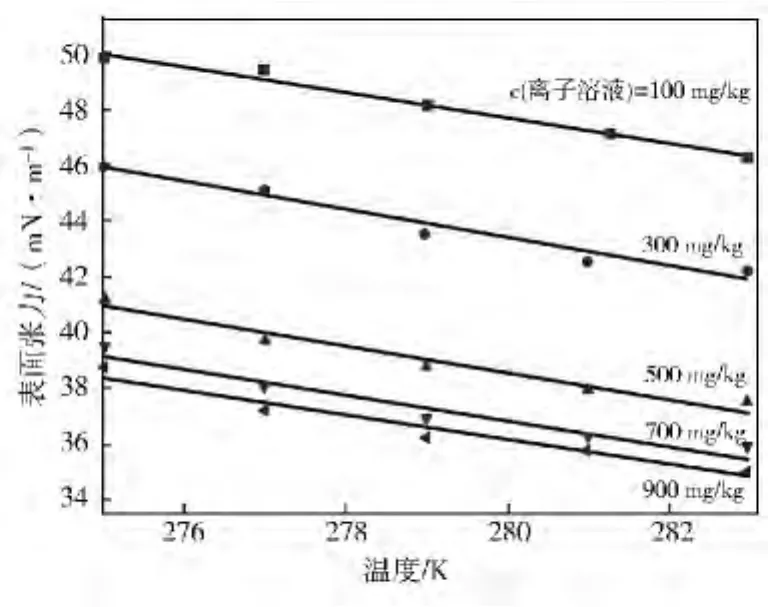
图4 含[PIPS]DBSA水合物反应液表面张力与温度的关系
图5、图6为[PYPS]DBSA水合物反应液表面张力随浓度和温度变化情况。由图5、图6可以看出:温度一定时,[PYPS]DBSA 与[PIPS]DBSA的表面张力有相同的变化趋势。第一阶段表面张力降低36.3%;第二阶段在100~500mg/kg区间,表面张力降低22.7%;第三阶段,表面张力变化没有明显减少,变化幅度≤0.057%,依次判断[PIPS]DBSA的CMC为700mg/kg。含[PYPS]DBSA的水合物反应液的表面张力最低为34.5mN/m,比无添加剂情况下降低53.06%。
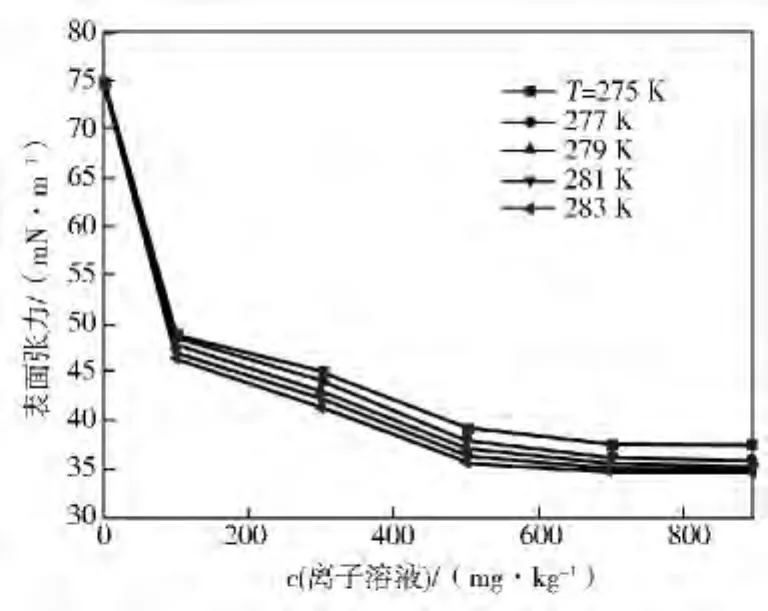
图5 含[PYPS]DBSA水合物反应液表面张力随浓度的变化
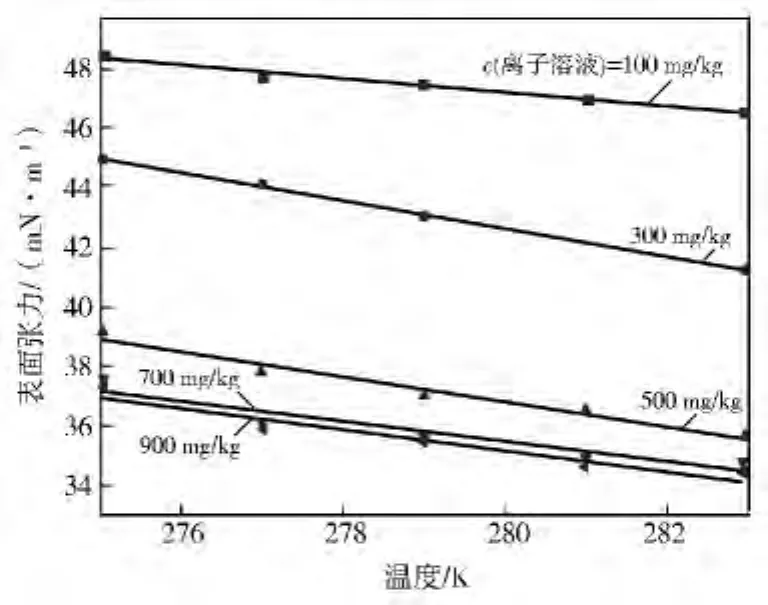
图6 含[PYPS]DBSA水合物反应液表面张力与温度的关系
2.3 3种离子液体对降低水合物反应溶液表面张力的效果对比
低温高压是气体水合物形成的必要条件,故在279K下,对比3种离子液体对降低水合物反应体系表面张力的效果,其表面张力曲线见图7。由图7可见:c<400mg/kg的[MIMPS]DBSA有较好的表面活性,降低溶液表面张力的效果好于其他两种;随浓度增加,表面张力浓度梯度dγ/dc减小。在c>500mg/kg时,[PYPS]DBSA和[PIPS]DBSA降低水合物反应液的表面张力好于[MIMPS]DBSA。总体来看,三者都能有效的降低水合物反应液的表面张力,作用效果相差不大。
图7中,在微量的表面活性剂浓度区间,水合物反应液的表面张力迅速下降,随着浓度的升高,表面张力降低趋势有所减缓,但仍持续降低。与无添加剂的反应体系相比,含有[PIPS]DBSA、[MIMPS]DBSA和[PYPS]DBSA的水合物反应液表面张力平均降低51.64%。其中,表面张力最低的为[PYPS]DBSA溶液,在CMC浓度时,表面张力为35.4mN/m。通常气体水合物首先形成于气-液界面处,由于气-液界面处的成核Gibbs自由能比较小,因为吸附作用界面处主体、客体分子浓度都较高,利于分子簇的生长。然而,气体分子在进入液相时会受到表面张力的阻碍,减小水合物反应液的表面张力可以有效降低水合物形成阻力,减少诱导时间,增大生成速率和储气密度。从这一角度出发,[PYPS]DBSA为强化水合物生成的最优促进剂,最佳促进剂浓度为700 mg/kg。
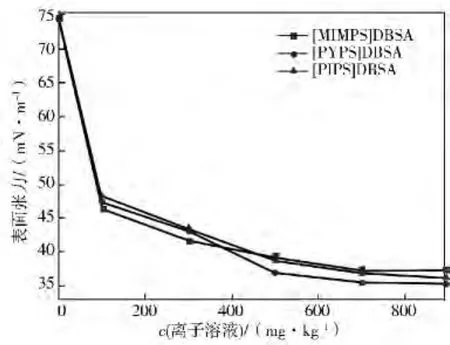
图7 含不同离子液体的水合反应溶液表面张力
3 离子液体对气体水合物生成溶液表面熵、表面焓的影响
对含离子液体的水合物生成溶液的表面张力进一步分析,得到生成溶液表面焓(表面能Es)与表面熵等热力学性质,表面张力是增加单位面积时表面相内内能、焓和自由能的增值,对于一元溶液体系,dF=-SdT+σdA,由此可得溶液的表面熵和表面焓的表达式(2)(3)。
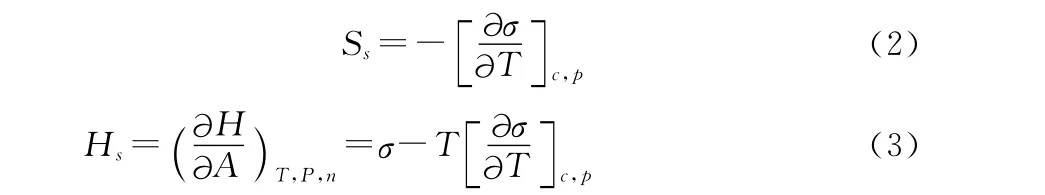
式中:Ss—溶液的表面熵,mJ/(m2·K1);T—溶液温度,K;c—离子液体浓度,mg/kg;p—实验体系压力,MPa;Hs—溶液的表面焓,mJ/m 。
表1是不同浓度的离子液体表面熵Ss、表面焓Hs的值。
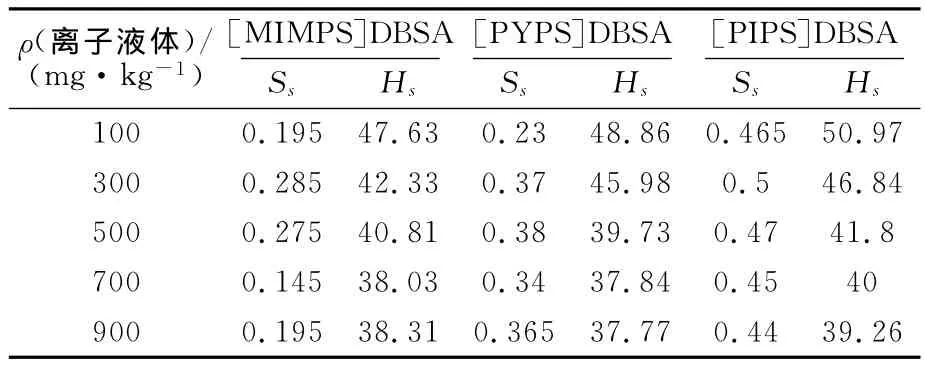
表1 离子液体的表面熵Ss、表面焓Hs
图8、图9分别是含有3种离子液体的水合物生成溶液表面熵Ss、表面能Hs。
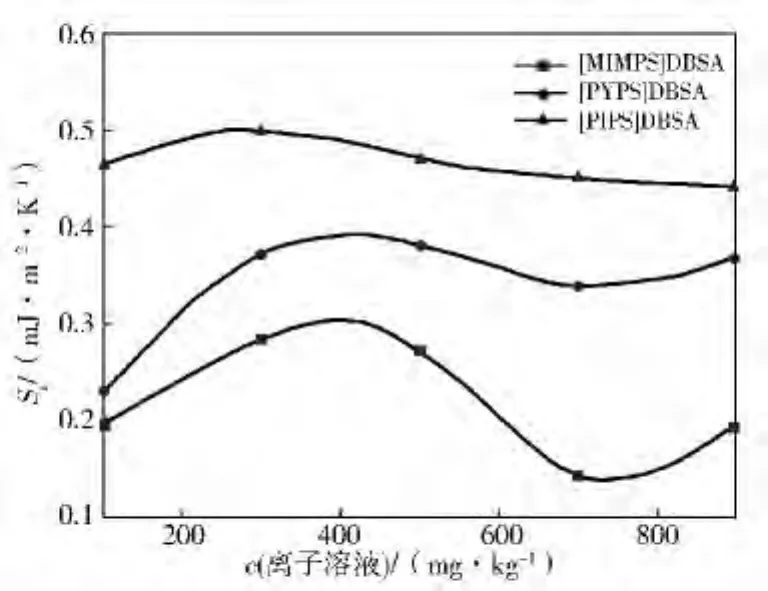
图8 含离子液体的水合物反应溶液表面熵Ss
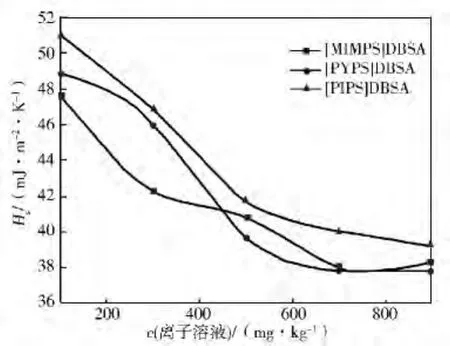
图9 含离子液体的水合物反应溶液表面焓Hs
由表1和图8、图9可见:浓度对3种离子液体的Ss和Hs影响很大。随着浓度的增大,[MIMPS]DBSA 和[PYPS]DBSA 的Ss先上升在下降,当浓度c>700mg/kg,又开始增大。[MIMPS]DBSA溶液的Ss变化幅度最大,且能达到三者中的最小值,[PIPS]DBSA的Ss随浓度的增加有先增后减的趋势,但变化比较平缓,说明[PIPS]DBSA的表面熵对浓度的敏感性较低。由图9可知:加入3种离子液体水合物反应液的Hs大幅度降低,Hs随浓度的增加先是明显下降后趋于平缓。其中,[PIPS]DBSA溶液的表面焓最大,c<500mg/kg时[MIMPS]DBSA溶液的表面焓最小;c超过500mg/kg后[PYPS]DBSA 表面焓快速下降,低于[MIMPS]DBSA。从分子组成来看,[MIMPS]DBSA、[PYPS]DBSA 和[PIPS]DBSA的分子中H原子逐渐增多,Ss和Hs的值也随之增大。
根据水合物成核成簇模型[12],将水合物成核过程分为几个阶段:首先水分子围绕在气体分子周围形成不稳定簇,不稳定簇通过点-点或面-面连接形成亚稳团聚体,同时,亚稳团聚体也会缩变回不稳定簇,亚稳团聚体不断聚集形成稳定的晶核,整个过程可用式(4)表示。
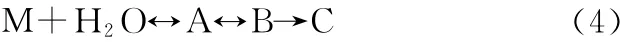
式中:M—气体分子;A、B、C—不稳定簇、亚稳团聚体和晶体。
结合化学反应过渡态理论,水合物反应中间状态A和B即为活化络合物,显然活化络合物的浓度越高,能生成的反应产物就越多,所以,反应速率K应该与活化络合物浓度成正比,即C=Kc[A]。反应速率K=PZe-E/RT,此处Z为单位浓度时分子碰撞频率,E为系统内能,P为几率因素,P∝eΔS/R,ΔS=S∞-S0,S∞为生成物活化熵,S0为反应物活化熵,向水合物反应溶液中加入离子液体促进剂,能有效降低水合物生成原液的活化熵,使得反应的活化熵ΔS增大,反应几率因素P变大,则反应速率K就随之增大,这样不稳定的活化络合物转化成水合物晶体的速率增大,即提高气体水合物生成速率,促进水合物生成。
4 结 论
a.在水合物生成条件下,[MIMPS]DBSA、[PIPS]DBSA 和[PYPS]DBSA 3种具有表面活性剂的离子液体均能有效降低水合物反应溶液的表面张力,减小水合物生成体系的表面熵和表面焓,提高气体水合物生成速率。
b.在275~283K的温度条件下,水合物反应液的表面张力随浓度变化明显,其临界胶束浓度分别为900,1200和700mg/kg,大幅度降低了水合物反应体系的表面张力,与不含添加剂的水合物体系相比,表面张力平均降低了51.64%。
c.在CMC浓度范围内,275~283K条件下,三者表面张力受体系温度影响不大,加入少量即能得到较低的表面张力,且水合物分解后反应试剂可以重复使用,为水合物强化生成提供了可靠的选择。
d.降低体系表面张力是离子液体促进水合物生成的重要原因,也是开发新的水合物促进剂时需要考虑的因素;引入体系表面熵Ss和表面焓Hs的概念关联水合物生成速率,为建立含有表面活性剂因素的水合物动力学模型提供一种思路。
[1]陈光进,孙长宇,马庆兰.气体水合物科学与技术[M].北京:化学工业出版社,2007:1-4.
[2]唐建峰,陈玉亮,王林,等.水合物法分离CO2与N2混合气的实验[J].天然气工业,2010,30(9):113-116.
[3]孙肖媛,王金渠,鲁金明,等.混合添加剂对水合物膜法捕集CO2的影响[J].膜科学与技术,2012,32(6):44-49.
[4]Sun C Y,Li W Z,Yang X,et al.Progress in research of gas hydrate[J].Chinese Journal of Chemical Engineering,2011,19(1):151-162.
[5]周诗岽,王树立,张国忠.十六烷基三甲基溴化铵促进剂CO2水合物生成的实验研究[J].现代化工,2013,33(2):60-65.
[6]王海秀,王树立,武雪红,等.SDBS的表面张力对天然气水合物生成的影响[J].应用化工,2007,36(12):1169-l175.
[7]李玉星,朱超,王昌武.表面活性剂促进CO2水合物生成的实验及动力学模型[J].石油化工,2012,41(6):699-703.
[8]刘国宇,顾大明,刘海燕,等.系列离子液体型Gemini咪唑表面活性剂在水溶液中的分子动力学模拟[J].化学学报,2012,70(1):6-14.
[9]Zhong Y,Rogers R E.Surfactant effect on gas hydrate formation[J].Chemical Engineering Science,2000,55(19):4175-4187.
[10]孙长宇,陈光进,郭天民.水合物成核动力学研究现状[J].石油学报,2001,22(4):82-87.
[11]Massoudi R,King A D.Effect of pressure on the surface tension of water.Adsorption of low molecular weight gases on water at 25.deg[J].J Hys Chem,1974,78(22):2262-2266.
[12]Sloan E D,Fleyfel F A.Molecular mechanism for gas hydrate nucleation from ice[J].Aiche Journal,1991,37(9):1281-1292.
