多孔纤维状氧化铁的制备及其对染料的吸附特性研究
2014-10-09曾成华廖学品
曾成华, 杨 凡, 林 海, 廖学品
(1.攀枝花学院资源与环境工程学院,四川攀枝花617000; 2.云南省产品质量监督检验研究院,云南昆明650223;3.四川大学制革清洁技术国家工程实验室,四川成都610065)
神奇的染料把我们的生活点缀得五彩缤纷,但印染工业排放大量的废水也带来了环境污染问题.据不完全统计,全国印染废水每天排放量为3×106~4×106m3.染料废水量大、有机污染物含量高、水质变化大,属难处理的工业废水之一.染料中的芳环物质和重金属可在人体富集,使人的泌尿系统、生殖系统等受到严重损害,同时废水中的大量有机物可使水体富营养化,将严重影响水体生物生存及人类的正常生产生活[1-4].因此,染料废水的处理是环境保护的重要任务.
目前,用于印染废水处理的主要方法有物化法(絮凝沉降、吸附)、生化法、化学法(电解、氧化)等[5-7].对低浓度染料废水,吸附法是最有效和最经济的处理方法[8-10].国内外研究者们将各种廉价的物质(如粉煤灰、作物秸秆等)经过物理化学处理制得吸附材料来处理印染废水,但吸附容量不高,吸附和解吸速度慢[11-16].因此,研究开发高效吸附材料仍然是吸附法处理染料废水的重要课题.研究发现,金属氧化物或负载金属离子的吸附材料对阴离子染料表现出较高的吸附容量,且易于解吸和重复使用[17].
另一方面,制革工业每年将产生大量的固体废弃物,俗称废皮渣,为纤维状的皮胶原蛋白[18].我国每年产生这类废弃物约1.4×106t,除了很少一部分用于生产明胶和再生革外,大部分都被作为垃圾处理,既浪费了资源,又污染了环境[19].皮胶原纤维可生物降解,亲水但又不溶于水[20].此外,皮胶原纤维具有特殊的空间结构和化学反应特性,其分子结构中含有大量的—COOH、—OH、—NH2等活性基团,可与Fe3+、Al3+、Zr4+等多种金属离子反应.本文以皮胶原纤维为模板,利用它天然的纤维结构,将三价铁与胶原纤维反应后再经高温煅烧,去除胶原纤维模板后制备多孔纤维状氧化铁吸附材料,并用于水体中染料的吸附.
1 实验部分
1.1 试剂与仪器

1.1.1 试剂 酸性嫩黄G(Acid Yellow 11,质量分数99.5%,E080326),萨恩化学技术(上海)有限公司;罗丹明B(Rhodamine B),成都市新都区木兰镇工业开发区;酸性嫩黄G和罗丹明B的分子结构如图1所示.Fe2(SO4)3,成都科龙化工试剂厂.皮胶原纤维,自制.
1.1.2 仪器 扫描电子显微镜FESEM(JSM-5900LV,日本电子株式会社);比表面/孔隙度分析仪(TriStar3000V6.03A,美国 Micromeritics公司);紫外分光光度计(UV-2510PC,日本岛津).
1.2 材料
1.2.1 皮胶原纤维的制备 以废皮渣为原料制备胶原纤维[21].不含铬废皮渣经水洗除去杂质后,用1.5倍皮渣重、质量分数为3.5%的醋酸溶液洗涤,脱除皮渣中的矿物质,重复3次;再用冰醋酸-醋酸钠缓冲溶液调节皮渣的pH值至4.8~5.0;用无水乙醇脱水后,减压干燥至水分≦10%,研磨过筛得粒度为10~20目的胶原纤维,其水分含量不超过12%,灰分不超过0.3%,pH值在5.0~5.5的范围内.
1.2.2 多孔纤维状氧化铁的制备 将5 g皮胶原纤维、0.2 g NaCl置于三口烧瓶中,加入400 mL蒸馏水浸泡4 h,再用硫酸和甲酸的混合溶液(H2SO4∶HCOOH=1∶1)调其pH值至1.5~2.0,加入6 g Fe2(SO4)3,在室温(25±5)℃下搅拌反应8 h,然后用质量分数10%NaHCO3溶液将反应体系的pH值缓慢调至4.2左右;升高反应温度至45℃,继续反应4 h;取出反应物,用蒸馏水充分洗涤后过滤,于50℃下真空干燥12 h,再经550℃下高温煅烧即得到多孔纤维状氧化铁吸附材料.
1.3 实验方法
1.3.1 pH值对吸附平衡的影响 取若干个25 mL质量浓度为300 mg/L的酸性嫩黄G或罗丹明B溶液置于具塞三角瓶中,用0.1 mol/L的NaOH溶液或0.1 mol/L的H2SO4溶液将染料溶液的pH值分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,分别加入0.05 g多孔纤维状氧化铁,在温度为303 K的水浴中振荡吸附24 h.过滤去除多孔纤维状氧化铁,测定吸附后溶液中染料的质量浓度ce并按(1)式计算平衡吸附量qe,考查pH值对平衡吸附量的影响.

式中,qe/(mg/g)为平衡吸附量;v/mL为溶液体积;c0/(mg/L)和ce/(mg/L)为吸附初始和平衡时染料的质量浓度;w/g为吸附材料的质量.
1.3.2 吸附平衡 取若干25 mL初始质量浓度分别为100、200、300、400、500 和 600 mg/L 的酸性嫩黄G溶液置于具塞三角瓶中,将溶液的pH值均调为3.0,分别加入0.05 g的多孔纤维状氧化铁,在303、313和323 K的水浴中振荡吸附24 h.过滤去除多孔纤维状氧化铁,测定吸附后溶液中酸性嫩黄G的质量浓度ce,并按(1)式计算平衡吸附量qe.
1.3.3 吸附动力学 取25 mL初始质量浓度分别为100、300和500 mg/L的酸性嫩黄G溶液置于具塞三角瓶中,将溶液的pH值均调为3.0,分别加入0.05 g的多孔纤维状氧化铁,在温度为303 K的水浴中振荡吸附并定时取样分析溶液中染料的质量浓度,并按(2)式计算t时刻的吸附量qt.

式中,qt/(mg/g)为时间t时的吸附量;v/mL为溶液体积;c0/(mg/L)和ct/(mg/L)分别为吸附初始和时间t时酸性嫩黄G的质量浓度;w/g为吸附材料的质量.
1.3.4 解吸与再吸附 称取4份0.05 g多孔纤维状氧化铁置于25 mL初始质量浓度为400 mg/L的酸性嫩黄G溶液中,调节溶液的pH值至3.0,在温度为303 K的水浴中振荡吸附达吸附平衡后,测定吸附后溶液中酸性嫩黄G的质量浓度,并计算吸附量.再将吸附了酸性嫩黄G的吸附材料分别置于20 mL浓度均为0.1 mol/L的Na2CO3、NaOH、乙醇和丙酮溶液中于温度为303 K的水浴中振荡解析6 h,测定解吸后溶液中酸性嫩黄G的质量浓度,计算解吸率.

式中,v1/mL为吸附前酸性嫩黄G溶液的体积;c0/(mg/L)和ce/(mg/L)分别为吸附初始和平衡时酸性嫩黄G的质量浓度;v2/mL和c2/(mg/L)分别为解吸液的体积和酸性嫩黄G的质量浓度.
2 结果与讨论
2.1 多孔纤维状氧化铁的比表面积、孔径、孔容比表面积、孔径、孔容是表征吸附剂孔隙结构的重要参数.本文采用Micromeritics TriStar3000V6.03A型比表面积/孔隙度分析仪,在-200℃条件下,以N2为吸附气、H2为吸附载气,用多点BET法测定不同氮气相对分压p/p0值对应的N2吸附量,得到比表面积及氮气吸附曲线如图2所示,根据BJH公式计算孔径分布,测得多孔纤维状氧化铁的比表面积、平均孔径、孔容分别为45.91 m2/g、11.601 nm和0.159 61 cm3/g.
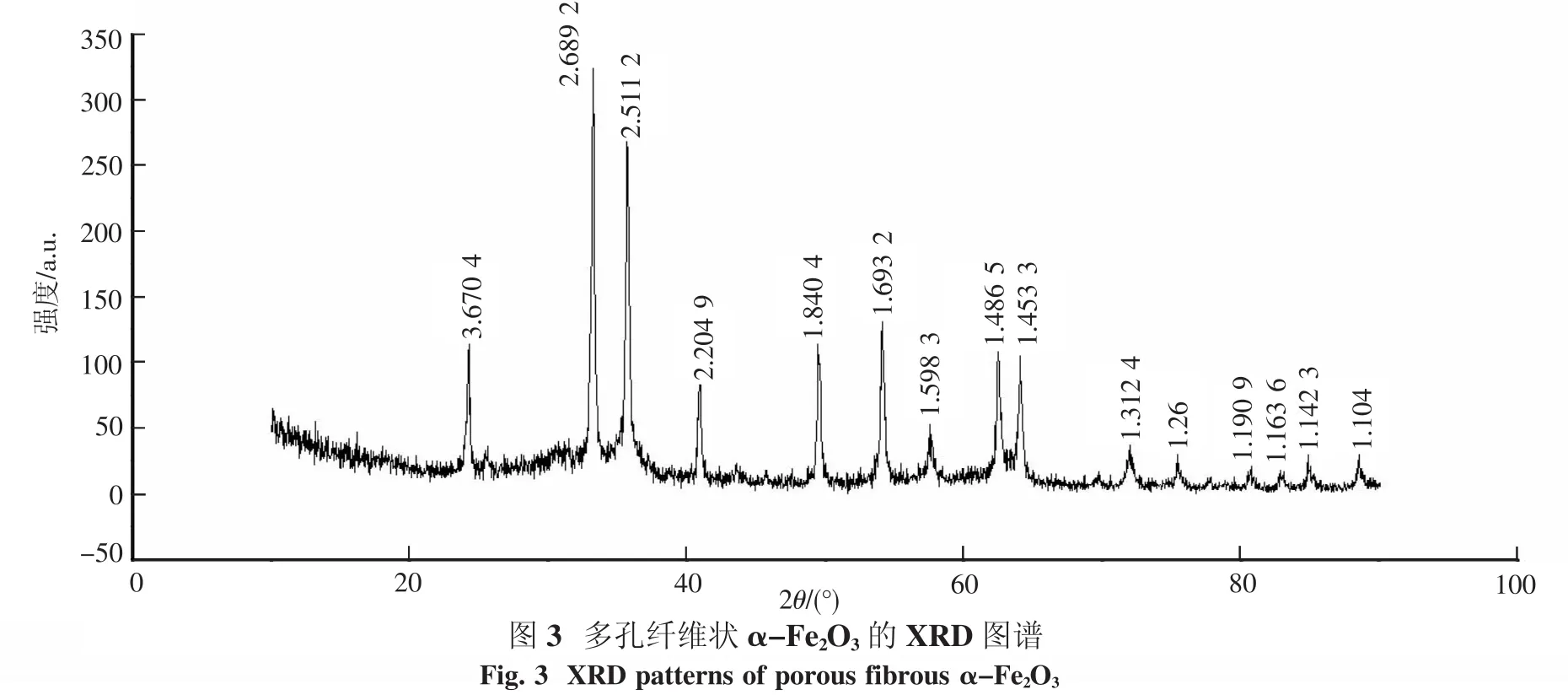
2.2 X射线衍射分析多孔纤维状氧化铁的XRD分析结果如图3所示.结果表明,样品的衍射峰对应的晶面间距d值与PDF卡片86-0550号一一对应,而且图中无其它杂质晶相衍射峰存在,说明样品为纯α-Fe2O3晶相,且结晶程度较高.
2.3 孔纤维状氧化铁的FESEM形貌表征图4为多孔纤维状氧化铁吸附材料的FESEM图像.从图4可以看出,所制备的α-Fe2O3的纤维状结构较明显.这表明,Fe(III)与胶原纤维反应并经高温煅烧后所得到的α-Fe2O3复制了胶原纤维模板的结构,胶原纤维可以作为模板制备多孔金属氧化物纤维.研究表明,纤维状的吸附材料由于传质阻力较低,因此具有较快的吸附速度[22].
2.4 pH值对吸附平衡的影响pH值对多孔纤维状氧化铁吸附染料的影响如图5所示.在pH值为3.0~10.0范围内,多孔纤维状氧化铁对酸性嫩黄G有较高的平衡吸附量,而对罗丹明B的吸附作用很弱.因此,该类吸附材料可能只适合于酸性染料的吸附.顾迎春[23]的研究也表明,皮胶原纤维固载Zr(IV)对阴离子型染料的吸附容量较高,而对阳离子型染料的吸附容量较低.在酸性条件下,酸性嫩黄G的吸附容量更高.这可以从罗丹明B和酸性嫩黄G的分子结构式(图1)进行分析,罗丹明B为阳离子型染料,在水中离解为带—N+R3基团的阳离子,而酸性嫩黄G为阴离子型染料,在水中离解为带—SO3-基团的阴离子.在酸性条件下,H+富集在多孔纤维状氧化铁表面,吸附材料通过静电吸引作用对染料阴离子进行吸附,随着pH值的升高,体系中的H+减少,OH-增加,这使得吸附材料对阴离子型染料的吸附作用减弱[24].当pH>3,多孔纤维状氧化铁对酸性嫩黄G的吸附逐渐减弱,吸附量也逐渐降低.因此,后续研究集中考查pH=3.0时多孔纤维状氧化铁对阴离子型染料的吸附特性.

2.5 吸附平衡从图6可以看出,随酸性嫩黄G平衡质量浓度的增加,多孔纤维状氧化铁对其平衡吸附量也在增加,特别是在低质量浓度范围内,平衡吸附量增加较明显.以温度T=323 K的吸附等温线为例,当平衡质量浓度从8.4 mg/L增加至224.9 mg/L时,其相应的平衡吸附量也从61.97 mg/g升高至225.88 mg/g;温度对平衡吸附量也有一定的影响,当温度从303 K升高至323 K,最大平衡吸附量也从194.71 mg/g升高至225.88 mg/g,可见,多孔纤维状氧化铁对酸性嫩黄G的吸附是吸热过程,升高温度有利于吸附.
通过对不同温度下的吸附平衡数据分别用Langmuir和Freundlich方程进行分析发现,吸附平衡数据更加符合Langmuir方程(4),其拟合结果如表1所示.

表1 酸性嫩黄G在多孔纤维状氧化铁上吸附平衡的Langmuir参数Table 1 Langmuir parameters of Acid Yellow 11 adsorbed on porous fibrous iron oxide

式中,ce/(mg/L)为吸附平衡质量浓度;qe/(mg/g)为平衡吸附量;qmax/(mg/g)为最大吸附容量;b/(L/mg)为Langmuir常数.以ce/qe对ce作图,可以得到一条直线,由此直线的斜率和截距可分别求出qmax和b的值.从拟合结果(表1)可以看出,吸附平衡数据与Langmuir方程有很好的相关性(相关系数R2>0.98),而且升高温度吸附量增加(图6),说明酸性嫩黄G在多孔纤维状氧化铁上的吸附很有可能是单分子层吸附[25].
2.6 吸附动力学图7是多孔纤维状氧化铁对酸性嫩黄G的吸附动力学曲线.从图中可以看出,在吸附开始的20 min内,酸性嫩黄G的吸附量增加很快,20 min后,吸附量增加逐渐减缓,300 min后吸附基本达到平衡.这表明,多孔纤维状氧化铁对酸性嫩黄G的吸附速度较快.另外,随着酸性嫩黄G初始质量浓度的增加,初始吸附速度加快,但达到平衡的时间延长,这与一般的吸附过程相似.
分别用拟一级速度方程(5)、拟二级速度方程[26](6)对吸附动力学数据进行拟合,拟合结果如表2所示.

由表2和图8可以看出,拟二级速度方程可以较好的描述多孔纤维状氧化铁对酸性嫩黄G的吸附动力学,其相关系数R2均在0.99以上,拟二级速度方程与实验数据吻合得较好;而且由拟二级速度方程计算得到的平衡吸附量qe与实验值qe,exp也比较接近,其误差在4%以内.而由拟一级速度方程拟合的结果较拟二级速度方程差,由拟一级速度方程计算得到的平衡吸附量qe与实验值qe,exp也有较大差异.因此可以认为,多孔纤维状氧化铁对酸性嫩黄G的吸附速度主要是由吸附反应速度控制,扩散传质阻力可以忽略不计.这表明多孔纤维状吸附材料具有较低的扩散传质阻力,因此吸附速度较快.
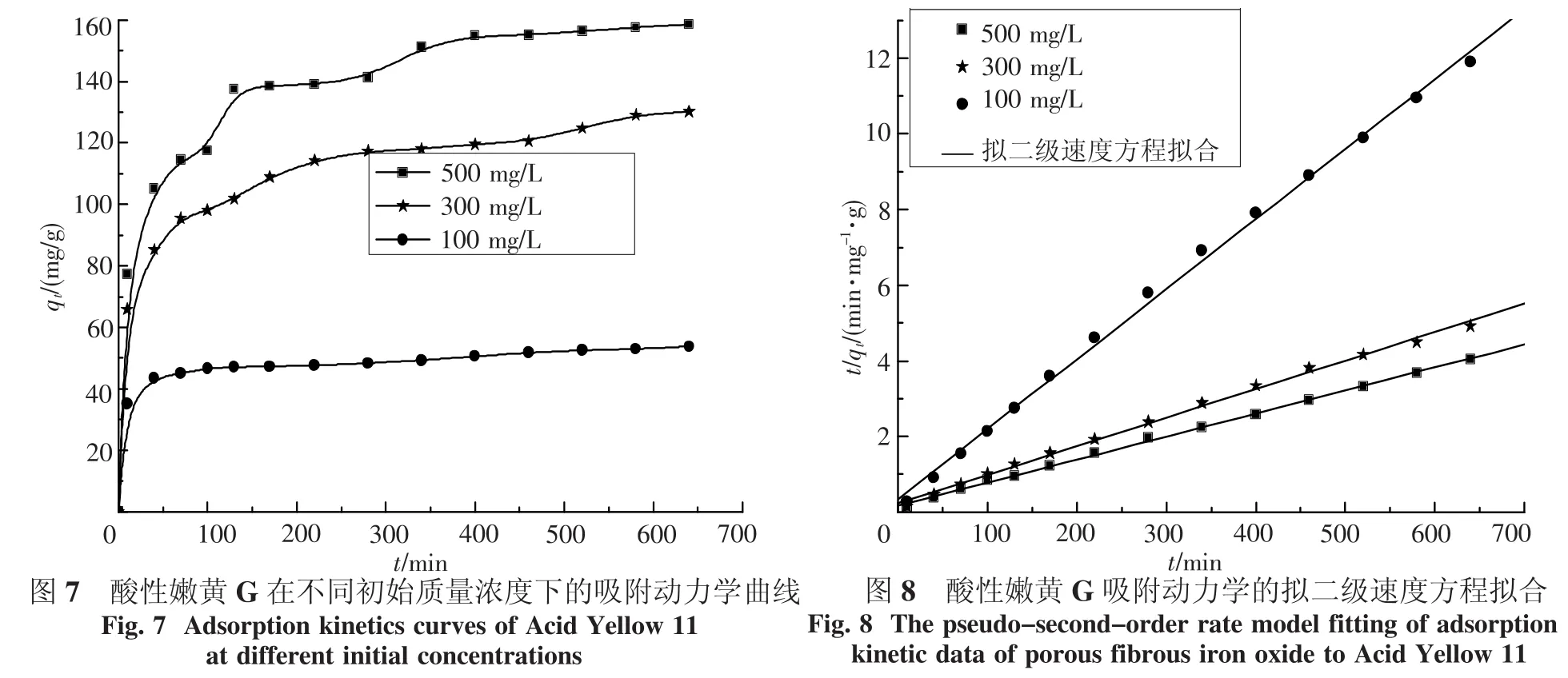

表2 多孔纤维状氧化铁对酸性嫩黄G的吸附动力学参数Table 2 Adsorption kinetics parameters of porous and fibrous iron oxide to Acid Yellow 11
2.7 解吸与再吸附由图5可知,多孔纤维状氧化铁对酸性嫩黄G的吸附在酸性环境中有较高的吸附量,而在碱性环境中吸附量大大降低.因此,可以用碱性溶液对吸附后的吸附剂进行解吸,将被吸附的酸性嫩黄G洗脱下来.又考虑到酸性嫩黄G是有机染料,根据相似相溶原理,可以尝试着用有机溶剂进行解吸.NaOH、Na2CO3、乙醇和丙酮溶液对多孔纤维状氧化铁吸附酸性嫩黄G后的解吸效果列于表3中.可见,NaOH溶液和Na2CO3溶液对酸性嫩黄G的解吸作用远远大于乙醇和丙酮溶液,说明在碱性条件下的解吸效果最佳.本文2.5中吸附平衡(吸附等温线)研究表明,酸性嫩黄G在多孔纤维状氧化铁上的吸附极有可能是化学吸附,而要根据相似相溶原理来解吸是不太可能的,因此乙醇和丙酮溶液的解吸效果很差.而 NaOH溶液比Na2CO3溶液的碱性更强,因此解吸效果更好.

表3 几种解吸液的解吸效果Table 3 Desorption results of Acid Yellow 11 adsorbed on porous fibrous iron oxide in different solutions
将用0.1 mol/L的NaOH溶液解吸后的多孔纤维状氧化铁经充分清洗并干燥后进行第二次吸附实验,其吸附容量为161.50 mg/g,与第一次相比较,再吸附的吸附容量仅减少了3.09 mg/g,这说明多孔纤维状氧化铁具有优良的重复使用性能.
3 结论
所制备的多孔纤维状氧化铁复制了胶原纤维的形貌,胶原纤维可作为模板制备多孔金属氧化物纤维.多孔纤维状氧化铁对废水中的阴离子型染料具有较高的吸附容量,吸附等温线符合Langmuir方程,吸附机理极有可能是单分子层化学吸附.多孔纤维状氧化铁对阴离染料的吸附速度快,吸附速度符合拟二级速度方程,这表明吸附过程是由吸附反应速度控制,扩散传质阻力可以忽略不计.多孔纤维状氧化铁吸附达平衡后可用碱液进行解吸,并且表现出良好的重复使用性能.因此,该吸附材料可望用于废水中阴离子染料的吸附.
[1]Banat I M,Nigam P,Singh D,et al.Microbial decolorization of textile-dye-containing effluents:a review[J].Bioresource Technol,1997,58:216-227.
[2]王学江,张全兴,赵建夫,等.酚酸类有机化工废水处理技术[J].环境污染治理技术与设备,2004,5(6):63-67.
[3]Forgacs E,Cserhati T,Oros G.Removal of synthetic dyes from wastewaters:a review[J].Environ Int,2004,30:953-971.
[4]Robinson T,McMullan G,Marchant R,et al.Remediation of dyes in textile effluent:a critical review on current treatment technologies with a proposed alternative[J].Bioresource Technol,2001,77:247-255.
[5]代先祥,陈洪,何海建,等.磁性纳米TiO2/Fe3O4的制备及光催化去除甲基紫的研究[J].四川师范大学学报:自然科学版,2011,34(6):889-893.
[6]Singh K,Arora S.Removal of synthetic textile dyes from wastewaters:a critical review on present treatment technologies[J].Crit Rev Environ Sci Technol,2011,41(9):807-878.
[7]钟俊波,李建章,曾凤春.磷钨酸光催化脱色直接橙S溶液的实验研究[J].四川师范大学学报:自然科学版,2013,36(4):618-621.
[8]Slokar Y M,Marechal L A M.Methods of decoloration of textile wastewaters[J].Dyes Pigments,1997,37(4):335-356.
[9]Choy K K H,Mckay G,Porter J F.Sorption of acid dyes from effluents using activated carbon[J].Resour Conserv Recycl,1999,27(2):57-73.
[10]Mckay G.Adsorption of dyestuffs from aqueous solution with activated carbon:equilibrium and batch contact-tome studies[J].J Chem Technol Biot,1982,32(8):758-772.
[11]Namasivayam C,Radhika R,Suba S.Uptake of dyes by a promising locally available agricultural solid wastes:coirpith[J].Waste Manage,2001,21(4):381-387.
[12]Annadurai G,Juang R H,Lee D J.Use of cellulose-based wastes for adsorption of dyes from aqueous[J].J Hazard Mater,2000,92(3):263-274.
[13]Singh B K,Rawat N S.Comparative sorption equilibrium studies of toxic phenols on fly ash and impregnated fly ash[J].J Chem Technol Biot,1994,61(4):307-317.
[14]Poots V J P,Mckay J J.The removal of acid dye from effluent using natural adsorbents[J].Water Res,1976,10(12):1061-1067.
[15]Chiou M S,Li H Y.Adsorption behavior of reactive dye in aqueous solution on chemical cross-linked chitosan beads[J].Chemosphere,2003,50(8):1095-1105.
[16]陆朝阳,沈莉莉,张兴全.吸附法处理染料废水的工艺及其机理研究进展[J].工业水处理,2004,24(3):12-16.
[17]丁云,廖学品,石碧.胶原纤维固载锆Zr(IV)对含氟、磷废水中磷的去除[J].皮革科学与工程,2007,17(1):6-10.
[18]Cot J,Aramon C.Waste processing in the tannery:production of gelatin,reconstituted collagen and glue from chrome-tanned leather splits and trimmings subjected to a modified detanning process[J].J Soc Leath Tech Ch,1986,70(3):69-76.
[19]高忠柏,苏超英.制革工业废水处理[M].北京:化学工业出版社,2001:7-14.
[20]Liao X P,Ding Y,Wang B,et al.Adsorption behavior of phosphate on metal-irons loaded collagen fiber[J].Ind Eng Chem Res,2006,45:3896-3901.
[21]吕绪庸.略论分析单宁用皮粉的生产[J].林产化学与工业,2000,20(1):71-74.
[22]张玉忠.树脂填充纤维吸附剂的研究[D].天津:天津工业大学.
[23]顾迎春.皮胶原纤维固载Zr(IV)对染料的吸附[D].成都:四川大学,2006.
[24]陈洁.铬鞣废革屑制备吸附材料及其对水体中磷酸根的吸附特性[D].成都:四川大学,2009.
[25]Aksu Z,Tezer S.Equilibrium and kinetic modeling of biosorption of Remazol Black B by Rhizopusarrhizus in a batch system:effect of temperature[J].Process Biochem,2000,36:430-440.
[26]Ho Y S,Mckay G.Pseudo-second order model for sorption processes[J].Process Bioch,1999,34(5):451-466.
