大肠癌FHIT和CHFR基因甲基化状态分析
2014-10-09王玉军
王玉军,徐 峰
(郑州大学第一附属医院消化内科 河南郑州 450052)
大肠癌是消化道肿瘤中最常见的恶性肿瘤之一,发病率居全球肿瘤的第3位,死亡率占所有肿瘤的9%,且往往确诊时已经发展至中晚期,治疗效果及预后较差。因此,探索其在分子水平的发生、发展机制,寻找早期诊断和早期治疗的方法很关键。近年来人们认识到表观遗传修饰也参与肿瘤的形成。DNA的甲基化是发现最早的基因表观遗传修饰方式之一[1],异常甲基化可能导致基因失活,业已发现多个基因的异常高甲基化在结直肠癌中频繁发生。脆性组氨基酸三联(FragiIe Histidine Triad,FHIT)基因是第一个将脆性位点与肿瘤相联系的侯选抑癌基因。研究发现:“FHIT基因作为抑癌基因,其启动子区在多种肿瘤中处于高甲基化状态”[2-3]。CHFR(Checkpoint with FHA and Ring Finger)是2000年新发现的一种能够检测分裂期正常细胞的分裂情况及控制分裂进行的基因,是一个新发现的抑癌基因,是第1个被发现的有丝分裂前期的检测点。CHFR在正常组织中广泛表达,其结构和功能都十分保守。研究表明,在结肠癌[4-5]、白血病[6]、胃[7-8]、乳腺癌[9]等多种肿瘤组织中 CHFR 表达缺失,CpG岛的甲基化可以导致CHFR表达缺失或沉默,但在大肠癌中的研究却鲜见报道。本研究利用甲基化特异性PCR检测46例大肠癌及相应癌旁正常组织中FHIT和CHFR基因的甲基化状态,目的在探讨其与大肠癌发生发展的作用。
1 材料与方法
1.1 材料 收集2011年7月至2013年10月郑州大学第一附属医院手术切除的大肠癌标本及相应的癌旁正常组织(距肿瘤边缘≥5 cm)共计46例,所有标本的诊断均经病理学教研室检查,且术前均未行免疫治疗及放化疗,其中男25例,女21例,年龄36~79岁,平均55岁,有淋巴结转移者27例,无淋巴结转移者19例;按肿瘤部位分类,直肠癌17例,结肠癌29例;按组织学分级,高、中分化者20例,中低、低分化者26例;按Dukes分期,A+B期30例,C+D期16例。所有标本离体后立即冻于液氮中,快速取出后置于-80℃冰箱中保存待测。Epitect Bisulfite Kit购自QIAGEN公司;TIANamp Genomic DNA Kit、PCR所需试剂均购自北京康为世纪生物科技有限公司。
1.2 方法
1.2.1 MSP方法原理:采用甲基化特异性 PCR方法,将从标本中提取的DNA进行亚硫酸氢盐修饰,使甲基化的胞嘧啶转化成尿嘧啶,而未甲基化的DNA中胞嘧啶则不发生改变,根据修饰过的DNA片段设计DNA引物,并进行PCR扩增,根据DNA产物片段大小的不同检测出差异,从而判断组织中DNA是否甲基化。
1.2.2 基因DNA提取:取-80℃保存的冷冻组织50~80 mg,按照组织DNA提取试剂盒说明书提取组织DNA,应用紫外分光光度法测定DNA的纯度及浓度,于-20℃保存。
1.2.3 基因DNA修饰及纯化:取1 μg上存DNA,按照EpiTect Bisulfite Kit试剂盒说明书进行亚硫酸氢钠修饰及纯化,最后溶于40 μl EB溶液中。
1.2.4 PCR扩增:由上海生工生物工程有限公司设计合成引物,见表1。PCR反应体系为25 μl,包括修饰后的模板 DNA 2 μl,5 × buffer(100 mmol/L Tris,HCl 500 mmol/L,KCl 15 mmol/L,MgCl2)5 μl,上、下游引物各 0.5 μl(10 pLmol/L)、Taq 多聚酶0.125 μl、dNTP Mixture 2.5 μl。反应条件:95 ℃预变性 10 min,95℃1 min,退火(FHIT为66℃,CHFR为50℃)1 min,72℃1 min,进行35个循环,最后72℃延伸10 min。取5 μl PCR产物在2.0%琼脂糖凝胶上电泳并摄像分析。
1.3 统计学方法 采用SPSS 17.0统计软件处理,应用χ2检验或Fisher确切概率法、关联分析法分析数据,P<0.05为差异具有统计学意义。
2 结果
2.1 MSP检测基因甲基化状态 FHIT和CHFR基因在大肠癌中的甲基化率(54.35%、34.78%)分别高于在癌旁正常组织中的甲基化率(8.69%、2.17%),组间差异均有统计学意义(P<0.05)。见表2、表3。
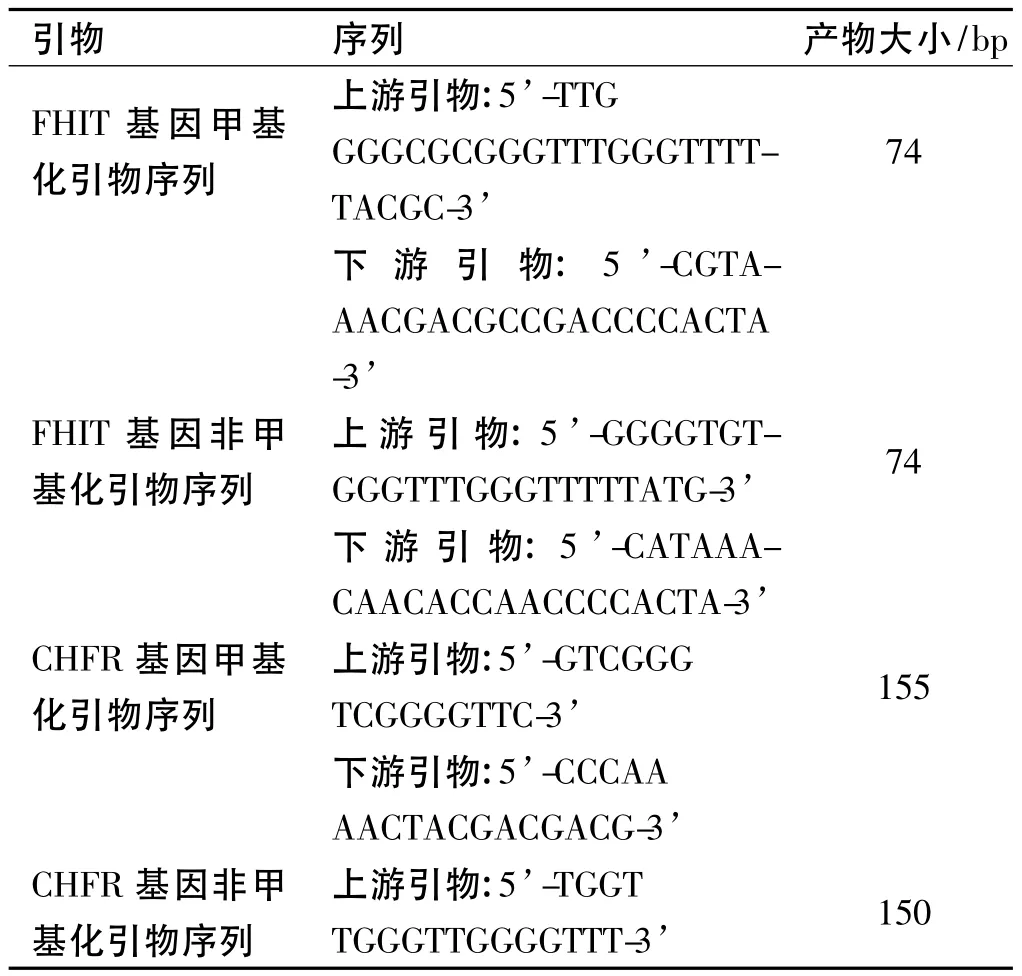
表1 FHIT和CHFR基因MSP引物序列和产物大小


表2 大肠癌及正常组织中FHIT基因甲基化
2.2 分析大肠癌中FHIT和CHFR基因甲基化的相关性 大肠癌中FHIT和CHFR基因甲基化有相关性(r=0.393,P <0.05)。见表 4。

表4 大肠癌FHIT和CHFR基因甲基化间相关性
2.3 FHIT和CHFR基因甲基化与临床病理特征的关系 FHIT和CHFR基因甲基化与分化程度、淋巴结转移有显著相关性(P<0.05),与年龄、性别、肿瘤部位、Dukes分期无显著相关性(P>0.05)。见表5。
3 讨论
DNA甲基化作为一种表观遗传学调控方式,在肿瘤的发生、发展过程中起重要作用[10],并且已证实在某些情况下DNA甲基化是抑癌基因失活的唯一机制[11-12]。
本实验发现,FHIT和CHFR基因甲基化存在于癌旁正常组织,可认为是大肠癌发生前已存在。FHIT和CHFR基因在大肠癌中的甲基化率显著高于癌旁正常组织,亦表明FHIT和CHFR基因高甲基化与大肠癌的发生相关。本实验还发现大肠癌FHIT和CHFR基因高甲基化与淋巴结转移、组织分化程度显著相关,而与性别、年龄、肿瘤部位、临床分期等临床因素无明显相关,由于FHIT和CHFR基因高甲基化多发生于分化低和有淋巴结转移的病例,因此,FHIT和CHFR基因高甲基化有可能作为评估大肠癌临床预后的一个重要指标。另外,启动子区甲基化使基因失活是一个可逆的过程,这与其他抑癌基因失活途径有所不同,应用去甲基化剂能使高甲基化状态发生去甲基化,激活抑癌基因,从而可以达到治疗肿瘤的目的。由于FHIT和CHFR基因甲基化具有相关性,它们有可能共同促进了大肠癌的发生,需进一步研究。

表5 结直肠癌中FHIT基因的甲基化与临床病理因素的关系
综上所述,FHIT和CHFR基因甲基化可能是大肠癌发生、发展中的一个重要机制,FHIT和CHFR基因是抑癌基因,当其启动子区甲基化时,易导致正常细胞的生长分化调控失常以及DNA损伤不能及时被修复,这可能与大肠癌形成密切相关,并有可能作为判断大肠癌预后的一个重要指标。
[1]闷俊红,刘建亮.DNA甲基化导致肿瘤的分子机制[J].医学综述,2009,15(22):3434-3436.
[2]张生军,张才全.FHIT基因结构、功能及其应用研究进展[J].重庆医学,2004,33(9):1411-1413.
[3]贾要丽,吴拥军,吴秋歌,等.肺癌患者RASSFlA和FHIT基因启动子区甲基化检测[J].郑州大学学报(医学版),2013,48(3):373-376.
[4]Kang H C,Kim I J,Jang S G,et al.Coding region polymorphisms in the CHFR mitotic stress checkpoint gene are associated with colorectal cancer risk[J].Cancer Let,2008,260(1/2):170-179.
[5]Hibi K,Nakao A.Highly-methylated colorectal cancers show poorlydifferentiated phenotype[J].Anticancer Res,2006,26(6B):4263-4266.
[6]Daniels M J,Marson A,Venkitaraman A R.PML bodies control the nuclear dynamics and function of the CHFR mitotic checkpoint protein[J].Nat Struct Mol Biol,2004,11(11):1114-1121.
[7]Gao Y J,Xin Y,Zhang J J,et al.Mechanism and pathobiologicimplications of CHFR promoter methylation in gastric carcinaoma[J].World J Gastroenterol,2008,14(32):5000-5007.
[8]Koga Y,Kitajima Y,Miyoshi A,et al.The significance of aberrant CHFR methylation for clinical response to microtubule inhibitors in gastric cancer[J].J Gastroenterol,2006,41(2):133-139.
[9]Privette L M,González M E,Ding L,et al.Altered expression of the early mitotic checkpoint protein,CHFR,in breast cancers:implications for tumor suppression[J].Cancer Res,2007,67(13):6064-6074.
[10]Ehrlich M.DNA methylation in cancer:Too much,but also too little[J].Oncogene,2002,21(35):5400-5413.
[11]Chan S L,Cui Y,van Hasselt A,et al.The tumor suppressor Wntinhibitory factor 1 is frequently methylated in nasopharyngeal and esophageal carcinomas[J].Lab Invest,2007,87(7):644-650.
[12]Palii S S,Robertson K D.Epigenetic control of tumor suppression[J].Crit Rev Eukaryot Gene Expr,2007,17(4):295-316.
