拟南芥RRP41L蛋白的原核表达与纯化
2014-09-27王翠玲侯小改
杨 敏, 王翠玲, 侯小改
(河南科技大学农学院,河南 洛阳 471003)
拟南芥RRP41L蛋白的原核表达与纯化
杨 敏, 王翠玲, 侯小改
(河南科技大学农学院,河南 洛阳 471003)
采用PCR技术克隆得到拟南芥类核糖体RNA加工蛋白41(Ribosomal RNA-processing protein 41-LIKE,RRP41L)基因,然后构建其原核表达载体,并对其进行诱导和纯化,以期获得较大量的重组蛋白.结果表明,试验获得了拟南芥RRP41L基因的全长编码序列(coding sequence, CDS)(771 bp),将其与原核表达载体PGEX4T-1连接构建了原核表达载体PGEX4T-RRP41L,将PGEX4T-RRP41L质粒导入大肠杆菌(E.coli)BL21(DE3)中,在37 ℃条件下,用1 mmol·L-1IPTG诱导8 h后体外纯化融合蛋白.SDS-PAGE电泳结果显示,在此诱导条件下,PGEX4T-RRP41L重组质粒可表达出较大量的重组蛋白,蛋白质相对分子质量大小为53.4 kD,除去PGEX4T-1自身表达相对分子质量大小为26.0 kD后,与RRP41L编码的蛋白质相对分子质量约为27.4 kD的大小一致.
拟南芥;类核糖体RNA加工蛋白41;原核表达;蛋白纯化
在真核细胞中,存在着大量的内切和外切核糖核酸酶参与mRNA的降解过程.外切酶主要包括5′-3′ 核酸外切酶和3′-5′ 核酸外切酶,5′-3′ 核酸外切酶以XRN蛋白家族为代表,广泛存在与酵母、动物及植物中,且研究也较为深入[1~6].而3′-5′ 核酸外切酶所进行的3′-5′ 方向的降解是真核生物中mRNA的主要降解途径,依赖于一种称为外切体 (exosome) 的复合物[7~9].该复合体广泛参与了大量RNA的加工、处理及降解过程,包括mRNA,rRNA,tRNA,snRNA,snoRNA等,且部分亚基的功能已在酵母和动物中得到了较为深入的研究,但是在植物中的研究还很少,所以对于植物核酸外切体组分的研究至关重要.在拟南芥中,类核糖体RNA加工蛋白41(Ribosomal RNA-processing protein 41-LIKE, RRP41L)基因编码一个含有256个氨基酸的蛋白质,是推测的具有RNase PH域的3′-5′ 核酸外切酶,是一个可能的核酸外切体组分[10,11].本试验前期工作中,通过对rrp41l突变体的表型分析,确定了RRP41L突变对拟南芥早期生长发育的影响,从生理及分子水平上证明了RRP41L参与了拟南芥种子的萌发和早期生长发育过程,并且找到了RRP41L的耙mRNA,阐明了RRP41L是通过影响编码拟南芥种子储藏蛋白(seed storage proteins, SSPs)[12~14]及脱落酸(abscisic acid, ABA)[15~17]信号和合成途径中相关蛋白mRNA的降解来调控拟南芥种子的萌发和早期生长发育的[18].为了对RRP41L蛋白进行更深入的功能探索,本研究通过原核表达载体的构建,诱导表达蛋白并进行纯化,旨在获得较纯的目的蛋白,以用于后续RRP41L蛋白抗体的制备、RRP41L互作蛋白的筛选等生化试验,为进一步了解RRP41L的蛋白功能奠定基础.
1 材料与方法
1.1试验材料
试验中所使用的植物材料是拟南芥(Arabidopsisthaliana).野生型 (WT) 拟南芥是Columbia (Col-0) 生态型,为河南科技大学实验室保存材料.培养条件为:16 h光照/8 h黑暗,温度是19~22 ℃,相对湿度为50%~70%,光照度为60~100 μmol·m-2·S-1.
1.2拟南芥总RNA的提取及cDNA合成
以5~7 d的拟南芥幼苗为材料,利用Trizol法(Trizol试剂,北京天根生化科技有限公司),提取总RNA,电泳跑胶,检测.使用Prim Script RT Reagent Kit (TaKaRa, 大连)合成cDNA第1条链.
1.3RRP41L基因CDS的PCR克隆
以1.2的cDNA为模板,根据拟南芥网站(TAIR)报道的拟南芥RRP41L(At4g27490)的CDS序列设计引物,上游引入BamH I (TaKaRa, 大连)位点,下游引入EcoRI (TaKaRa, 大连)位点.具体引物为:RRP41L-LP: 5-GGATCC- ATGGCAGCTAAACCTGGAGCCGCAACRRP41L-RP: 5-GAATTC-TCATTCATCGGAAGCTGAGGCAGACTG,PCR反应条件为:94 ℃,5 min;94 ℃,30 s,60 ℃,30 s,72 ℃,1 min,30个循环;72 ℃ 延伸10 min.扩增结束后,电泳,跑胶,回收,将回收产物与中间载体pMD-19Tsimple连接,连接产物转化感受态细胞,涂板,选取阳性单克隆菌落,提取质粒测序(华大基因公司).
1.4原核表达载体的构建
将1.3重组质粒与表达质粒pGEX 4T-1分别用BamH I和EcoR I进行双酶切,酶切产物用T4连接酶(TaKaRa, 大连)连接,连接产物转化E.coli(DH5α)感受态细胞(北京天根生化科技有限公司),涂板,选取阳性单克隆菌落,提取质粒,并进行双酶切验证,将重组质粒命名为PGEX4T-RRP41L.
1.5目的蛋白的诱导表达与纯化
将构建成功的重组质粒PGEX4T-RRP41L和空质粒PGEX4T-1分别转化大肠杆菌(E.coli) BL21(DE3),挑取阳性克隆接入20 mL含有的LB液体培养基中,37 ℃,200 r·min-1振荡过夜培养,次日以1∶50的比例转接到1 L含有氨苄青霉素(Ampicillin,Amp)的LB液体培养基中,37 ℃,200 r·min-1培养至菌液在600 nm波长处的吸光值大小为0.5~0.8时,取1 mL菌液作为诱导前对照,剩余菌液中加入终浓度为1 mmol·L-1的IPTG(Merck,德国),37 ℃诱导培养8 h,将菌液分装至50 mL离心管中,4 ℃,4 000 r·min-1离心10 min收集菌体.用预冷的Buffer L(配方为:50 mmol·L-1Tris-HCl (pH 8.0),250 mmol·L-1NaCl,1 mmol·L-1EDTA (pH 8.0),调pH 7.5)重悬菌体,加入终浓度为1 mmol·L-1的PMSF(Merck,德国),充分混匀.冰浴,超声破碎细胞(300 W),每次超声5 s,间歇10 s,总共30次.细胞破碎完成后,4 ℃,12 000 r·min-1离心30 min,取上清液与已用Buffer L平衡好的GST亲和树脂填料(Glutathione-SepHarose 4B) (Amersham,美国) 悬液混合,于4 ℃温和混匀结合1.5 h,上柱,待琼脂糖填料沉淀后,让菌液全部流出.用预冷的Buffer L充分清洗柱填料至检测不到蛋白质.加入预冷的10 mmol·L-1的还原型谷胱甘肽溶液,将柱子封闭,静置5 min后打开柱子,让洗脱液流出,同时用蛋白检测液检测,当有目标蛋白质流出时,将目的蛋白质根据试验要求透析到相应的工作缓冲液中,收集蛋白质,用SDS-PAGE检测纯度,考马斯亮蓝法检测浓度,分装后-80 ℃保存备用.
2 结果与分析
2.1拟南芥幼苗中RRP41L全长编码序列(codingsequences,CDS)的克隆
取约1周龄的拟南芥幼苗,提取mRNA,反转录成cDNA,以此为模板,以RRP41L-LP,RRP41L-RP为引物进行扩增,产物用1%琼脂糖凝胶电泳跑胶,结果如图1所示,获得了一个大小约为750 bp的片段,片段大小与拟南芥网上的RRP41L基因CDS(771 bp)大小相符,初步确定为目的片段.

M,D 2000.图1 RRP41L基因CDS片段的克隆Fig.1 Cloning of RRP41L CDS
2.2RRP41LCDS目的片段的获得
将获得的PCR产物用天根公司的DNA凝胶回收纯化试剂盒回收产物,与中间载体pMD-19T simple连接过夜,之后转化大肠杆菌DH5α感受态细胞,积菌,涂布与带有氨苄青霉素抗性的LB选择性培养基上,约12 h后,挑取①~⑩号单菌落,进行菌落PCR,如图2-A所示.在阳性菌中选择2~3个单菌落,摇菌,提取质粒,送生物公司测序,用DNAMAN软件将测序结果与拟南芥网上的RRP41LCDS片段比对,结果显示,获得的目的片段是完全正确的,可用于后续试验.同时将获得的2个阳性质粒(RRP41L-19T)用BamH I/EcoR I双酶切,进行鉴定,结果如图2-B所示.胶图上方为酶切后的pMD-19 Tsimple,下方显示的是目的片段.
2.3PGEX4T-RRP41L质粒的构建
将RRP41L-19T质粒双酶切,之后将目的片段回收,与同样双切回收的pGEX4T-1连接,转化大肠杆菌DH5α感受态细胞,同样用带有 Amp抗性的LB选择性培养基筛选,菌落PCR获得阳性菌,如图3-A所示.选取其中2个阳性单菌落摇菌,提取质粒,利用BamH I/EcoRI双酶切鉴定阳性质粒,电泳跑胶,结果如图3-B所示.上方为双酶切后的pGEX4T-1,下方为目的片段.将该质粒命名为PGEX4T-RRP41L,用于后续试验.
2.4GST-RRP41L重组蛋白的诱导表达与纯化
将阳性质粒PGEX4T-RRP41L转入到大肠杆菌DE3宿主菌中,进行菌落PCR,获得阳性菌,选取2个阳性单菌落用1 mmol·L-1IPTG 进行诱导表达,然后集菌做菌的全蛋白电泳检测.同时也将PGEX4T-1质粒转入到大肠杆菌DE3宿主菌中作为对照,结果如图4-A所示.融合蛋白GST-RRP41L及GST蛋白都诱导表达成功,相对分子质量均与预期相符:GST-RRP41L蛋白相对分子质量大小为53.4 kD,除去PGEX4T-1自身表达的26.0 kD蛋白后,与RRP41L编码的相对分子质量约为27.4 kD蛋白的大小一致.

A. ①~⑩号单菌落的菌落PCR结果;B. 2个阳性质粒的酶切鉴定结果; M, 2000.
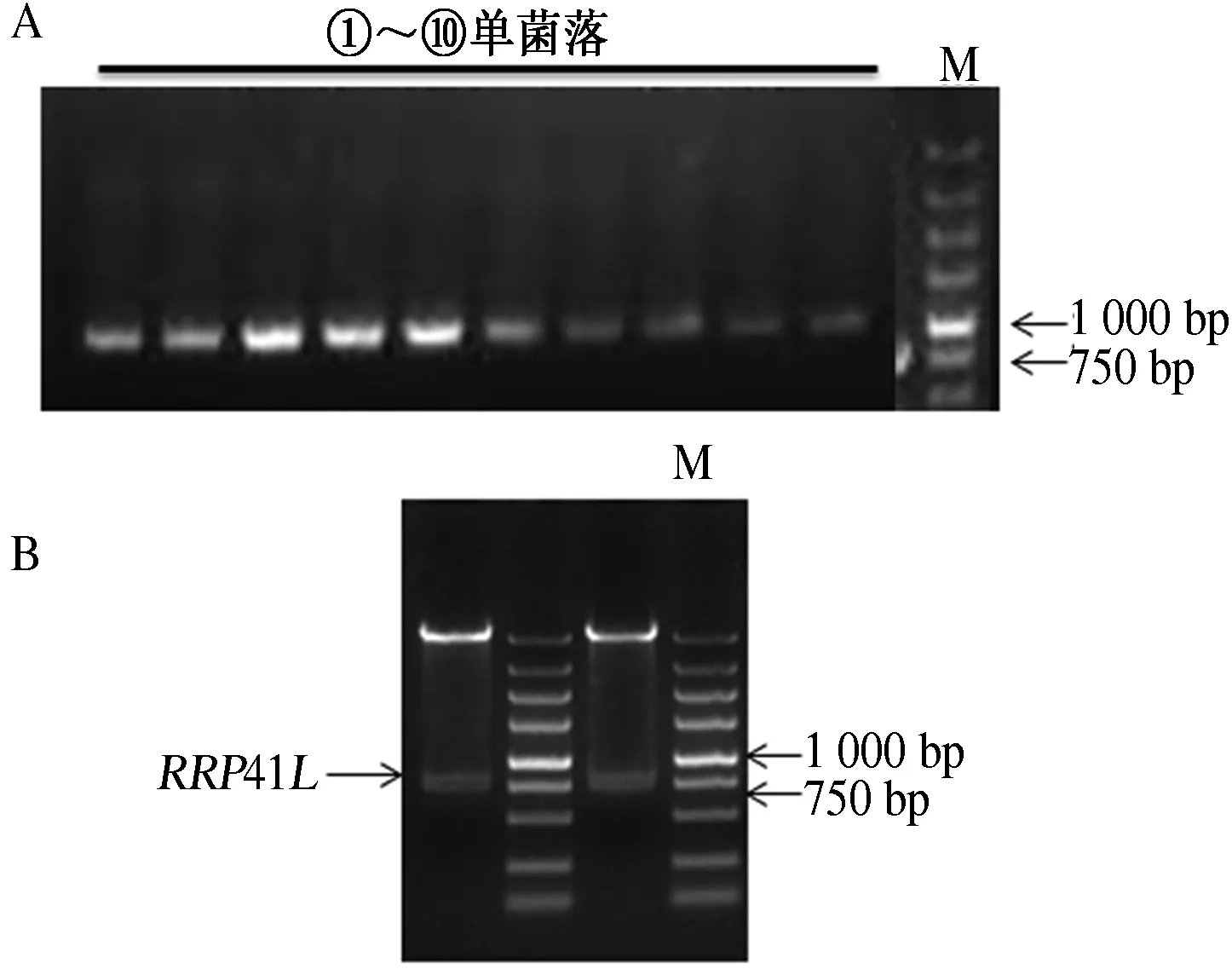
A. ①~⑩号单菌落的菌落PCR结果;B. 两个阳性质粒的酶切鉴定结果; M, D5000.
将已检测的阳性菌接入1 L的LB液体培养基中,37 ℃培养,测定菌液在600 nm波长处的吸光值,大小在0.5~0.8时,加入1 mmol·L-1IPTG,诱导表达8 h,集菌,裂解,取上清液与Glutathione-SepHarose 4B琼脂糖填料结合,并进行融合蛋白的纯化.重组蛋白进行SDS-PAGE电泳分析,结果如图4-B所示,在相应的相对分子质量位置检测到了GST-RRP41L重组蛋白质的存在,且获得的重组目的蛋白质较纯,量也较大.可以用于后续试验.
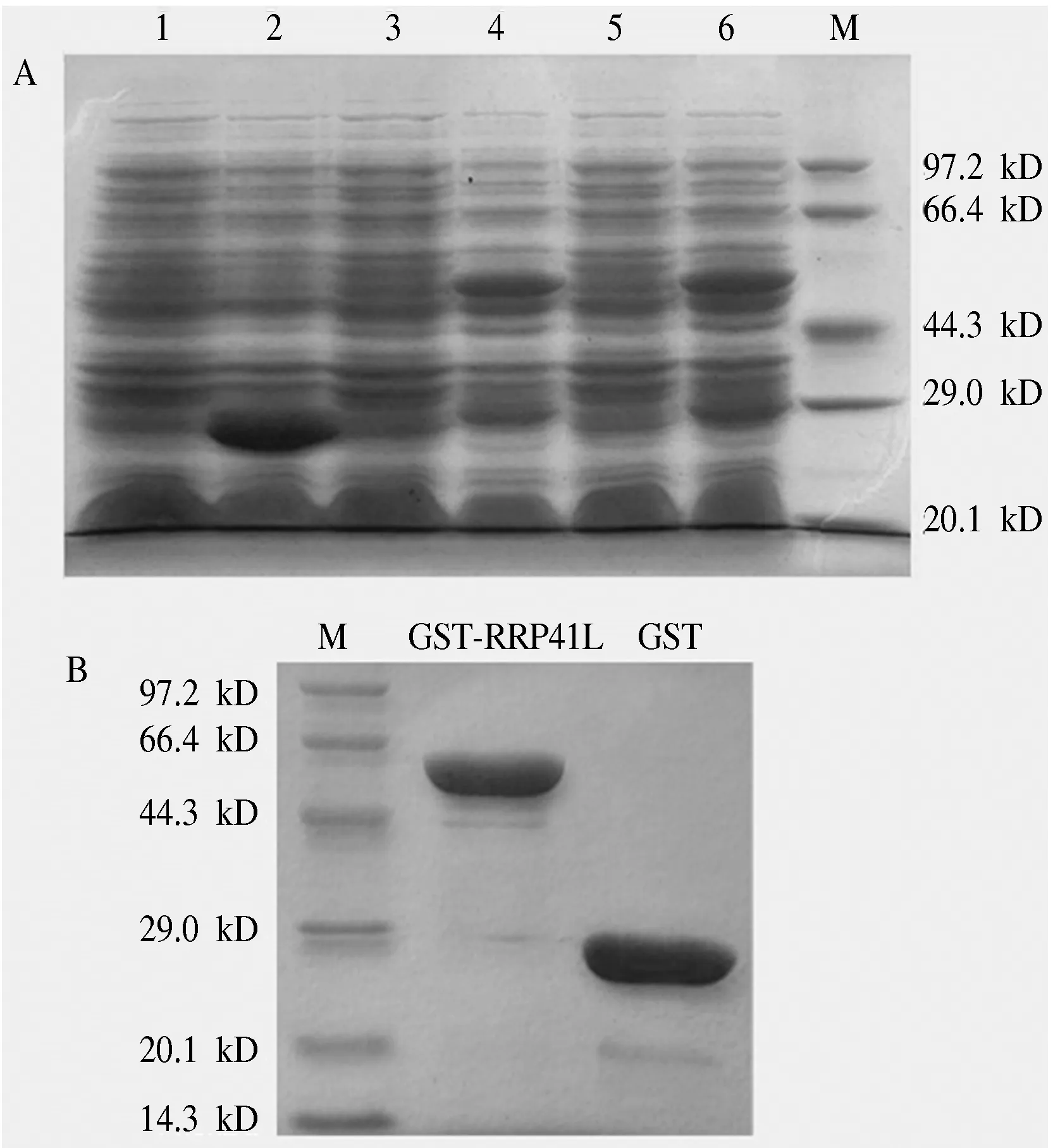
A.GST,GST-RRP41的诱导表达.1为空载体未加IPTG诱导结果;2为空载体加1 mmol·L-1 IPTG诱导表达结果;3,5分别为重组质粒①,②号菌未加IPTG诱导结果; 4,6为重组质粒①,②加1 mmol·L-1IPTG诱导表达结果.B.GST,GST-RRP41L的纯化. M, marker.
3 讨论
在拟南芥中,RRP41L编码一个含有256个氨基酸的3′-5′ 核酸外切酶,包含一个在进化上十分保守的RNase PH域,是拟南芥一个可能的核酸外切体组分.作者前期的研究结果表明,RRP41L作为一个可能的核酸外切体亚基,对拟南芥种子的萌发及早期生长至关重要,RRP41L的亚细胞定位结果也与核酸外切体的定位相一致[18],进一步说明RRP41L是拟南芥核酸外切体的一个重要组分,但是对于该亚基的详细作用机制还不是很清楚,需要进一步研究.
外切体广泛存在于真核生物中,在动物及酵母中的研究较为深入,但是,在植物中的研究还很少.在已有的研究中,发现真核生物核酸外切体在结构上虽然十分相似,但是在蛋白功能上,尤其是作用机制方面有明显的差异.例如,在酵母和人中,外切体的6个含有RNase PH域的亚基是没有催化活性的[19,20].但是,在果蝇中有报道认为,外切体的单个亚基可以单独或是2个亚基形成子复合物发挥特定的功能[21].而在拟南芥中,已报道RRP41单个亚基是有催化活性的[22].结合这些研究结果认为,将核酸外切体各亚基组分分离出来,对单个亚基蛋白进行详细研究,包括蛋白亚基的互作蛋白、作用机制等,将为深入解析植物核酸外切体功能,了解真核生物外切体差异提供重要试验证据.特别是近年来,对拟南芥核酸外切体的研究仅仅局限于对各亚基缺失突变体的表型分析及亚基底物RNA的寻找,而对于其详细的作用机制并没有深入探讨.
为了填补这方面的研究空白,并解决“拟南芥RRP41L蛋白与其他蛋白的互作关系及其详细的作用机制”这一科学问题,RRP41L蛋白的体外诱导和纯化至关重要.本试验在前期工作的基础上,首次通过原核表达载体的构建,成功诱导和纯化了目的蛋白.在试验中影响大肠杆菌表达融合蛋白的因素很多,包括诱导温度、诱导IPTG浓度及诱导时间等[23,24].为了高效表达该蛋白,本试验对GST-RRP41L重组蛋白的诱导条件进行了摸索,通过SDS-PAGE电泳结果显示,当诱导温度为37 ℃,IPTG浓度为1 mmol·L-1,诱导时间为8 h时,诱导条件为最佳,能够获得较纯和较大量的目的蛋白.GST-RRP41L重组蛋白的成功获得为后续的研究工作,包括体外互作蛋白筛选试验、蛋白抗体的制备等生化试验提供了材料,为深入研究拟南芥RRP41L蛋白的功能打下了坚实基础.
[1] GARNEAU N L, WILUS Z J, WILUSZ C J. The highways and byways of mRNA decay[J]. Nat Rev Mol Cell Biol, 2007, 8: 113-126.
[2] HSU C L, STEVENS A. Yeast cells lacking 5’→3’ exoribonuclease 1 contain mRNA species that are poly (A) deficient and partially lack the 5’cap structure[J]. Mol Cell Biol, 1993, 13: 4826-4835.
[3] KASTENMAYER J, GREEN P. Novel features of the XRN-family in Arabidopsis: evidence thatAtXRN4, one of several orthologs of nuclear Xrn2p/Rat1p, functions in the cytoplasm[J]. Proc Natl Acad Sci USA, 2000, 97: 13985-13990.
[4] RYMARQUIS L A, SOURET F F, GREEN P J. Evidence that XRN4, an Arabidopsis homolog of exoribonuclease XRN1, preferentially impacts transcripts with certain sequences or in particular functional categories[J]. RNA, 2011, 17: 501-511.
[5] MIKI T S, RUEGGER S, GAIDATZIS D, et al. Engineering of a conditional allele reveals multiple roles of XRN2 inCaenorhabditiselegans development and substrate specificity in microRNA turnover[J]. Nucleic Acids Res, 2014, 42: 4056-67.
[6] NAGARAJAN V K, JEONES C I, NEWBURY S F, et al. XRN 5’→3’ exoribonucleases: structure, mechanisms and functions[J]. Biochim Biophys Acta , 2013, 182: 590-603.
[7] ESTEVEZ A M, LEHNER B, SANDERSON C M, et al. The roles of intersubunit interactions in exosome stability[J]. J Biol Chem , 2003,278: 34943-34951.
[8] MITCHELL P, PETFALSKI E, SHEVCHENKO A, et al. The exosome: a conserved eukaryotic RNA processing complex containing multiple 3’-5’ exoribonucleases[J]. Cell, 1997, 91: 457-466.
[9] JANUSZYK K, LIMA C D. The eukaryotic RNA exosome [J]. Curr Opin Struct Biol, 2014, 24: 132-140.
[10] CHEKANOVA J A, GREGORY B D, REVERDATTO S V, et al. Genome-wide high-resolution mapping of exosome substrates reveals hidden features in theArabidopsistranscriptome[J]. Cell , 2007, 131: 1340-1353.
[11] ZIMMER S L, FEI Z, STERN D B. Genome-based analysis ofChlamydomonasreinhardtiiexoribonucleases and poly (A) polymerases predicts unexpected organe-llar and exosomal features[J]. Genetics, 2008, 179: 125-136.
[12] MIERNYK J A, HAJDUCH M. Seed proteomics[J]. J Proteomics, 2011, 74: 389-400.
[13] LOPEZ-MOLINA L, CHUA N H. A null mutation in a bZIP factor confers ABA-insensitivity inArabidopsisthaliana[J]. Plant Cell Physiol, 2000,41: 541-547.
[14] TO A, VALON C, SAVINO G, et al. A network of local and redundant gene regulation governsArabidopsisseed maturation[J]. Plant Cell, 2006, 18: 1642-1651.
[15] FINKELSTEIN R, REEVES W, ARIIZUMI T, et al. Molecular aspects of seed dormancy[J]. Plant Biol, 2008, 59: 387-415.
[16] XIONG L, WANG R G, MAO G, et al. Identification of drought tolerance determinants by genetic analysis of root response to drought stress and abscisic acid[J]. Plant Physiol, 2006,142: 1065-1074.
[17] KIM T H , BOHMER M, HU H, et al. Guard cell signal transduction network: advances in understanding abscisic acid, CO2, and Ca2+signaling[J]. Annu Rev Plant Biol, 2010, 61: 561-591.
[18] YANG M, ZHANG B, HAN Y, et al. RRP41L, a putative core subunit of the exosome, plays an important role in seed germination and early seedling growth inArabidopsis[J]. Plant Physiol, 2013, 161: 165-178.
[19] DZIEMBOWSKI A, LORENTZEN E, CONTI E, et al. A single subunit, Dis3, is essentially responsible for yeast exosome core activity[J]. Nat Struct Mol Biol, 2006, 14: 15-22.
[20] LIU Q, GREIMANN J C, LIMA C D. Reconstitution, activities, and structure of the eukaryotic RNA exosome[J]. Cell, 2007, 131: 188-189.
[21] GRAHAM A C, KISS D L, ANDRULIS E D. Differential distribution of exosome subunits at the nuclear lamina and in cytoplasmic foci[J]. Mol Biol Cell, 2006, 17: 1399-1409.
[22] CHEKANOVA J A, SHAW R J, WILLS M A, et al. Poly (A) tail-dependent exonuclease AtRrp41p fromArabidopsisthalianarescues 5.8 S rRNA processing and mRNA decay defects of the yeast ski6 mutant and is found in an exosome-sized complex in plant and yeast cells[J]. J Biol Chem, 2000, 275: 33158-33166.
[23] 倪志勇,李 波,范 玲. 棉花肉桂醇脱氢酶基因GhCAD3的克隆及原核表达[J]. 核农学报,2010,24(5):910-916.
[24] 杨书玲,张龙雨,张改生,等. 小麦TaPDK基因的序列分析、原核表达及纯化[J]. 核农学报,2013,27(8):1081-1089.
(责任编辑:常思敏)
ProkaryoticexpressionandpurificationofRRP41LinArabidopsisthaliana
YANG Min, WANG Cui-ling, HOU Xiao-gai
(College of Agronomy, Henan University of Science and Technology, Luoyang 471003, China)
In order to construct prokaryotic expression vector and to obtain the recombinant gene expression in the host bacteria, we cloned full-length coding sequence (CDS) of Ribosomal RNA-processing Protein 41-LIKE (RRP41L) inArabidopsisby the PCR method followed by restriction enzymes cutting and connection. The results of the experiments showed: the full-length of RRP41L CDS (771bp) was cloned, fused with the vector of PGEX4T-1, and a recombinant of prokaryotic expression vector (PGEX4T-RRP41L) was constructed successfully. Then the expression plasmid PGEX4T-RRP41L was transformed toE.coliBL21 (DE3). RRP41L protein expressed effectively after being induced for 8 hours with 1 mmol·L-1IPTG at 37 ℃. The SDS-PAGE results indicated that the fusion protein was expressed with molecular weight of 53.4 kD, with the PGEX4T-1 own induction produced 26.0 kD protein. The result was consistent with the 27.4 kD protein which encoded byRRP41L.
Arabidopsis;RRP41L; prokaryotic expression; purification
1000-2340(2014)06-0731-05
Q 202
:A
2014-08-24
国家青年科学基金项目(31101153)
杨 敏,1985年生,女,山东枣庄人,副教授,博士,主要从事植物发育分子生物学方面的研究.
