日本雪椿愈伤组织诱导体系的建立
2014-09-27吴雅文
张 宁, 吴雅文, 刘 震
(河南农业大学林学院,河南 郑州 450002)
日本雪椿愈伤组织诱导体系的建立
张 宁, 吴雅文, 刘 震
(河南农业大学林学院,河南 郑州 450002)
研究探讨了日本雪椿愈伤组织诱导过程中不同生长调节剂、不同类型外植体对愈伤组织诱导效应的影响.结果表明,MS+6-BA 2.0 mg·L-1+2,4-D 0.5 mg·L-1培养基是雪椿愈伤组织诱导的最佳培养基,雪椿新生叶片作为外植体,诱导率和生长状况最佳.
雪椿;外植体;生长调节剂;组织培养
雪椿 (Camelliajaponicavar.decumbens),又名“山茶花”,属山茶科(Theaceae)山茶属(Camellia)植物[1,2],是山茶科名花之一,也是世界名花之一,具有很高的观赏和实用价值.山茶花的栽培有较长的历史,但由于其种源少、自花结实率低、自然繁殖困难等原因限制了山茶花应有园林作用的发挥[3].山茶属植物多酚类物质含量较高,是易受内生菌污染的喜阴植物,进行组织培养的困难程度较高[4].为了解决这个难题,在国内很早就开始采用山茶种子的子叶,幼龄植株的茎尖等作为外植体,诱导产生出体胚再到丛生芽,成功获得山茶再生苗[5],但是由叶片和茎段作为外植体形成愈伤组织,然后诱导产生不定芽分化和再生植株的技术却并不完善,为建立山茶快速繁育体系,获得完整的再生植株,必须获得完整稳定的愈伤体系用于继代培养,大量增殖.在建立愈伤体系的研究中,夏泉生[6]认为,MS+6-BA 2.0 mg·L-1+IAA 1.0 mg·L-1对山茶花愈伤诱导最适宜;董慧慧[3]认为,MS+6-BA 2.0 mg·L-1+2,4-D 0.5 mg·L-1对山茶花叶柄处的愈伤组织的诱导最好,同时叶片的诱导率小于茎段;袁颖[7]则认为,2, 4-D 0.5 mg·L-1+6-BA 1.0 mg·L-1诱导愈伤组织的生长状态最好,利于培养;而杨凯[8]在对山茶花胚状体和胚性诱导研究中认为,MS+6-BA 1.0 mg·L-1+NAA 0.2 mg·L-1总体对胚状体的诱导率最高.本研究在前人研究的基础上对植物生长调节剂配比,植物生长调节剂质量浓度和外植体类型进行系统筛选,重点探讨了雪椿愈伤组织诱导过程中不同植物生长调节剂、不同类型外植体对愈伤组织诱导效应的影响,以期寻找山茶花组织培养过程中所需要的最佳植物生长调节剂质量浓度组合及外植体类型.
1 材料与方法
1.1试验材料
雪椿种子取自日本三重大学,在河南农业大学林学实习基地进行催芽萌发,在生长健壮的雪椿植株上采摘已展开的新叶和嫩梢的茎段2种材料作为外植体.
1.2试验方法
将2种外植体材料消毒后,把叶片剪成5 mm×5 mm大小的方块,茎段切成 1 cm左右小段,接种于附加不同植物生长调节剂及不同生长调节剂质量浓度的MS培养基上做初代培养,每日光照14 h,温度 22 ℃,光照度 1 800~2 500 Lx,静置培养,30 d后统计污染率、愈伤组织诱导率及其生长状况.
1.2.1 培养基配制 以MS为基本培养基添加植物生长调节剂如表 1所示,根据试验设计分别对叶片和茎段设计2种配比方案(6-BA+2, 4-D和6-BA+IAA),共4个处理,每个处理做10瓶,共计40瓶,将培养基在121 ℃高压下灭菌15 min.

表1 不同种类植物生长调节剂配比Table 1 The ratio of different growth regulatory substances
注: A-1叶片6-BA+2,4-D, A-2茎段6-BA+2,4-D, B-1叶片6-BA+IAA, B-2茎段6-BA+IAA.
Note: A-1 Blade 6-BA+2,4-D, A-2 Stem 6-BA+2,4-D, B-1 Blade 6-BA+IAA, B-2 Stem 6-BA+IAA.
1.2.2 不同植物生长调节剂及质量浓度的配比处理 在添加不同质量浓度生长调节剂的培养基中对外植体进行培养,在6-BA+2,4-D的组合中2,4-D的质量浓度分别设置为0.1 mg·L-1,0.5 mg·L-1,和1.0 mg·L-13个梯度,每个梯度设置15个重复,共计45个,对叶片和茎段进行愈伤组织诱导,此处理设定叶片处理为C处理,茎段处理为D处理,培养基类型相同,具体培养基配比如表2.
1.2.3 外植体处理及接种 选取生长健壮的雪椿植株,剪取雪椿新叶和枝条嫩梢的茎段用自来水清洗30 min,洗去浮尘,然后用洗洁精进一步清洗,再用自来水将洗洁精残留冲洗干净,然后置于无菌室超净工作台上,用无菌水清洗1 min,再用质量份数75 %的乙醇浸泡0.5 min,后用无菌水冲洗2次,放入0.1 % HgCl2中,并不时摇晃消毒缸,计时8 min,取出后用无菌水冲洗5遍,置于无菌滤纸上吸干水分,接种于附加不同植物生长调节剂的 MS培养基上做初代培养.
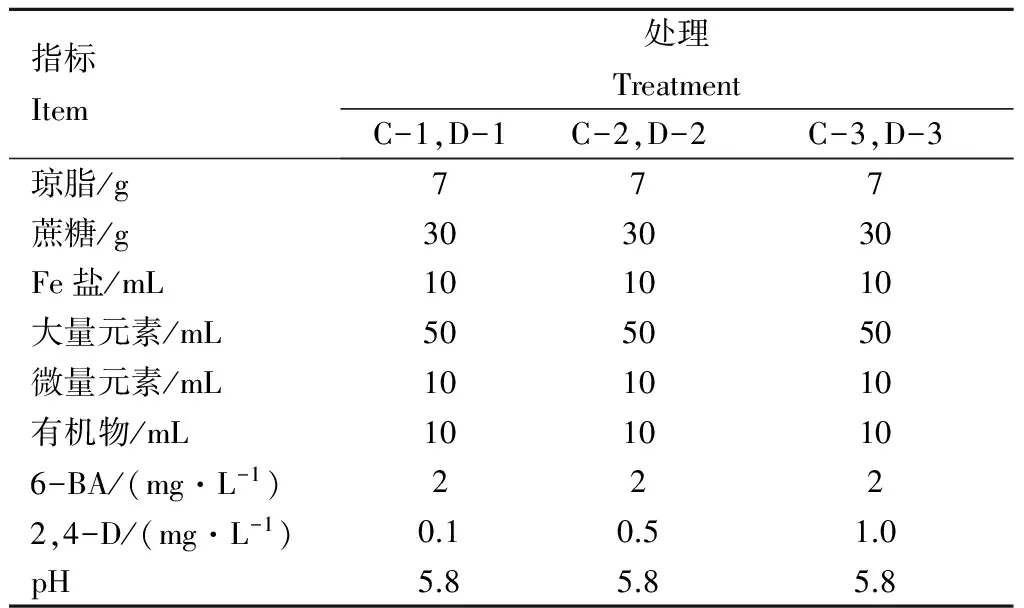
表2 不同质量浓度植物生长调节剂配比Table 2 The ratio of different concentration of growth regulatory substances
注: C-1叶片2,4-D 0.1 mg·L-1,C-2 叶片2,4-D 0.5 mg·L-1, C-3 叶片2,4-D 1 mg·L-1, D-1茎段2,4-D 0.1 mg·L-1,D-2茎段2,4-D mg·L-1,D-3茎段2,4-D 1 mg·L-1.
Note: C-1 Blade 2,4-D 0.1 mg·L-1,C-2 Blade 2,4-D 0.5 mg·L-1, C-3 Blade 2,4-D 1 mg·L-1, D-1 Stem 2,4-D 0.1 mg·L-1,D-2 Stem 2,4-D 0.5 mg·L-1,D-3 Stem 2,4-D 1 mg·L-1.
1.2.4 观察 每天对接种的培养基进行观察、记录,初代培养完成后总结记录结果.
2 结果与分析
2.1不同植物生长调节剂对愈伤组织诱导的影响
试验使用的植物生长调节剂为6-BA+2,4-D或6-BA+IAA,附加在 MS培养基上,观察雪椿产生愈伤组织的情况,包括出现愈伤组织前外植体的形态变化,愈伤组织形成的数量及愈伤组织的生长情况(包括愈伤组织的颜色、质地和色泽等);并计算外植体的愈伤组织污染率和诱导率.
诱导率=(愈伤组织材料数/总接种材料数)×100%
(1)
污染率=(污染材料数/总接种材料数)×100%
(2)
由表3可看出,6-BA+2,4-D与6-BA+IAA作为生长调节剂时对叶片愈伤组织的诱导率相差较大,对茎段愈伤组织的诱导率相差不大,通过观察可得,处理A比处理B愈伤组织总体生长状况较好,其中处理A-1生长状态最好,由此得知,生长调节剂为6-BA+2,4-D的组合最佳.

表3 不同种类生长调节剂处理对愈伤组织的生长状况的影响Table 3 The effects of different kinds of hormone treatment on callus growth condition
注: + 愈伤组织生长慢,数量少,褐化严重;++ 愈伤组织生长慢,数量较少;+++愈伤组织生长快,数量较多;++++愈伤组织生长旺盛,数量多,质地细密.
Note: + indicates the growth of callus is slow with less quantity and serious browning;++ indicates the growth of callus is slow with less quantity;+++ indicates the growth of callus is fast with large quantity;++++ The callus grows thrive with large quantity and the quality of materials is close.
2.2不同质量浓度的2,4-D对愈伤组织诱导的影响
在6-BA 2 mg·L-1+2,4-D的激素组合中,对2,4-D的质量浓度设置3个梯度,分别对嫩叶片和茎段进行诱导处理,观察外植体的生长状况得到最佳的激素质量浓度. 由表4可以看出,处理C-2和D-2对外植体愈伤组织的诱导率较高,其中C处理的诱导率普遍高于D处理,在实际观察中发现,叶片在愈伤组织诱导过程中2,4-D质量浓度为0.5 mg·L-1的愈伤组织生长状况最佳;茎段在愈伤组织诱导过程中2,4-D的最佳质量浓度为0.5 mg·L-1的愈伤组织生长状况最佳,而此时质量浓度在C,D处理中褐化程度也最低.
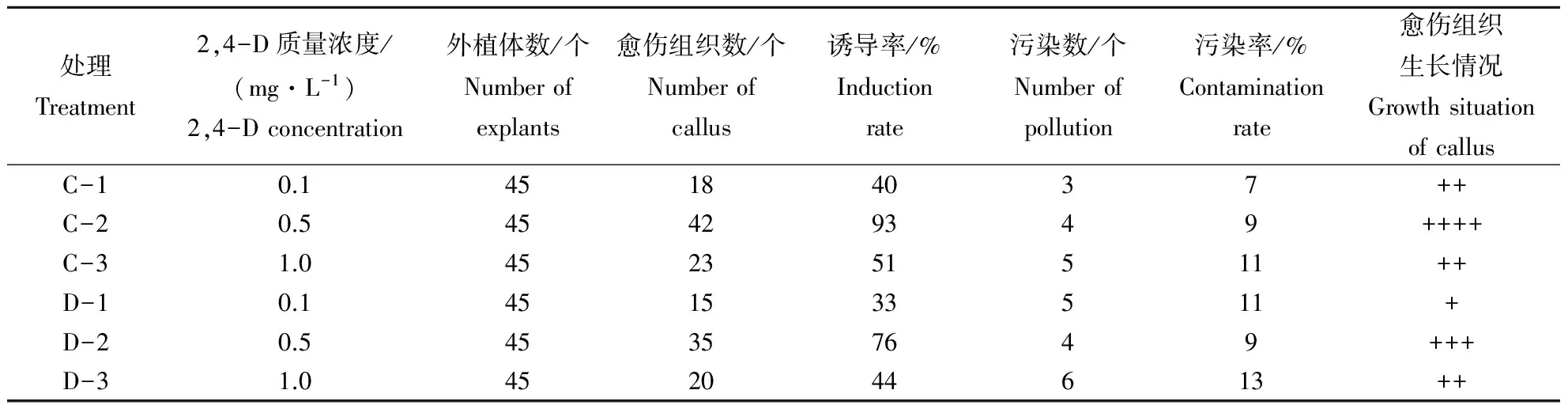
表4 不同质量浓度的生长调节剂处理对愈伤组织的生长状况的影响Table 4 The effects of different concentrations of hormone treatment on callus growth condition
2.3不同外植体对愈伤组织诱导影响的分析
从图1、图2可知,在相同的培养时间里,叶片形成的愈伤组织的时间短,叶片诱导形成的愈伤组织生长状态也更好,愈伤的状态呈浅绿色,质地细密,且褐化数量较少,可以确定叶片为愈伤组织诱导率最佳的外植体.
3 结论与讨论
3.1不同植物生长调节剂与雪椿愈伤组织诱导的关系
不同的植物生长调节剂对试管苗生根影响差异较大,对愈伤组织诱导的影响差异也较大.植物生长调节剂是微量的有机分子,对植物的生长、发育、衰老、休眠、抗逆性具有极其重要的作用.刘志华等[9]报道,植物生长调节剂是培养基的关键物质,对植物组织培养起着决定性作用.植物生长调节剂用量虽少,但它们对外植体愈伤组织的诱导起着重要的调节作用,其中以生长素类和细胞分裂素类最为常用.在诱导愈伤组织的培养基中,生长素和细胞分裂素是必需的,缺一不可.
本试验中,使用 6-BA和IAA, 2,4-D的组合,发现外植体的生长状况反应不同,两个组合诱导率基本相同,但是6-BA+2,4-D,产生愈伤组织的时间早,且生长状况最佳,褐化程度较低,这与夏泉生等[6]人对山茶花的研究结果不一致,生长素使细胞中的酶系统活跃起来,引起呼吸作用和代谢作用的加强,同时,细胞在生长素的作用下发生分生和分化,形成大量的愈伤组织,但可能是由于试验过程中IAA有不同程度的见光分解,同时不同植物对营养的吸收是不同的,不同条件下吸收程度也不一样,还可能有其他原因造成结果不一致,使本试验中加入2,4-D的生长状况更好,具体原因还需要进一步的研究.汪结明[10]等在研究中指出,在对山茶叶片进行组织培养时,6-BA 质量浓度不宜过高,如果达到 0.5 mg·L-1时愈伤组织的褐化情况将会十分严重.本实验6-BA的用量达到2 mg·L-1不仅没有出现大量的褐化,而且生长状况良好.

图2 茎段作为外植体诱导出的愈伤组织Fig.2 Callus induced by stem as explants
3.2不同质量浓度植物生长调节剂与雪椿愈伤组织诱导的关系
植物激素是促进生根的生长调节剂,但不同植物根的诱导对激素种类质量和质量浓度的需要各不相同.陈丽文等[11]提出:在MS + 6-BA 5.0 mg·L-1+ NAA 1.0 mg·L-1培养基中茎段形成的愈伤组织部分呈水渍状,这可能是由于诱导培养使用的生长素质量浓度过高引起的,说明植物生长调节剂的质量浓度对植物的培养有很大影响.本试验以MS为基本培养基,当培养基加入不同质量浓度的2,4-D后,培养基的状态是不同的,对外植体的愈伤组织的诱导率影响也是不同的.质量浓度0.1 mg·L-1时,愈伤组织的状态基本没有变化,褐化情况较多;质量浓度0.5 mg·L-1时,愈伤组织的状态是浅绿色,质地致密,生长旺盛;质量浓度1.0 mg·L-1时,愈伤组织的状态是深绿色,质地较为坚硬.由以上结论可知:以 2,4-D质量浓度为0.5 mg·L-1为最好,叶片和茎段出愈率分别为93 % 和76 %;其次为1.0 mg·L-1,叶片和茎段出愈率分别为51 % 和44 %;最后是0.1 mg·L-1,叶片和茎段出愈率分别为40 % 和33 %,出愈率最差,生长状态也最差,褐化程度也较高.
杨凯[8]认为,采用6-BA 1.0 mg·L-1+ NAA 0.2 mg·L-1对山茶胚状体的愈伤组织诱导是最适宜.此外,在离体培养条件下,不同植物由于各自的遗传特性、生物学特性都不一样,因此植物组织保持良好生长的营养要求随植物种类而变化,甚至同一植物的不同部位的组织以及同一部位的组织在不同生长时期对营养的要求也不一样,吸收程度也不一样,只有满足了它们各自的要求,才能正常生长,因此选择适宜的培养基及其添加物质对植物组织培养特别重要.
3.3外植体与雪椿愈伤组织诱导的关系
能否有效地控制微生物污染是油茶无性系组织培养能否成功的关键技术之一,污染分为外植体,培养基和无菌操作3个方面[5],这对于山茶花组织培养也同样适用,其中外植体方面的污染是最复杂,也最难控制,由于选用的外植体较幼嫩,经过消毒灭菌会对其造成不同程度的损伤,导致褐化现象加重,且取自田间的外植体带菌较多,较难彻底消毒灭菌,这与外植体本身的生长发育和生理生化状态有关,因而对外植体的筛选是组织培养中很关键的技术.先期试验发现,在山茶组织培养过程中,剪切外植体如果伤口过多会导致叶片褐化非常严重,无法形成愈伤,那是因为在剪切外植体时会溢泌一些酚类物质产生褐化现象,这更增加了组织培养的难度[10].外植体在黑暗条件下培养, 用1 ‰抗坏血酸处理茎段及芽尖外植体、在培养基中加入一定比例的活性碳、在外植体行接种前再剪去一部分茎段、对外植体勤转瓶等措施可以在一定程度上减轻山茶花外植体组培过程中的褐化[12].
综上所述,雪椿愈伤组织诱导体系建立的最佳方案为:培养基采用 MS +6-BA 2 mg·L-1+2,4-D 0.5 mg·L-1,在PH 5.8条件下,接种外植体采用幼嫩叶片,每日光照14 h,温度 22 ℃,光照强度 1 800~2 500 Lx,静置培养.该试验方案经过多次试验,具有可操作性,可以应用于大规模生产和研究.
[1] 阌天禄.山茶属山茶组植物的分类、分化和分布[J].云南植物研究,1998,20(2):127-148.
[2] 闵天禄.山茶属的系统大纲[J].云南植物研究,1999,21(2):149-159.
[3] 董慧慧,王奎玲,薛秋华,等.耐冬山茶愈伤组织诱导研究[J].福建林业科技,2007,34(3) :135-138,154.
[4] 赖钟雄,林 莉. 山茶属植物体细胞胚胎发生研究进展[J]. 福建农林大学学报, 2004,33(4):471-476.
[5] 毕方铖,谭晓风,张智俊,等.油茶离体培养诱导再生植株的研究[J].经济林研究,2004,22(2):5-9.
[6] 夏泉生.山茶花[M].上海:上海科学技术出版社,2000.
[7] 袁 颖. 攀西西南山茶幼叶愈伤组织诱导研究[J].安徽农业科学,2009 ,37(17) :7866 -7867.
[8] 杨 凯.耐冬山茶胚状体和胚性愈伤组织诱导研究[J].青岛农业大学学报:自然科学版, 2013,30(3):184-187.
[9] 刘志华,马艳红,曹 枫.罗布麻种子组培再生体系的研究[J].种子, 2010,29(4):5-8.
[10] 汪结明,周 倩,李瑞雪. 不同激素配比对诱导栓壳红山茶愈伤组织的影响[J]. 中国农学通报, 2011,27(13):112-115.
[11] 陈丽文,荣 薏,何贵整.金钻蔓绿绒组培再生体系的建立[J].北方园艺,2012(01):120-121.
[12] 张志兰. 山茶花组织培养过程中的防外植体褐化试验 [J].西部林业科学,2007,36(2):118-121.
(责任编辑:梁保松)
EstablishmentofcallusinductionsystemofCamelliajaponica
ZHANG Ning, WU Ya-wen, LIU Zhen
(College of Forestry, Henan Agricultural University, Zhengzhou 450002, China)
The experiment focused on the influence of different types of growth regulators and explants on inductive effect of callus induction in callus induction process ofCamelliajaponicavar.decumbensfrom Japan. The results showed that: MS+6-BA 2.0 mg·L-1+2, 4-D 0.5 mg·L-1was the best medium for callus induction medium . The optimal induction and growth condition was to take Camellia japonica new leaves as explants.
Camelliajaponica; explants; growth regulators; tissue culture
1000-2340(2014)06-0701-05
S 685.14
:A
2014-07- 11
国家林业局948项目(2011441)
张 宁,1989年生,女,河南宝丰人,硕士研究生,从事森林培育学与树木生理生态学研究.
刘 震,1964年生,男,河南沈丘人,教授,博士生导师.
