大鼠脑出血后蛋白酶激活受体-1与细胞凋亡关系的实验研究*
2014-09-26张德绸杨云芳
张德绸,白 雪,杨云芳,罗 钢
(泸州医学院附属中医院心脑病科,四川泸州646000)
脑出血(intracerebral hemorrhage,ICH)是最常见的急性脑血管性疾病,发病率0.86%~7.32%,病死率50.0%~67.7%,存活患者约3/4不同程度地丧失劳动能力,严重者丧失自理能力,给家庭及社会带来沉重的经济负担等[1-2]。近年研究表明,ICH后血肿周围组织存在大量蛋白酶激活受体-1(proteinase activated receptor-1,PAR-1)可引起细胞凋亡,但ICH后PAR-1、小胶质细胞与神经凋亡细胞关系未见研究报道。本实验主要采用ICH大鼠模型,探讨ICH后PAR-1、血肿周围神经细胞凋亡、小胶质细胞之间关系及PAR-1在ICH后脑损伤可能存在的病理、生理机制,现报道如下。
1 材料与方法
1.1 材料 健康雄性SD大鼠60只280~320g(由泸州医学院实验动物中心提供),PAR-1抗体(Sigma公司),TUNEI试剂盒(Roche公司),OX-42(CD11b)单抗(Sigma公司)。
1.2 方法
1.2.1 实验分组及动物模型建立 实验动物分为假手术组、ICH组,每组30只,每组再随机分为6个亚组。本实验采用自体不凝血注入大鼠ICH模型,参照Xue等[3]方法制备脑出血模型。2%戊巴比妥钠腹腔注射麻醉(30mg/kg)后固定于大鼠脑立体定位仪上,正中切开头皮,暴露前囟、冠状缝,选择前囟后0.5mm、右3.0mm、深度5.5mm为自体凝血注射部位;同时剪断鼠尾,含抗凝剂EP管收集鼠尾滴下血,微量注射器抽不凝血50μL缓慢匀速5μL/min注入壳尾核,骨蜡填塞针孔,缝合头皮。假手术组以0.9%生理盐水50μL代替自体血。术后给予同等环境及饲料喂养。术后不同时间点:6h、1 d、2d、3d、5d、7d断头处死大鼠。
1.2.2 观察指标
1.2.2.1 PAR-1阳性细胞数 将各组各时间点大鼠断头取脑,4%甲醛溶液固定,石蜡包埋,取出脑组织在血肿区做冠状切片,常规脱水、浸蜡、包埋,将脑组织切成厚4mm切片,采用免疫组织化学染色(SP)法观察PAR-1阳性细胞数,将SP法染色切片在400倍光学显微镜下观察,主要分布在血肿周围组织,胞膜、胞质呈棕黄色,可清楚的分辨出细胞核形态的为PAR-1阳性细胞。随机选取5个视野,取其平均值。
1.2.2.2 凋亡神经细胞计数 脑组织石蜡载片用TUNEL原位染色(按说明书进行),400倍光学显微镜下观察,细胞核中有紫红色颗粒者为TUNEL染色阳性凋亡神经细胞。凋亡细胞计数方法同PAR-1SP法。
1.2.2.3 小胶质细胞计数 使用OX-42标记小胶质细胞方法[4]。OX-42阳性细胞:主要是小胶质细胞(核呈棕黄色)。ICH组在6h时OX-42染色较浅,数量少,细胞形态欠清楚,尚可见长的突起,24h时数量明显增多,形态改变呈圆形、椭圆型或梭型,2d时数量和体积达高峰,以后逐渐减少,7d仍可观察到其数量较少、形态变化不大。在假手术组未见有OX-42阳性细胞。
1.3 统计学处理 采用SPSS13.0软件进行统计分析,计量资料以s表示。ICH组内各时间点及与假手术组比较采用单因素方差分析,确定有差异后采用最小有意义差异法比较,以P<0.05为差异有统计学意义。
2 结 果
ICH组不同时点血肿周围PAR-1阳性细胞、凋亡细胞、小胶质细胞与假手术组比较明显增加,PAR-1阳性细胞、凋亡细胞3d达高峰,之后PAR-1逐渐下降至正常,但凋亡细胞下降缓慢仍维持较高水平,小胶质细胞2d达高峰,之后逐渐下降,与PAR-1阳性细胞、凋亡细胞比较三者呈正相关(P<0.05),见表1~3。光镜下血肿周围组织,胞浆或胞核中染有棕黄色颗粒者为PAR-1阳性细胞;染色质浓集于核周、呈新月形、环形、长条形、块状小体甚至形成核碎片状为凋亡细胞;小胶质细胞为OX-42标记的阳性细胞,核呈棕黄色,有突起,见图1~6。
表1 两组PAR-1阳性细胞数±s)
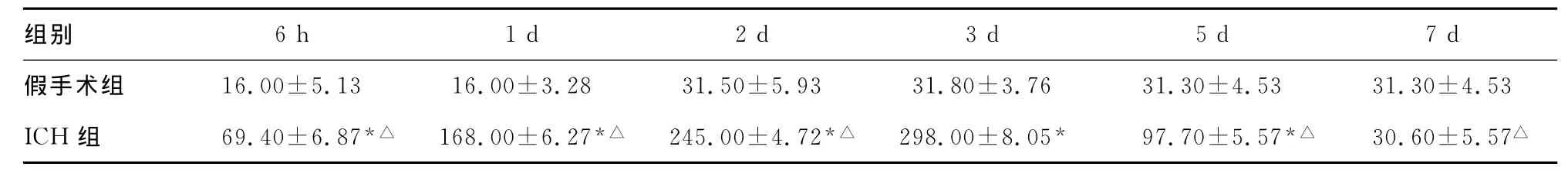
表1 两组PAR-1阳性细胞数±s)
*:P<0.05,与假手术组比较;△:P<0.05,与ICH组3d比较。
组别6 31.30±4.53 31.30±4.53 ICH组 69.40±6.87*△ 168.00±6.27*△ 245.00±4.72*△ 298.00±8.05* 97.70±5.57*△ 30.60±5.57 6h 1d 2d 3d 5d 7d假手术组 16.00±5.13 16.00±3.28 31.50±5.93 31.80±3.7△
表2 两组TUNEL染色阳性细胞数±s)

表2 两组TUNEL染色阳性细胞数±s)
*:P<0.05,与假手术组比较;△:P<0.05,与ICH组3d比较。
组别0±1.65 3.40±1.61 ICH组 65.00±2.69*△ 91.80±8.29*△ 106.00±5.31* 171.00±6.76* 112.30±7.67*△ 98.20±8.33 6h 1d 2d 3d 5d 7d假手术组 3.60±1.24 3.40±2.01 3.50±2.59 3.50±1.96 3.3*△
表3 两组小胶质细胞数比较

表3 两组小胶质细胞数比较
*:P<0.05,与假手术组比较;△:P<0.05,与ICH组2d比较。
组别6h 1d 2d 3d 5d 7d假手术组000000 ICH组 28.30±3.68*△ 62.80±5.78*△ 96.80±9.57* 79.60±7.89*△ 50.30±8.12*△ 16.90±6.32*△

图1 假手术组PAR-1阳性细胞(×400);

图2 ICH组3dPAR-1阳性细胞(×400);

图3 假手术组TUNEL阳性细胞(×400)

图4 ICH组3dTUNEL阳性细胞(×400);

图5 假手术组OX-42阳性细胞(×400);
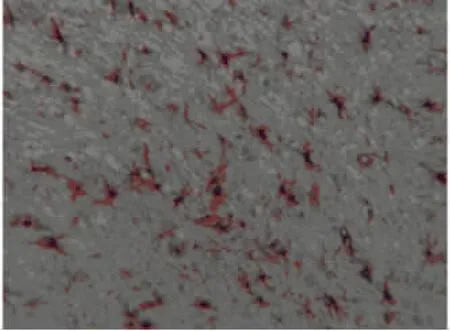
图6 ICH组2dOX-42阳性细胞(×400)
3 讨 论
ICH最主要的病理改变为血肿对周围脑组织的压迫和血肿的介质释放所诱发的继发性损伤。血肿压迫周围脑组织可引起血肿周围脑组织机械性损伤,同时占位效应导致血肿周围微循环障碍、血管痉挛、再灌注损伤等,进一步引起脑组织缺血、缺氧,发生脑神经细胞的缺血坏死[5]。另外,血肿压迫周围脑组织血液循环障碍,继发性酸中毒、血管麻痹、血液分解产物释放生物活性物质等加重对脑组织的损害;血管内皮细胞损伤产生的内皮素可导致细胞内钙离子超载激惹神经毒性氨基酸,促进神经细胞的缺血坏死和凋亡。
ICH后血肿降解释放出凝血酶、血红蛋白、血浆蛋白和C反应蛋白等活性物质,在对ICH后脑组织继发性损伤中凝血酶占据重要角色[6-7]。凝血酶由无活性的凝血酶原产生,是凝血级联反应过程的关键酶,也是重要的细胞外信号因子之一[8-9]。凝血酶的生物活性主要由 PAR-1介导,PAR-1在脑内海马、丘脑、下丘脑、纹状体等部位广泛分布。正常生理状态下,体内有PAR-1少量表达,激活后介导跨膜信号转导:细胞内Ca2+的移动和蛋白磷酸化,产生一系列生理效应[10];病理状态下,组织损伤后,PAR-1表达明显上调,可能介导凝血酶的系列反应,引起神经细胞毒性损伤,导致死亡[11-13]。
本实验结果显示,ICH后血肿周围PAR-1阳性细胞、凋亡细胞、小胶质细胞明显增加,PAR-1阳性细胞、凋亡细胞3d达到高峰,小胶质细胞2d达到高峰,高峰之后逐渐下降,说明ICH后PAR-1阳性细胞与神经凋亡细胞、小胶质细胞的表达基本一致,ICH后PAR-1表达上调可能通过以下途径引起细胞凋亡:(1)血肿压迫周围脑组织导致机械性损伤致脑神经细胞的凋亡。局部脑组织受挤压发生缺血改变,脑血管通透性的增加致脑水肿及脑内高压加重脑组织缺血、缺氧,进而可能介导PAR-1释放增加,凝血酶原大量激活导致一系列级联反应,神经细胞凋亡明显增加,和李恒等[14]实验研究PAR-1与凝血酶在ICH后的表达趋势基本一致;(2)血肿本身的血细胞破坏、炎性介质释放,大量凝血酶原激活可能通过PAR-l介导而增加血脑屏障通透性,造成血管源性脑水肿,另外,凝血酶也可能通过PAR-1介导而影响水通道蛋白4的机能[15],加剧ICH后脑组织水肿。(3)除作为ICH启动脑水肿形成的“扳机点”外,凝血酶可以通过PAR-1介导引起小胶质细胞的激活,然后可能通过2条途径发挥细胞毒性效应。一是通过释放一系列潜在的神经毒性物质、炎性因子和酶等导致继发性脑损害,介导神经细胞凋亡;二是通过与神经细胞直接接触,发挥脑内吞噬细胞的毒性作用[16-17],进而可能加重ICH后的继发性损伤。
本研究表明,ICH后凝血酶可能通过不断激活PAR-1,PAR-1再次激活神经小胶质细胞大量产生尽而进一步损害脑神经细胞和对细胞毒性损害作用,造成脑细胞毒性水肿、炎性介质反应等多种损伤机制导致神经细胞凋亡。ICH脑出血损伤的病理生理机制极其复杂,通过对PAR-1介导的脑神经细胞的凋亡的深入研究可能对今后临床治疗ICH提供一定的科学依据。
[1]王颖,齐晓飞.我国各地脑卒中流行病学调查近况[J].包头医学,2010,34(1):1-3.
[2]李云鹏,柳胜生,苏旭燕,等.上海市松江区2001年~2008年脑卒中流行病学分析[J].上海预防医学,2010,22(1):22-25.
[3]Xue M,Del Bigio MR.Intracerebral injection of autologous whole blood in rats:time course of inflammation and cell death[J].Neurosci Lett,2000,283(3):230-232.
[4]周杰,章翔,蒋晓帆,等.白藜芦醇对脑创伤后小胶质细胞激活的影响[J].中华神经外科疾病研究杂志,2007,6(1):39-43.
[5]安立新,王保国.脑出血病理生理机制的研究进展[J].麻醉与监护论坛,2006,13(5):297-300.
[6]Zheng GQ,Wang XT,Wang XM,et al.Long-time course of protease-activated receptor-1expression after intracerebral hemorrhage in rats[J].Neurosci Lett,2009,459(2):62-65.
[7]Xue M,Hollenberg MD,Demchuk A,et al.Relative importance of proteinase-activated receptor-1versus matrix metalloproteinases in intracerebral hemorrhage-mediated neurotoxicity in mice [J].Stroke,2009,40(6):2199-2204.
[8]赵巧珍,杨文,杨期明,等.脑出血的病理损伤机制研究进展[J].医学创新研究,2008,8(24):34-35.
[9]Kawabata A.PAR-2:structure,function and relevance to human diseases of the gastric mucosa[J].Expert Rev Mol Med,2002,4(16):1-17.
[10]关景霞,叶应湖.大鼠脑出血后血肿周围蛋白酶激活受体-1的表达及其机制[J].中华实验外科杂志,2006,23(12):1460-1462.
[11]Rohatgi T,Henrich-Noack P,Sedehizade F,et al.Transient focal ischemia in rat brain differentially regulates mRNA expression of protease-activated receptors 1to 4[J].J Neurosci Res,2004,75(2):273-279.
[12]Keep RF,Xi G,Hua Y,et al.The deleterious or beneficial effects of different agents in intracerebral hemorrhage:think big,think small,or is hematoma size important?[J].Stroke,2005,36(7):1594-1596.
[13]Nakamura T,Xi G,Park JW,et al.Holo-transferrin and thrombin can interact to cause brain damage[J].Stroke,2005,36(2):348-352.
[14]李恒,吴鹤,丛玉玮,等.大鼠脑出血后脑组织蛋白酶连接素-1、凝血酶和蛋白酶激活受体-1表达变化的实验研究[J].中华神经医学杂志,2009,10(10):1006-1010.
[15]Tang Y,Cai D,Chen Y.Thrombin inhibits aquaporin 4 express through protein C-dependent pathway incultured astrocytes[J].J Mol Neurosci,2007,31(1):83-93.
[16]Suo Z,Citron BA,Festoff BW,et al.Thrombin:apotential proinflammatory mediator in neurotrauma and neurodegenerative disorders[J].Curt Drug Targets Allergy,2004,3(1):105-114.
[17]张兆波,贾保祥.脑出血后凝血酶的毒性作用及抗凝血酶治疗现状[J].中华神经医学杂志,2006,5(10):1076-1078.
