HPLC同时测定保胎灵中芍药苷和五味子醇甲的含量
2014-09-26孙强王涛刘斌
孙强,王涛,刘斌
(泰安市食品药品检验中心,山东 泰安 271000)
HPLC同时测定保胎灵中芍药苷和五味子醇甲的含量
孙强*,王涛,刘斌
(泰安市食品药品检验中心,山东 泰安 271000)
目的:建立同时测定保胎灵中芍药苷和五味子醇甲含量的高效液相色谱方法。方法:采用Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);以甲醇为流动相A,水为流动相B,梯度洗脱;流速为0.8 mL·min-1;检测波长为220 nm。结果:芍药苷、五味子醇甲的线性范围分别为0.052~1.04 μg(r=0.999 9,n=6),0.055 8~1.116 μg(r=0.999 8,n=6)。加样回收率分别为96.6%,96.1%(n=6)。结论:该方法可靠、准确、专属性强,可有效控制保胎灵的质量。
保胎灵;芍药苷;五味子醇甲;高效液相色谱
保胎灵由熟地黄、五味子、白芍、巴戟天、槲寄生等14味中药制成,具有补肾、固冲、安胎的功能,用于先兆流产,习惯性流产及因流产引起的不孕症[1]。该品种收载于《卫生部药品标准·中药成方制剂》第四册,现行标准中仅有显微鉴别以及片剂的检查项目,且相关文献也只有芍药苷含量的高效液相测定方法[2-3]。为了更好地控制产品质量,笔者采用HPLC梯度洗脱法在同一色谱条件下,选用合适的检测波长分别对白芍中的芍药苷以及五味子中的五味子醇甲进行含量测定。
1 仪器与试药
1.1 仪器
LC-2010液相色谱仪(岛津)。
1.2 试药
芍药苷对照品、五味子醇甲对照品(中国食品药品检定研究院,批号分别为110736-201035,110857-201010);甲醇为色谱纯;水为纯化水;其他试剂为分析纯;保胎灵(吉林国药制药有限责任公司,规格0.3 g/片:,批号:20121101,20120701,20120401)。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);以甲醇为流动相A,以水为流动相B,按表1进行梯度洗脱;流速:0.8 mL·min-1;检测波长:220 nm;柱温:30 ℃;进样量:10 μL。

表1 流动相洗脱程序
2.2 混合对照品溶液的制备
取芍药苷对照品、五味子醇甲对照品适量,精密称定,加甲醇制成每1 mL含芍药苷50 μg、五味子醇甲25 μg的混合对照品溶液,即得。
2.3 供试品溶液的制备
取保胎灵20片,除去包衣后,精密称定,研细,再分别精密称定本品粉末0.5 g,置锥形瓶中,精密量取25 mL甲醇,称定,置水浴上加热回流30 min,放冷,称定,用甲醇补足减失的重量,摇匀,过滤,经0.45 μm滤膜滤过,取续滤液,即得。
2.4 阴性样品溶液的制备
按处方中的比例,取除白芍和五味子以外的其他中药,按标准中的工艺制成阴性制剂,再按2.3制成阴性样品溶液。
2.5 系统适用性试验
精密吸取对照品溶液、供试品溶液、阴性样品溶液各10 μL,分别注入液相色谱仪,记录色谱图。结果显示,在与对照品色谱相对应的位置上,供试品溶液具有相同保留时间的色谱峰,而阴性样品溶液在此处无干扰。见图1。
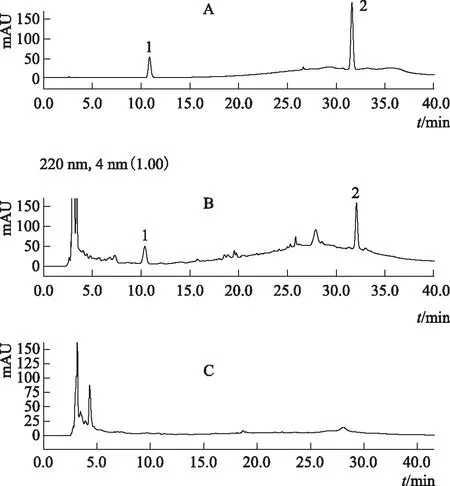
A.混合对照品 B.供试品 C.阴性样品 1.芍药苷 2.五味子醇甲图1 保胎灵及对照品溶液HPLC图
2.6 线性关系考察
分别精密吸取每1 mL含芍药苷104.0 μg、五味子醇甲111.6 μg的混合对照品溶液0.5,1.0,2.0,3.0,5.0,10 mL,置于10 mL容量瓶中,加甲醇定容,摇匀,得系列对照品溶液。分别吸取系列对照品溶液各10 μL注入液相色谱仪中,记录峰面积。以对照品进样量(μg)为横坐标(X),以峰面积为纵坐标(Y),绘制标准曲线,得芍药苷回归方程:Y=1.221×106X+70.1,r=0.999 9;五味子醇甲回归方程:Y=6.737×106X+2.58×103,r=0.999 8。结果表明,芍药苷在0.052~1.04 μg、五味子醇甲在0.055 8~1.116 μg与峰面积呈良好的线性关系。
2.7 精密度试验
精密吸取对照品溶液,重复测定6次,每次10 μL,测定峰面积,计算芍药苷峰面积的RSD=0.66%(n=6),五味子醇甲峰面积的RSD=0.59%(n=6),表明仪器精密度良好。
2.8 稳定性试验
取同一供试品溶液(批号:20121101),在配制后0,1,3,8,12,24 h精密吸取10 μL,注入液相色谱仪中,测定芍药苷和五味子醇甲峰面积,计算芍药苷峰面积的RSD=0.53%(n=6),五味子醇甲峰面积的RSD=0.71%(n=6),表明供试品溶液在24 h内稳定性良好。
2.9 重复性试验
取保胎灵(批号:20121101)样品6份,按供试品溶液制备方法制备溶液,进行含量测定,结果芍药苷平均质量分数为1.13 mg·g-1,RSD=0.72%(n=6);五味子醇甲平均质量分数为0.672 mg·g-1,RSD=0.69%(n=6),说明该方法重复性良好。
2.10 加样回收试验
精密称取保胎灵(批号:20121101)样品6份,各0.25 g,按2.3制备溶液后分别精密加入质量浓度为0.101 2 mg·mL-1的芍药苷对照品溶液3 mL(0.303 6 mg)、质量浓度为0.112 2 mg·mL-1的五味子醇甲对照品溶液1.5 mL(0.168 3 mg),计算回收率,结果见表2。

表2 保胎灵中芍药苷和五味子醇甲回收率试验
2.11 样品含量测定
取3批保胎灵样品,按2.3制成供试品溶液,分别精密吸取对照品溶液与供试品溶液10 μL,注入液相色谱仪,按上述色谱条件测定,以外标法测定芍药苷及五味子醇甲的含量,结果见表3。

表3 保胎灵中芍药苷及五味子醇甲的测定 mg/片
3 讨论
3.1 提取条件的选择
分别考察加热回流法、超声提取法对芍药苷和五味子醇甲的提取效率,结果表明,加热回流提取效率更高;提取溶剂分别考察了纯甲醇、80%甲醇、50%甲醇,结果表明纯甲醇提取效果最佳;同时考察了体积分别为15,25,50 mL的甲醇,结果表明25 mL的甲醇即可完全提取,最终确定纯甲醇25 mL加热回流30 min作为提取条件。
3.2 检测波长的选择
取对照品溶液,按色谱条件在190~400 nm进行二极管阵列检测,兼顾芍药苷和五味子醇甲的紫外最大吸收波长,并查阅相关文献[2-5],最终确定检测波长为220 nm。
3.3 流动相的选择
分别考察了甲醇-水、乙腈-水、甲醇-0.05%磷酸溶液,结果甲醇-水峰型较好,分离较理想。
3.4 指标成分的确定
保胎灵中白芍和五味子用量都较大,芍药苷作为白芍的功效成分其在药材中含量较高,且性质稳定;五味子醇甲作为五味子的专属性成分,含量高且性质稳定,能够和南五味子进行区别,所以选择芍药苷及五味子醇甲作为保胎灵含量的控制指标。与单一的芍药苷含量指标[3-4]相比,增加五味子醇甲的含量指标更能体现中成药复方整体作用的特点。实验建立的方法可靠、准确、专属性强,可有效控制保胎灵的质量。
[1] 卫生部.卫生部药品标准·中药成方制剂[S].第四册.1991:133.
[2] 李妍,孙成娟,李桂明.保胎灵定性定量方法研究[J].中国药品标准,2009,10(4):268-271.
[3] 曾重英,龙海燕.高效液相色谱法测定保胎灵中芍药苷含量[J].中国药业,2011,20(9):20-21.
[4] 施祖勇,谭军.高效液相色谱法测定复方益肝灵片中五味子醇甲、五味子醇乙和五味子甲素的含量[J].中南药学,2011,9(4):264-267.
[5] 郭汉文,白旭东.HPLC双波长法测定更年安胶囊中二苯乙烯苷和五味子醇甲的含量[J].西北药学杂志,2013,28(3):260-263.
DeterminationofPaeoniflorinandSchisandrininBaotailingTabletsbyHPLC
Sun Qiang*,Wang Tao,Liu Bin
(TaianFoodandDrugInspectionCenter,Taian271000,China)
Objective:To establish an HPLC method for the determination of paeoniflorin and schisandrin in Baotailing tablets.Methods:The separations were performed on an Agilent ZORBAX SB C18 column(250 mm×4.6 mm,5 μm).The mobile phase consisted of methanol(A)-water(B)with gradient elution at a flow rate of 0.8 mL·min-1and the detection wavelength was 220 nm.Results:The linear range was 0.052~1.04 μg(r=0.999 9,n=6)for paeoniflorin and 0.055 8~1.116 μg(r=0.999 8,n=6)for schisandrin,respectively.The average recoveries of paeoniflorin and schisandrin were 96.6% and 96.1%(n=6).Conclusion:The method is reliable,accurate and specific,and can be used for the quality control of Baotailing Tablets.
Baotailing Tablets;Paeoniflorin;Schisandrin;HPLC
10.13313/j.issn.1673-4890.2014.11.012
2014-03-07)
*
孙强,主管药师,研究方向:中药、中成药、保健食品的质量控制;E-mial:mobile1127@163.com
