低频噪声对小鼠骨髓细胞微核率的影响
2014-09-24罗玲玲郭新亮
罗玲玲,郭新亮
(宁夏大学 资源环境学院,宁夏 银川 750021)
低频噪声作为职业类噪声和生活类噪声的共有部分,在城市化进程不断加快的今天,已经成为不容忽视的环境问题之一[1].人们的可听声频率范围为20~20000赫兹,通常200赫兹以下的噪声为低频噪声,变压器噪声、水泵噪声、空调噪声、交通噪声等[2].国内外已有研究结果表明,城市环境噪声中的低频噪声越来越大,人们对低频噪声烦恼度增加,明显高于中高频噪声,长期暴露会对人体造成神经衰弱,失眠,头痛等各种神经官能症的慢性损伤[3].
本文观察低频噪声暴露下小鼠的生理效应,以行为的改变和骨髓微核率的变化作为主要的观测指标,探讨低频噪声对小鼠行为及骨骼细胞微核率的影响[4].
1 实验方法
1.1 交通噪声的采集与模拟声频转换
交通噪声的采集:选取银川市北京路上路面车道一侧作为监测点,监测点周围地势开阔平坦,无障碍物.将TES-1357噪声检测仪置于距离街口50m以上,距路肩10cm,离路面高度为1.2m处,测量时间段为每天的三个交通高峰时间,即 7:30~8:30、12:30~1:30、18:30~19:30,每个时段连续监测1h.同期采集相应段位交通噪声,以录音机录制.
模拟声频转换:对所采集交通噪声的进行计算机声级分析处理与转录制,并以此作为后续实验的噪声源[5].先把噪声录入电脑,应用WAVECN2.0软件进行处理制成Mp3格式的音频文件,再用录音机进行转录.
1.2 小鼠行为改变:低频噪声暴露下小鼠行为变化观察法
小鼠骨髓细胞微核率影响:小鼠骨髓细胞微核试验法[6].
1.3 数据处理
数据经Excel平台处理完成.
2 试剂与器材
试剂:甲醇(分析纯)、甘油(分析纯)、小牛血清、生理盐水、Giemsa储备液、pH6.8的磷酸盐缓冲液.
动物:ICR小鼠(由宁夏医科大学动物实验中心提供).
器材:TES-1357噪声检测仪、录音机、扩音设备;手术刀、手术剪、眼科镊、医用纱布、带橡皮头吸管、台式离心机、刻度离心管、晾片架、电吹风机、玻璃蜡笔、玻璃染色缸、2ml注射器及针头、载玻片及推片、显微镜、细胞计数器.
3 试验过程
3.1 低频噪声暴露
实验动物及分组:健康ICR小鼠100只,雌雄各半,随机分为5组,每组20只且雌雄各半,分笼饲养,保证所有小鼠处于同一生长条件下.5组分别为:阴性对照组、60dB组、70dB组、80dB组、90dB组.
噪声暴露:以模拟处理的交通噪声发生器作为声源,噪声强度分别设计为60dB、70dB、80dB、90dB,其主要频率范围在0.25~4.00kHz.每天于早中晚三个固定时段,在互不影响的条件下,分别以60dB,70dB,80dB,90dB的低频噪声暴露于小鼠,每个时段连续影响1小时.暴露时扬声器置于鼠笼正前方,暴露过程中以TES-1357噪声检测仪即时监测,控制声压级变化范围不超过2dB,且尽量避免受到外界声源影响.实验周期30天.阴性对照组则在整个实验周期中正常饲养于背景噪声低于40dB的环境中.
3.2 小鼠行为变化观察
每次噪声暴露过程中及暴露结束后1小时随时记录小鼠的行为变化.
3.3 骨髓液制备、涂片及微核检测
小鼠最后一次噪声作用后,禁食24小时,用颈椎脱臼法将其处死,迅速用手术剪将其两腿股骨取下,剃下肌肉,用生理盐水洗去血污和碎肉,再剪去两端的骨骺,用带针头的1.0ml注射器吸取小牛血清,插入骨髓腔内,冲洗骨髓腔,将骨髓冲入离心管,然后用吸管吹打骨髓团块使其均匀,以1000r/min离心10分钟,取0.5ml上清液与沉淀物混匀,用滴管吸取混悬液并滴一滴再洁净的载玻片上,均匀推片,晾干;将推好晾干的骨髓片放入染色缸中,用甲醇溶液固定15min,取出晾干;将固定晾干后的涂片,用新鲜配制的Giemsa应用液染色10~15min,冲洗掉玻片上的染色液,置晾片架上晾干后在油镜下观察计数.
先在低倍镜下进行观察,选择分布均匀,染色较好的区域,再在油镜下观察计数,骨髓嗜多染红细胞(PCE)呈灰蓝色,正染红细胞(NCE)呈橘黄色.细胞中含有的微核多数呈圆形,边缘光滑整齐,嗜色性与核质一致,呈紫红色或蓝紫色.一个细胞内可出现一个或多个微核.计数1000个PCE中含微核的PCE数.
4 结果与分析
4.1 小鼠行为改变
由实验可知,随着噪声声级的变化,小鼠行为也在发生变化,由能正常进食、活动逐渐变为活动异常、烦躁不安、抱团嗜睡等状态.说明低频噪声从进食、个体活动、睡眠、神经行为等方面均对小鼠有不同程度的影响.小鼠行为的变化见表1.

表1 低频噪声暴露下小鼠行为变化
4.2 小鼠骨髓细胞微核率
本文只计数骨髓嗜多染红细胞(PCE)中的微核,微核率以千分率表示.每只动物为一观察单位,结果见表2.
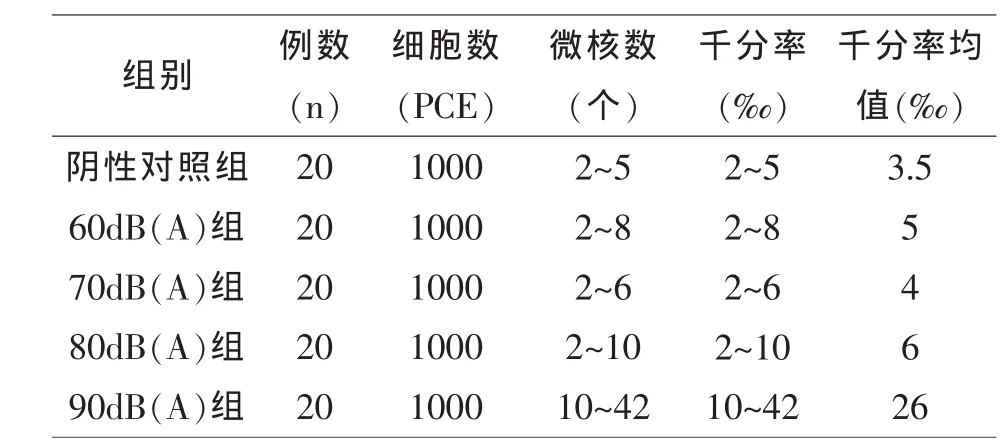
表2 低频噪声暴露下小鼠骨髓细胞微核率
由表2可知,对照组及四个实验组小鼠均有微核出现.阴性对照组与60dB组、70dB组、80dB组相比微核数基本稳定于2~10之间,分析认为是微核的自然产生或低频噪声对实验组的微弱影响而产生.但90dB组微核数有较大辐度增加,达到10~42‰,提示小鼠骨髓细胞微核的产生存在一定的低频噪声声级阈值.
对测得的小鼠骨髓细胞微核千分率,取其各组平均值,应用Excel进行线性趋势分析.结果显示,R=0.7570,各组间线性相关性较差,尤其是阴性对照组与60dB组、70dB组、80dB组几无差异,而90dB组差异较明显.这一结果也再次强调低频噪声对动物的影响是微弱长期的,若积累达到一定阈值则会产生较明显的影响甚至是遗传损伤.结果见图1.

图1 小鼠骨髓细胞微核率随低频噪声声级变化曲线
5 结论与讨论
由实验结果可知低频噪声作为一种有害的物理刺激,可影响到小鼠的一般状况及神经行为[7].随着噪声声级的不断增加,小鼠的行为从正常到个别个体出现应激反应及至整体出现烦躁不安、抱团嗜睡现象.同时亦可以证明随着低频噪声分贝的升高小鼠的应激反应越明显,其影响效果明显加大,且影响对其心情,睡眠造成一定的影响.
通过实验组与对照组的比较来看,60dB组、70dB组、80dB组与阴性对照组线性关系较好,说明他们无明显差异,而90dB组有较大突跃,说明小鼠微核的产生存在一个阈值,当噪声的作用超过这个阈值时,便使小鼠细胞产生了微核.
这说明并不是所有低频声范围的声源都可以使小鼠细胞产生了微核,只有达到一定的频率、阈值后才对小鼠的细胞产生一定程度的遗传损伤.
〔1〕刘砚华,张朋,高小晋.我国城市噪声污染现状与特征[J].中国环境监测,2009,25(4):88-91.
〔2〕柴俊霖,刘丽华,等.城市道路交通噪声分析与防治对策研究[J].噪声与振动控制,2008,10(5):126-127.
〔3〕陈美丽,何兰波.低频噪声对人体健康的影响[J].新医学导刊,2008,7(10):55-58.
〔4〕王艳.噪声干扰对小鼠学习和记忆的影响[J].畜牧与饮料科学,2010,31(8):45-46.
〔5〕黄武康,周长胜等.2.5W低噪声CMOS D类音频功放设计[J].固体电子学研究与进展,2010,30(1):108-113.
〔6〕李宏.微核试验的研究进展[J].安徽农业科学,2009,37(7):2864-2866.
〔7〕桑传兰,王萧,等.光照和噪声对实验小鼠血液指标及肝肾功能的影响[J].动物医学进展,2012,33(5):64-68.
