B7同源体3上调肺炎链球菌脑膜炎小鼠NSE和S100bmRNA的表达*
2014-09-22王延平陈旭勤王浙东张兵兵傅丰庆
王延平,陈旭勤△,王浙东,张兵兵,傅丰庆,李 岩▲
(1.苏州大学附属儿童医院神经内科,江苏苏州 215003;2.苏州大学医学生物技术研究所,江苏苏州 215004)
肺炎链球菌(streptococcus pneumococcal,SP)是引起化脓性脑膜炎最常见的革兰阳性细菌之一[1]。在能引起神经系统后遗症的中枢神经系统疾病中,SP脑膜炎是最复杂,最严重的[2]。通过正规的抗菌药物、激素及支持治疗后,SP脑膜炎仍有高达25%的致死率,约50%的存活者遗留神经系统后遗症[2],多表现为智力低下、惊厥发作、听力损害、感觉障碍和运动发育落后等[3]。因此,进一步研究细菌性脑膜炎的免疫病理机制,对治疗和改善细菌性脑膜炎预后意义重大。B7同源体3(B7H3)是B7协同刺激分子家族的新成员,它不仅在T细胞介导的免疫调控中扮演者多种角色而且与SP脑膜炎的固有免疫应答有关[4]。神经元特异性烯醇化酶(NSE)是反映脑损伤的标志物[5],S100b蛋白约96%存在于脑内,绝大部分分布于神经胶质细胞中,是反映脑组织损伤的标志蛋白[6]。作者的前期研究发现,在确诊细菌性脑膜炎患者的脑脊液中,B7H3的表达显著升高[7],并且在小鼠SP脑膜炎中,证实了B7H3是通过TLR-2机制增强了脑内炎症反应,并且加剧了血脑屏障的破坏[4]。本研究是在既往实验的基础上,通过观察B7H3对SP脑膜炎小鼠的临床症状以及检测脑损伤标志物NSE和S100b的基因表达的作用,进一步分析B7H3对SP脑膜炎中脑损伤的影响。
1 材料与方法
1.1 材料 实验动物:BALB/C小鼠共48只,由上海实验动物中心(斯克莱公司)提供。试剂:SP3型购自American Tissue Cell Culture Collection(ATCC,Manassas,VA),菌号:ATCC 6303;mB7H3蛋白购自美国R&D公司;NSE、S100b和β-action三对引物均由上海博亚(英骏)有限公司设计;Trizol试剂购自上海博亚(英骏)有限公司;Prime Script RT reagent kit Perfect Real Time试剂盒、SYBR Premix Ex TaqII(Perfect Real Time)试剂盒均购自宝生物工程(大连)有限公司;RNeasy®Mini Kit购自凯杰生物技术(上海)有限公司。
1.2 方法
1.2.1 动物分组 将48只BALB/C小鼠分为4组,每组12只。生理盐水组(CON组)定位后向侧脑室注入15μL 0.9%氯化钠,B7H3蛋白组(B7H3组)定位后向侧脑室注入10μL浓度为0.33μg/μL的B7H3蛋白+5μL 0.9%氯化钠,SP组定位后向侧脑室注入10μL 0.9%氯化钠+5μL浓度为1.5×104cfu/mL),SP+B7H3组。以上各实验组小鼠按处死时间分为18h组、48h组、72h组,术后置于室温20~25℃,光线明、暗各12h,自由饮食饲养。
1.2.2 细菌与化脓性脑膜炎的制备 将菌种ATCC 6303接种于血琼脂糖固体培养基上,置于37℃、5%的CO2培养箱中过夜。挑取单个菌落,接种于含有15mL脑心浸液的50mL的离心管中,倾斜插入37℃恒温摇床中,以240r/min振速摇过夜;取350μL细菌悬液接种于脑心浸液中,240r/min 37℃恒温摇床培养6~8h,此时细菌生长至对数生长期,收菌,3 000r/min离心20min,离心后在管底可见乳白色沉淀,弃上清液,取10mL无菌的PBS冲洗细菌沉淀;再同前离心1次,弃上清液后用无菌PBS 10mL重悬沉淀,充分吹打混匀后,取100μL,仍用无菌PBS进行倍比稀释余下细菌离心,将只含有细菌沉淀的离心管用封口膜封住放入-20℃冰箱中备用;倍比稀释后的细菌各取100μL进行涂板,置于37℃、5%的CO2培养箱中培养;24h后计数血平板上的菌落,计算保存备用的细菌总数。在制作化脓性脑膜炎时,用0.9%氯化钠稀释备用细菌沉淀,制成浓度为1.5×104cfu/mL的SP悬液。
小鼠脑膜炎模型采用改进的Diab的侧脑室注射法[8],首先用麻醉剂戊巴比妥钠(浓度1.0%)60mg/kg,腹腔注射诱导深度麻醉,然后俯卧位固定小鼠,在小鼠头正中沿矢状位做一个长1.5cm左右的切口,暴露颅骨结构,可见各额、顶骨结构界限,准确定位:前囟后约0.5mm,中线右旁开1.0mm为进针处,垂直深度为2.5~3.0mm,然后将15μL的细菌悬液(1.5×104cfu/mL)在约2min内缓慢、匀速地注入侧脑室,留置针头于颅内1min后缓慢拔出(控制好注入速度和退针速度,以防由于速度过快引起的颅内压急剧升高和退针过快注入的液体外溢而影响注入侧脑室的液体量)。为证实定位准确,按以上定位方法向侧脑室内注射蓝黑墨水,3~5min后颈椎脱臼处死,解剖脑部结构,可见蓝黑色墨水已通过脑脊液迅速扩散至脊髓腔颅底窝小脑延髓池双侧侧脑室。
1.2.3 神经行为学评分 在18、48、72h时分别对各组小鼠(n=4)进行神经行为学评分,评分标准采用Loeffler的神经行为学5分制评分方法[9]。5分:抓住背部时能正常活动,在5s内翻身成功;4分:自主运动减少,5s内能翻身;3分:翻身可以成功,但时间超过5s;2分:不能翻身;1分:不能运动;0分:死亡。
1.2.4 实时-PCR 侧脑室注射后18、48、72h,将各组小鼠(n=4)用1%戊巴比妥钠(60mg/kg)腹腔注射麻醉,快速颈椎脱臼处死,在冰块上断头,将脑组织迅速放入液氮中快速冻。待行实时-PCR检测。采用TRIZOL抽提法提取小鼠脑组织匀浆中的总RNA,抽提的总RNA,使用RNeasy®Mini Kit进行纯化,操作步骤严格按照说明书进行,取纯化后的RNA 500ng进行逆转录,逆转录操作步骤按照Prime Script RT reagent kit Perfect Real Time执行,逆转录条件如下:37℃15min,85℃5s。特异性引物如下:NSE上游引物5′-TCA TTC TCC TGG AGC CTC TT-3′,下 游 引 物 5′-AAG AGC AGA GAG AGC AAG G-G-3′;S100b上游引物5′-TGC CCT CAT TGA TGT CTT CCA-3′,下游引物5′-GAG AGA GCT CGT TGT TGA TAA GCT-3′;β-actin上游引物,5′-GGT CAT CAC TAT TGG CAA CG-3′,下 游 引 物 5′-ACG GAT GTC AAC GTC ACA CT-3′。实时-PCR的操作按照SYBR Premix Ex TaqII(Perfect Real Time)的说明书进行,反应条件如下:95℃30s1个循环,95℃5s,60℃30s,72℃30s35个循环,72℃15min 1个循环。
1.2.5 NSE、S100bmRNA的相对表达量的计算 采用2-ΔΔct方法计算mRNA的相对量,以β-actin基因为内参基因,对NSE、S100bmRNA进行均一化处理,利用荧光阈值(Ct值)计算NSE、S100bmRNA的相对表达量。
1.3 统计学处理 所有数据采用SPSS18.0统计软件进行统计学分析,计量资料以s表示,数据作正态性W 检验和方差齐性Levene检验;满足条件者多组间比较采用单因素方差分析,组间两两比较采用t检验;不满足条件者采用非参数检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 B7H3对小鼠神经行为学评分的影响 各时点B7H3组神经行为学评分与CON组比较,差异无统计学意义(P>0.05);不同时间点SP组较 CON组降低(P<0.05);SP+B7H3组与SP组比较,评分进一步降低(P<0.05),见表1。
表1 各组小鼠不同时间点神经行为评分比较(s)

表1 各组小鼠不同时间点神经行为评分比较(s)
a:P<0.05,与SP组比较;b:P<0.05,与SP+B7H3组比较。
18h 48h 72h CON组 4 5.000±0.000a5.000±0.000a5.000±0.000组别 n a B7H3组 4 5.000±0.000a5.000±0.000a5.000±0.000a SP组 4 4.500±0.577b 3.500±0.577b 2.750±0.500b SP+B7H3组4 4.000±0.000 3.000±0.000 1.750±0.500
2.2 实时-PCR特异性产物 实时-PCR产物具有高度特异性,电泳条带如图2。

图2 实时-PCR特异性产物
2.3 B7H3对脑膜炎时脑损伤标志物NSE、S100bmRNA相对表达量的影响 在细菌注射后18、48、72h,B7H3组与CON组比较,NSE、S100bmRNA相对表达量差异无统计学意义(P>0.05);不同时间点SP组NSE、S100bmRNA相对表达量较CON组明显升高(P<0.05);各时间点SP+B7H3组NSE、S100bmRNA相对表达量较SP组进一步升高(P<0.05)。见表2、3。
表2 4组小鼠各时间点脑组织NSE mRNA水平比较()

表2 4组小鼠各时间点脑组织NSE mRNA水平比较()
a:P<0.05,与SP组比较;b:P<0.05,与SP+B7H3组比较。
18h 48h 72h CON组 4 0.028±0.006a0.028±0.003a0.028±0.001组别 n a B7H3组 4 0.052±0.034 0.020±0.001 0.036±0.002 SP组 4 0.095±0.030b 0.177±0.021b 0.369±0.035b SP+B7H3组4 0.124±0.049 0.330±0.088 0.529±0.020
表3 4组小鼠各时间点脑组织S100bmRNA水平比较s)
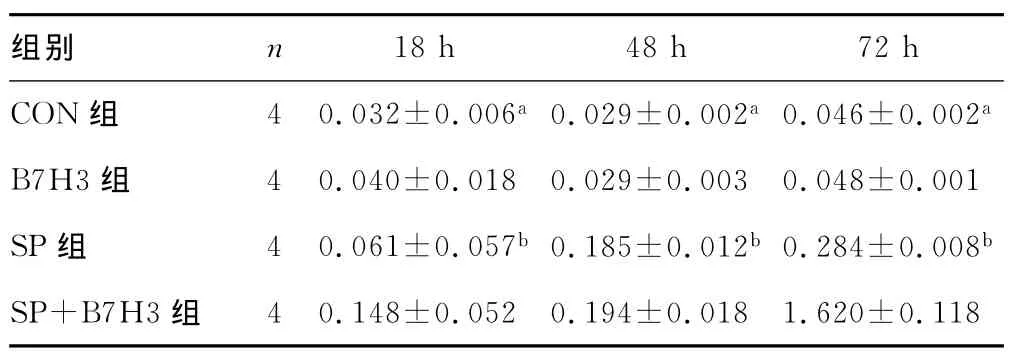
表3 4组小鼠各时间点脑组织S100bmRNA水平比较s)
a:P<0.05,与SP组比较;b:P<0.05,与SP+B7H3组比较。
18h 48h 72h CON组 4 0.032±0.006a0.029±0.002a0.046±0.002组别 n a B7H3组 4 0.040±0.018 0.029±0.003 0.048±0.001 SP组 4 0.061±0.057b 0.185±0.012b 0.284±0.008b SP+B7H3组4 0.148±0.052 0.194±0.018 1.620±0.118
3 讨 论
B7H3是B7协同刺激分子家族的新成员,作者的临床资料表明,在确诊细菌性脑膜炎患者的脑脊液中,相对于病毒性脑炎患儿可溶性B7H3的表达显著升高[7],推测B7H3蛋白在细菌性脑膜炎的病理、生理过程中发挥着重要作用。在本研究中,通过侧脑室注射SP悬液建立SP脑膜炎小鼠模型,并且选取术后18、48、72h时间点动态观察脑膜炎的症状。本研究发现在侧脑室注射后18h,SP组神经行为学评分较CON组降低,说明实验组小鼠在细菌感染后18h就已经出现了脑膜炎临床症状;在细菌注射后48、72h时,SP组与CON组比较评分呈下降趋势,表明随着时间的推移脑膜炎小鼠的病情逐步加重。SP和B7H3蛋白的联合注射与SP单独注射相比,神经行为学评分进一步下降,表明在SP感染的前提下B7H3加剧了SP脑膜炎的病情进展。同时还发现B7H3蛋白单独注射小鼠的神经行为评分在各时间点均较CON组无变化,表明B7H3蛋白本身对正常小鼠无影响,这与作者最近的研究结果相符[4]。
除临床症状外,本研究中还运用了实时-PCR技术检测脑组织匀浆中脑损伤标志物NSE、S100bmRNA的表达。NSE是一种细胞质中的糖酵解酶,是存在于神经元内的形式,它是由γγ二聚体组成的,相对分子质量为78×103,半衰期为24 h[10],它特异性存在于神经元尤其是中枢神经系统成熟的神经元内,当神经元遭受各种应激状态时会将其释放[11]。有研究表明,NSE血清水平亦越高,脑损伤的程度越重[12]。S100b蛋白是一种相对分子质量只有21×103的钙结合蛋白,生物半衰期为2h,它是由ββ组成的同源二聚体,在中枢神经系统的星形胶质细胞中高表达并由它分泌[13]。当S100b水平异常升高时,它可以通过促炎症细胞因子的表达增加而产生有害影响促进细胞凋亡[14]。亦有研究表明,S100bmRNA在成年和老年小鼠的创伤性脑损伤中的表达是上调的[15]。在本研究中,实时-PCR结果显示,细菌接种后18、48、72h,SP组小鼠 NSE、S100bmRNA相对表达量较CON组明显升高,表明在基因水平,SP感染诱导了小鼠脑组织中NSE、S100b的表达,SP+B7H3组小鼠的S100bmRNA相对表达量较SP组更进一步升高,而在S100b、NSE mRNA结果中均发现B7H3组和CON组差异无统计学意义(P>0.05)。结合SP脑膜炎小鼠的同步的神经行为学评分的动态观察,本结果显示,在脑膜炎的病情进展中,B7H3在SP感染的基础上上调了SP脑膜炎小鼠脑损伤标志物NSE、S100b基因的表达。
综上所述,本研究发现在SP脑膜炎小鼠中,B7H3蛋白干预加剧了SP脑膜炎的临床症状,并且对脑损伤标志物NSE、S100b的基因表达发挥了上调作用。因此,可以认为协同刺激分子B7H3在细菌性脑膜炎引起的脑损伤可能发挥着积极作用。这一研究结论为B7H3作为细菌性脑膜炎干预治疗的潜在靶点提供了实验依据。深入探讨B7H3加剧SP脑膜炎脑损伤的信号机制,正是作者后续研究中的主要内容。
[1]Hoffmann O,Braun JS,Becker D,et al.TLR2mediates neuroinflammation and neuronal damage[J].J Immunol,2007,178(10):6476-6481.
[2]Mook-kanamori BB,Geldhoff M,van der Poll T,et al.Pathogenesis and pathophysiology of pneumococcal meningitis[J].Clin Microbiol Rev,2011,24(3):557-591.
[3]Brouwer MC,Heckenberq SG,de Gans J,et al.Nationwide implementation of adjunctive dexamethasone therapy for pneumococcal meningitis[J].Neurology,2010,75(17):1533-1539.
[4]Chen X,Quinn EM,Ni H,et al.B7-H3participates in the development of experimental pneumococcal meningitis by augmentation of the inflammatory response via a TLR2-Dependent mechanism[J].Immunol,2012,189(1):347-355.
[5]Soqut O,Guloglu C,Orak M,et al.Trauma scores and neuron-specific enolase,cytokine and C-reactive protein levels as predictors of mortality in patients with blunt head trauma[J].Int Med Res,2010,38(5):1708-1720.
[6]黄艳军,郑帼,晋光荣.TBOA抑制谷氨酸转运体功能对戊四氮点燃癫痫模型的影响[J].实用医学杂志,2009,25(19):3199-3201.
[7]Chen X,Zhang G,Li Y,et al.Circulating B7-H3(CD27 6)elevations in cerebrospinal fluid and plasma of children with bacterial meningitis[J].Mol Neurosci,2009,37(1):86-94.
[8]Diab A,Zhu J,Lindquist L,et al.Haemopilus influenzae and streptococcus Pneumoniae induce different intracerebral mRNA cytokine paterns during the course of experimental bacterial meningitis[J].Clin ExP Immunol,1997,109(2):233-241.
[9]Leib SL,Clements JM,Lindberg RL,et al.Inhibition of matrix metalloproteinases and tumour necrosis factor alpha converting enzyme as adjuvant therapy in pneumococcal meningitis[J].Brain,2001,124(9):1734-1742.
[10]Pahlman S,Esscher T,Bergvall P,et al.Purification and characterization of human neuron-specific enolase:radioimmunoassay development[J].Tumour Biol,1984,5(2):127-139.
[11]Yardan T,Cevik Y,Donderici O,et al.Elevated serum S100Bprotein and neuron specific enolase levels in carbon monoxide poisoning[J].Am J Emerq Med,2009,27(7):838-842.
[12]谷兴华,张供,张希全.血清蛋白B亚型和神经元特异性烯醇化酶对早期判断体外循环术后脑损伤的意义[J].中华医学杂志,2007,87(14):975-977.
[13]Donato R,Sorci G,Riuzzi F,et al.S100B′s double life:intracellular regulator and extracellular signal[J].Biochim Biophys Acta,2009,1793(6):1008-1022.
[14]Rothermundt M,Peters M,Prehn JH,et al.S100Bin brain damage and neuro-degeneration[J].Microsc Res Tech,2003,60(6):614-632.
[15]Sandhir R,Onyszchuk G,Berman NE.Exacerbated glial response in the aged mouse hippocampus following controlled cortical impact Injury[J].Exp Neurol,2008,213(2):372-380.
