不同组分马尾藻岩藻聚糖硫酸酯对人肺癌细胞A549作用的研究
2014-09-20,,*,,,
,,*,, ,
(1.广东海洋大学食品科技学院,广东湛江 524088; 2.旭骏水产(湛江)有限公司,广东湛江 524057)
不同组分马尾藻岩藻聚糖硫酸酯对人肺癌细胞A549作用的研究
蔡璐1,王维民1,*,谌素华1,丁伟2,李春莲1
(1.广东海洋大学食品科技学院,广东湛江 524088; 2.旭骏水产(湛江)有限公司,广东湛江 524057)
本研究采用不同组分马尾藻岩藻聚糖硫酸酯(SF)对人肺癌细胞A549细胞的抑制作用进行了研究。根据MTT比色法检测不同细胞铺板数量及不同质量浓度SF对该细胞生长曲线的影响;不同组分SF在不同时间对该细胞的增殖抑制率;倒置显微镜下观察SF对该细胞形态的影响。研究结果表明,当SF的浓度在1~25mg/mL范围、细胞铺板数量为5×103个/mL时,细胞生长曲线线性良好;各组分SF对人肺癌细胞A549均有抑制作用,其中SF2-R对细胞的抑制效果较强,抑制率为61.06%。
马尾藻岩藻聚糖,人肺癌细胞A549,抑制效果,铺板
马尾藻(Sargassumsiliquastrum)是褐藻的一属,墨角藻目、马尾藻科、马尾藻属。岩藻聚糖硫酸酯(Fuciodan)是海藻多糖中一类独特的结合有硫酸基团的活性多糖,具有显著的抗肿瘤[1-2]、抗病毒[3-4]、提高免疫力[5]、降血脂[6-7]、抗凝血[8]等活性。但由于其分子量大,溶解性较差,不容易被人体吸收,所以在研究和应用方面受到了限制。因此研究低分子量的岩藻聚糖硫酸酯的制备及其活性为岩藻聚糖的应用开拓了新的途径。目前关于海带[9](Laminaria)、裙带菜[10](Undariapinnatifida)、鼠尾藻[11](Sargassum.thunbergii)等褐藻中提取的岩藻聚糖硫酸酯的抗肿瘤活性已经有了很多的研究报道,但是对马尾藻岩藻聚糖硫酸酯尤其是低分子量的马尾藻岩藻聚糖硫酸酯的研究很少。本文以马尾藻为原料提取SF,经分解得到不同分子量的组分,研究不同组分SF对人肺癌细胞A549的抑制作用,希望能够将SF作为对肺癌进行抑制的功能性食品提供依据,并为马尾藻的综合利用提供理论基础。
1 材料与方法
1.1材料与仪器
马尾藻 2012年4月采自湛江硇州岛;不同分子量的SF 由本实验室提取、分离纯化及降解所得8个组分,其相对平均分子量及硫酸根含量如下:SF1(851.13ku,30.93%)、SF2(239.05ku,32.65%)、SF3(102.34ku,29.88%)、SF4(19.95ku,21.61%)、SF1-R(53.74ku,33.63%)、SF2-R(19.54ku,35.87%)、SF3-R(9.27ku,30.44%)、SF4-R(6.69ku,20.85%)。
细胞株:人肺癌细胞A549 购于中国科学院上海生命院细胞资源中心;RPMI-1640培养基 美国GIBCO公司产品;胰蛋白酶Trypsin 美国GIBCO公司产品;噻唑蓝(MTT) 美国Amresco公司产品;青霉素G钠盐 美国Amresco公司产品;硫酸链霉素 美国Amresco公司产品;优级胎牛血清 杭州四季青生物工程有限公司生产;二甲基亚砜DMSO 美国Amresco公司产品;PBS缓冲液(pH7.2~7.4) 北京鼎国生物技术有限公司。
SHELL/JB TC2323型CO2培养箱 美国壳牌公司;BHC-1300ⅡA/B3型超净工作台 苏净集团安泰公司;TE300型倒置显微镜 NIKEO ECLIPSE公司;BIO-ELX808型全自动酶标仪 美国伯腾仪器有限公司;TG16A-WS型离心机 上海离心机仪器有限公司;液氮罐 成都云光低温科技有限责任公司;Thermo超低温冰箱 广州市凌志电子科技有限公司;高压灭菌锅 上海比朗仪器有限公司;电热鼓风干燥箱 天津市达北实验仪器厂;AUW120型电子分析天平 日本岛津;PHS-3C精密pH计 上海雷磁。
1.2实验方法
1.2.1 肿瘤细胞的培养 将肺癌细胞A549以RPMI-1640为培养液(含10%小牛血清、青霉素100U/L、链霉素100μg/L),在5% CO2培养箱中培养,以0.25%的胰蛋白酶消化,取对数生长期细胞进行实验。
1.2.2 肿瘤细胞铺板数量的确定 以细胞计数法建立肺癌细胞A549的生长曲线,将生长良好的细胞制成细胞悬液,按1×103~1×105个/mL 180μL接种到培养板各孔中,每个浓度设3个复孔,于37℃、5%的CO2培养箱中分别培养24、48、72、96h后加入20μL MTT溶液,继续培养4h后弃培养液加入150μL DMSO,振荡10min,490nm测OD值。以培养时间(h)为横坐标,OD值为纵坐标,绘制细胞生长曲线,对比不同铺板数量的细胞随培养时间的生长曲线的线性情况。
1.2.3 多糖对肿瘤细胞抑制作用的浓度确定 研究一系列不同质量浓度(0、0.1、0.5、1、2、4、8、10、15、20、25、30mg/mL)的多糖对肺癌细胞A549增殖的抑制情况。以MTT法测定SF1对细胞作用48h后细胞数量反应的OD值与浓度之间的关系。
1.2.4 MTT比色法测定各组分SF对肿瘤细胞增殖的影响 参照文献[12]将生长情况良好的肺癌细胞A549浓度调整为5×103个/mL,每孔180 μL接种于96孔板上,每孔设置3个复孔,同时设对照孔和空白孔,在37℃、5% CO2孵箱中培养24h;在96孔板中每孔加入20uL用RPMI-1640培养基配制的不同质量浓度的多糖溶液,使多糖的最终浓度调整为1、2.5、5、10、20mg/mL的,在对照组和空白组加入20μL的RPMI-1640培养基;使多糖溶液作用的时间分别为24、48、72h,作用时间结束后,倒掉上清液,用PBS洗涤2次;每孔加入用滤器过滤的MTT 20μL,在37℃、5% CO2培养箱中继续培养4h,小心吸除上清液,每孔加入150μL DMSO,将96孔板在酶标仪上振荡10min,490nm处检测吸收值,计算:
增殖抑制率(%)=1-(处理组平均OD值-空白对照组平均OD值)/(对照组平均OD值-空白对照组平均OD值)×100。
按改良Karber公式计算半数抑制率(IC50):
lgIC50=Xm-I(P-(3-Pm-Pn)/4)[13]
式中符号意义:Xm:lg最大剂量,I:lg(最大剂量/相临剂量),P:阳性反应率之和,Pm:最大阳性反应率,Pn:最小阳性反应率。
2 结果与分析
2.1肿瘤细胞铺板数量的确定
将贴壁细胞A549按每孔细胞数量在1×103~1.0×105个/mL的范围铺板,绘制OD值与时间关系曲线,如图1,当细胞数量以5×103个/mL铺板时,细胞数量反应的OD值与时间呈良好的线性关系(R=0.996)。当铺板细胞数少于1×103个/mL时,结果重复性不好;当细胞数量在5×104个/mL时,在72h出现平台期,细胞数量所反应的OD值与时间的线性相关性不好。为了排除细胞数量对实验结果的影响,对于肺癌细胞A549的后期实验宜选取5×103个/mL为铺板数量。

图1 不同接种数量的肺癌细胞A549的生长曲线
2.2 SF对肿瘤细胞抑制作用浓度确定
结果如图2所示,与空白对照管比较,当SF1浓度小于0.5mg/mL时测得的OD值与空白对照管OD接近,细胞增殖抑制作用不明显。当SF1浓度大于1mg/mL时,细胞增殖被抑制,并且随着SF1浓度的升高,细胞增殖抑制作用逐渐加剧。当SF1浓度到达25mg/mL,细胞增殖抑制达到极限,继续增加SF1浓度,细胞增殖的抑制情况变化不明显。综合实验结果分析,硫酸酯多糖的浓度在1~25mg/mL范围内,对肿瘤细胞具有良好的抑制趋势,在后期实验中选取0(对照)、1.25、2.5、5、10、20mg/mL浓度进行研究。
2.3各SF组分对肿瘤细胞增殖的影响
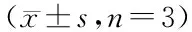
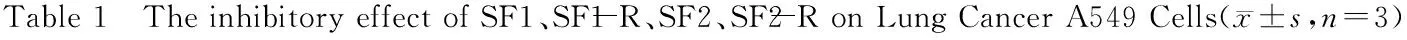

时间(h)浓度(mg/mL)SF1SF1-RSF2SF2-ROD值IR(%)OD值IR(%)OD值IR(%)OD值IR(%)2400.567±0.0061.250.542±0.009*4.070.549±0.006**3.170.541±0.007**4.580.529±0.008**6.702.50.528±0.012**6.550.526±0.006**7.230.514±0.007**9.350.506±0.006**10.7650.495±0.019**12.390.482±0.013**14.990.485±0.015**14.460.467±0.009**#17.64100.488±0.009**13.630.472±0.004**16.750.470±0.015**17.110.446±0.009**##21.34200.481±0.017**15.610.464±0.007**18.170.456±0.005**19.580.423±0.013**##25.404800.768±0.0191.250.731±0.034**4.280.714±0.032**#7.030.717±0.009**6.640.704±0.014**8.332.50.698±0.005**9.110.682±0.005**#11.200.686±0.013**10.680.668±0.012**##13.0250.652±0.005**15.100.630±0.018**##17.980.646±0.010**15.880.615±0.006**#19.92100.609±0.011**20.700.583±0.025**##24.220.594±0.008**22.660.575±0.007**25.13200.542±0.012**29.430.518±0.015**##32.550.524±0.008**31.770.496±0.006**#35.427200.945±0.0161.250.853±0.014**9.770.869±0.013**8.040.841±0.008**11.010.826±0.015**#12.592.50.795±0.014**15.870.774±0.007**#18.180.782±0.005**17.250.762±0.006**#19.3750.690±0.017**26.980.647±0.008**##31.530.684±0.006**27.620.614±0.016**##35.03100.582±0.007**38.410.520±0.011**##44.970.564±0.017**40.310.493±0.012**##47.83200.451±0.008**47.720.398±0.009**##57.880.427±0.013**54.810.368±0.008**##61.06
注释:降解前多糖组分与对照组比较:*p<0.05,**p<0.01;同浓度,同时间下降解后多糖组分与降解前多糖组分比较:#p<0.05,##p<0.01,表2同。
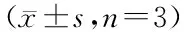

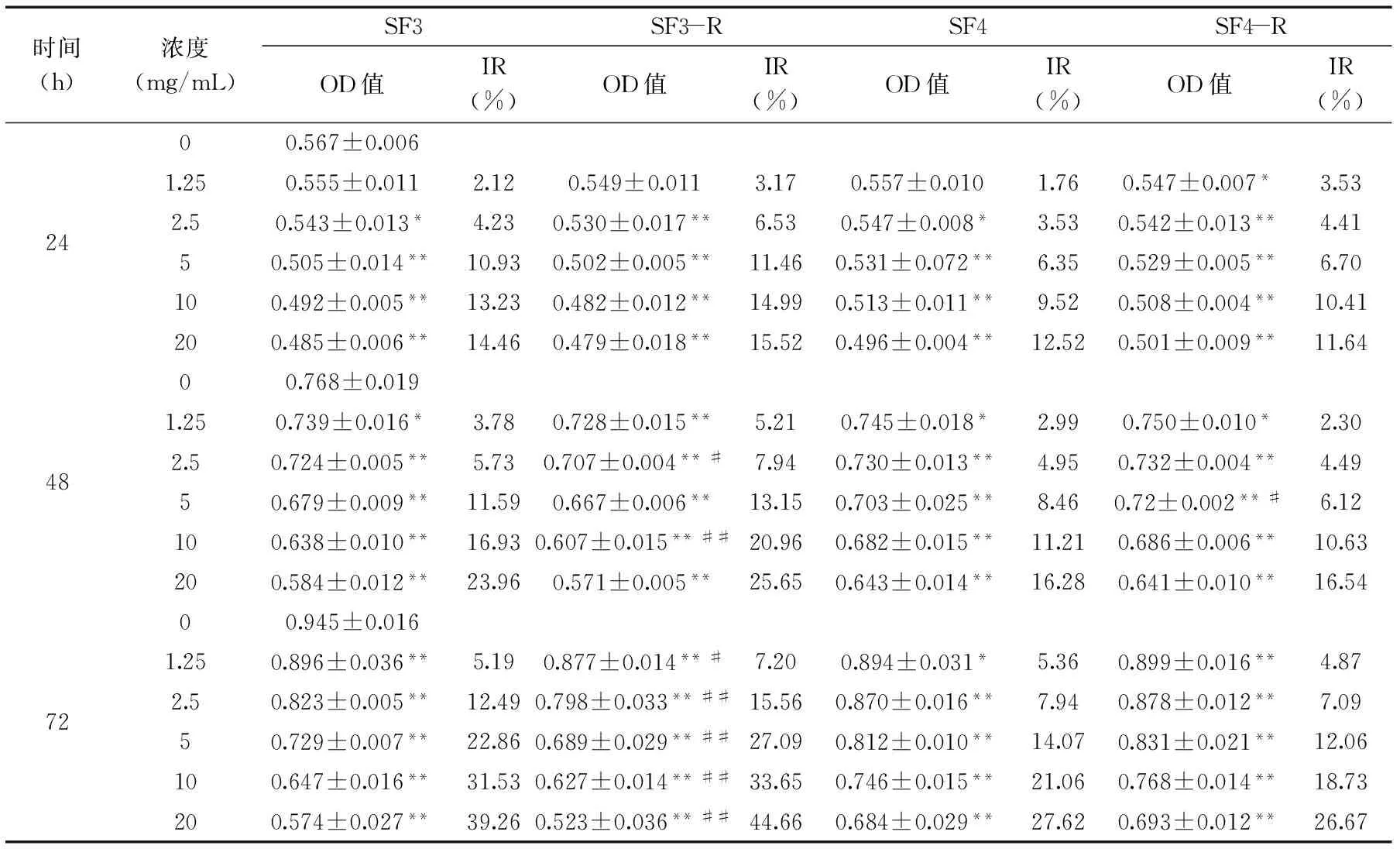
时间(h)浓度(mg/mL)SF3SF3-RSF4SF4-ROD值IR(%)OD值IR(%)OD值IR(%)OD值IR(%)2400.567±0.0061.250.555±0.0112.120.549±0.0113.170.557±0.0101.760.547±0.007*3.532.50.543±0.013*4.230.530±0.017**6.530.547±0.008*3.530.542±0.013**4.4150.505±0.014**10.930.502±0.005**11.460.531±0.072**6.350.529±0.005**6.70100.492±0.005**13.230.482±0.012**14.990.513±0.011**9.520.508±0.004**10.41200.485±0.006**14.460.479±0.018**15.520.496±0.004**12.520.501±0.009**11.644800.768±0.0191.250.739±0.016*3.780.728±0.015**5.210.745±0.018*2.990.750±0.010*2.302.50.724±0.005**5.730.707±0.004**#7.940.730±0.013**4.950.732±0.004**4.4950.679±0.009**11.590.667±0.006**13.150.703±0.025**8.460.72±0.002**#6.12100.638±0.010**16.930.607±0.015**##20.960.682±0.015**11.210.686±0.006**10.63200.584±0.012**23.960.571±0.005**25.650.643±0.014**16.280.641±0.010**16.547200.945±0.0161.250.896±0.036**5.190.877±0.014**#7.200.894±0.031*5.360.899±0.016**4.872.50.823±0.005**12.490.798±0.033**##15.560.870±0.016**7.940.878±0.012**7.0950.729±0.007**22.860.689±0.029**##27.090.812±0.010**14.070.831±0.021**12.06100.647±0.016**31.530.627±0.014**##33.650.746±0.015**21.060.768±0.014**18.73200.574±0.027**39.260.523±0.036**##44.660.684±0.029**27.620.693±0.012**26.67
MTT结果分析如表1、表2所示,不同质量浓度的各组分SF对肺癌细胞A549作用不同时间后,细胞受到不同程度的抑制,而且不同时间、不同浓度的作用效果具有显著性差异。相同作用时间下,随着SF质量浓度的增大,细胞增殖的抑制率逐渐升高,而在同一浓度水平,随着作用时间的延长,各组分SF对A549细胞的生长抑制作用也呈现逐渐增大的趋势,可以看出各组分SF对肺癌细胞A549增殖的抑制作用呈现明显的量效和时效关系。

表3 各SF组分对肺癌细胞A549作用不同时间的IC50值
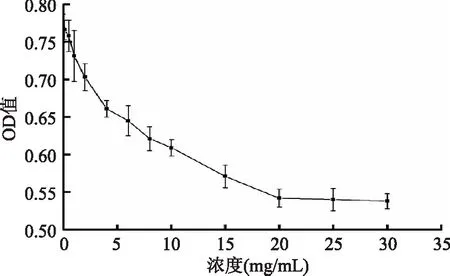
图2 肺癌细胞A549在不同浓度SF1作用下的生长曲线
采用统计学分析(p<0.05显著,p<0.01极显著),8个组分SF对肺癌细胞A549作用的实验组与阴性对照组的比较,结果分析表明:除1.25mg/mL组的SF3、SF3-R、SF4对细胞作用24h时的抑制作用无统计学意义外(p>0.05),其余组与阴性对照组比较差异均有统计学意义(p<0.05显著,p<0.01极显著)。在相同时间、相同浓度下,统计学分析酶降解后的4个组分SF与其各自降解前组分对肺癌细胞A549的抑制作用结果表明:在48~72h,SF1-R、SF2-R相较于SF1、SF2对A549细胞增殖抑制作用差异显著(p<0.05显著,p<0.01极显著),在24h,个别浓度的SF2-R相较于SF2对细胞增殖抑制作用差异显著;在作用72h时,SF3-R相较于SF3对A549细胞抑制作用差异显著(p<0.05显著,p<0.01极显著),而在作用24、48h时只有个别浓度的SF3-R对A549细胞增殖的抑制作用相较于SF3差异显著;SF4-R相较于SF4作用差异不显著(p>0.05),具体结果分析如表1、表2。其中SF2-R对肺癌细胞A549作用72h时的抑制作用最明显,抑制率达到61.06%,而SF4和SF4-R抑制作用接近且最低。这主要与各组分马尾藻岩藻聚糖硫酸酯的理化组成及分子量的大小有关,海藻多糖的生物活性是在一定的分子量范围体现出来的,分子量太大、太小都会影响其生物活性。在一定分子量范围,经酶降解的高分子量的马尾藻岩藻聚糖硫酸酯的活性被提高,但是分子量太低其活性也受到抑制。另外,活性硫酸基团越多活性表现也越明显。
2.4 SF对肿瘤细胞的IC50值
各组分SF对肺癌细胞A549增殖均有一定的抑制作用,而且不同浓度,不同作用时间对肺癌细胞A549抑制效果不同。通过抑制率对各组分SF浓度回归方程计算在24、48、72 h不同时间组8个组分SF对肺癌细胞A549的IC50值如表3。作用72h时,SF2-R对A549的IC50达到8.75mg/mL,低于其他SF组分对肺癌细胞A549的IC50。
3 结论
本文研究了不同细胞铺板数量及不同质量浓度的SF对肺癌细胞A549生长曲线的影响,结果表明肺癌细胞A549铺板数量在5×103个/mL时的OD值与时间的线性关系较好,当SF的浓度为1~25mg/mL范围时,细胞增殖抑制作用随着SF浓度的增加而增加;由MTT实验结果分析,各组分SF对肺癌细胞A549均有一定的抑制作用,而且呈现一定的剂量和时间依赖性;通过各组分SF对肿瘤细胞作用72h的抑制作用比较,SF2-R表现出最强的抑制作用,抑制率达61.06%,SF4-R对肺癌细胞A549的抑制作用最弱,抑制率只有26.67%;通过抑制率对SF浓度的回归方程计算,得出各组分对肺癌细胞A549作用72h的IC50值分别为:11.64、9.86、10.63、8.75、14.37、12.62、18.71、20.27mg/mL。
[1]张珣,王静凤,徐雷,等.海地瓜和冰岛刺参海参岩藻聚糖硫酸酯抗肿瘤作用的比较研究[J].食品科学,2012,33(7):251-255.
[2]Stanislav D,Anastyuk,Natalia M. Anticancer activity in vitro of a fucoidan from the brown alga Fucus evanescens and its low-molecular fragments,structurally characterized by tandem mass-spectrometry[J]. Carbohydrate Polymers,2012(87):186-194.
[3]Zhu W,Chiu L,Ooi V,etal. Antiviral property and mode of action of a sulphated polysaccharide from Sargassum patens against herpes simplex virus type[J]. International Journal of Antimicrobial Agents,2004,24(3):279-283.
[4]Jiao G,Yu G,Zhang J,etal. Chemical structures and bioactivities of sulfated polysaccharides from marine alga[J]. Marine Drugs,2011(9):196-223.
[5]刘宪丽,刘东颖,汪艳秋,等.褐藻多糖硫酸酯免疫调节和抗肿瘤活性研究[J].中国微生态学杂志,2010,22(12):1074-1076.
[6]谌素华,王维民.马尾藻岩藻聚糖硫酸酯纯化及降血脂功能研究[J].食品与发酵工业,2010,36(5):28-31.
[7]李德远,徐战,黄利民,等.海带岩藻糖胶对大鼠饮食性高血脂症的影响[J].食品科学,2001,22(2)92-95.
[8]赵雪.海带岩藻聚糖硫酸酯的化学组成及活性的研究[D].青岛:中国海洋大学,2004.
[9]史大华,刘玮炜,刘永江,等.低分子量海带岩藻多糖的制备及其抗肿瘤活性研究[J].时珍国医国药,2012,23(1):53-55.
[10]刘宪丽,刘东颖,汪艳秋,等.褐藻多糖硫酸酯免疫调节和抗肿瘤活性研究[J].中国微生态学杂志,2010,22(12):1074-1076.
[11]Zhuang C,Itoh H,Mizuno T,etal. Antitumor active fucoidan from the brown seaweed,Umitoranoo(Sargassum thunbergii)[J]. Biosci Biotech BioChem,1995,59:563-567.
[12]林董,何爱明,吴丽萍,等.MTT法测定8种中草药体外抗肝癌细胞SMMC-7721活性[J]. 安徽农业科学,2009,37(34):17264-17266.
[13]叶启翔.青蒿琥酯对K562细胞端粒酶活性的影响及凋亡的作用[D].湛江:广东医学院,2007.
Effect of different components of fucoidan fromSargassumsiliquastrumon Lung Cancer A549 Cells
CAILu1,WANGWei-min1,*,CHENSu-hua1,DINGWei2,LIChun-lian1
(1.College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China; 2.Xujun Aquatic Products Limited Company,Zhanjiang 524051,China)
In this study,the effect of sargasso fucosan sulfate(SF)with different components on inhibition of human lung cancer A549 cells was studied. The effect of different cell counts in the planking and SF with different concentrations on cell growth curve was detected according to the MTT assay;the proliferation inhibition rate of SF with different components on this cell at different times;the effect of SF on morphology of this cell was observed under an inverted microscope. The results showed that,when concentration of SF was set in the range of 1~25mg/mL,cell count in the planking was 5×103cell/mL,the cell growth curve had a good linearity;SF with different components all had inhibitory effect on human lung cancer A549 cells,in which SF2-R had the strongest inhibitory effect on the cells,and the inhibition rate was 61.06%.
fucoidan fromSargassumsiliquastrum;Lung Cancer A549 Cells;inhibitory effect;planking
2013-04-22 *通讯联系人
蔡璐(1989-),女,硕士在读,研究方向:食品加工与贮藏。
广东省科技计划项目(2011B20310010)。
TS254.9
:A
:1002-0306(2014)01-0116-05
