不同方法提取国槐叶黄酮及其抗氧化活性研究
2014-09-20,,,,2,,2,*
,,, ,2,,2,*
(1.河西学院农业与生物技术学院,甘肃张掖 734000;2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000)
不同方法提取国槐叶黄酮及其抗氧化活性研究
李小勇1,霍喜东1,杨自勇1,张勇1,2,李彩霞1,2,*
(1.河西学院农业与生物技术学院,甘肃张掖 734000;2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000)
研究超声波辅助双水相、回流、半仿生、水提、超声波辅助双水相(碱)性5种提取方法提取国槐叶黄酮以及抗氧化活性。结果表明,回流提取黄酮含量大于其它几种提取方法,与其它3种方法比较黄酮含量差异显著(p<0.05),而与超声波辅助双水相提取比较差异不显著(p>0.05)。抗氧化结果显示,5种提取方法所得的黄酮提取物均有较强的抗氧化活性,但超声波辅助双水相黄酮提取物对DPPH自由基的清除作用和对铜离子的还原力优于其它方法,超声波辅助双水相(碱)性黄酮提取物对ABTS自由基的清除作用及对铁离子的螯合能力最好。而不同提取物对亚油酸自氧化的抑制作用的强弱顺序是回流>超声波辅助双水相>半仿生>超声辅助双水相(碱)>水提。由此说明,国槐叶黄酮易溶于有机溶剂,超声辅助双水相提取物具有很好的抗氧化性。
国槐叶,黄酮,提取方法,抗氧化活性
黄酮类是广泛存在于自然界的、具有2-苯基色原酮结构的一类化合物,在蔬菜、作物、水果等植物中均有分布[1]。研究表明,黄酮类化合物具有抗氧化、清除自由基,直接抑制癌细胞生长、抗致癌因子、抑制血管生长、提高机体免疫力[2-3]等多种生理活性,因而对于该类化合物的研究与开发倍受关注。
黄酮的提取方法很多,目前较为普遍的提取方法有回流提取、微波、超声、微波辅助回流[4]、超声波辅助双水相等提取方法[5-6]等。由于提取方法不同,黄酮的性质存在较大的差异。
国槐(SophorajaponicaL.)为蝶形花科(Papilionoideae)落叶乔木,是绿化树、行道树、蜜源树的优良品种之一[7]。研究发现国槐各组织器官均含有大量的药用成分[8],目前,许多学者对国槐中活性物质进行了研究,Paniwnyk L等[9]对槐米中芦丁进行了提取;龚盛昭[10]等利用微波技术提取槐米中的芦丁;田中民[11]等对槐角中槐角苷的超声提取工艺进行了研究;丛艳波等[12]用亚临界水提取槐角总异黄酮;而对于国槐叶的研究仅见不同生长期总黄酮的含量测定[13]及叶中黄酮抗氧化[14]方面的报道,而未见国槐叶黄酮提取方法研究方面的报道。为此本实验以国槐叶为材料,研究国槐叶黄酮提取方法及其黄酮提取物清除DPPH、ABTS自由基,抗脂质过氧化活性、铁离子螯合能力及铜离子还原力,以期找出适宜、快速、简单而抗氧化活性高的提取方法,为国槐叶活性成分的开发利用提供理论依据。
1 材料和方法
1.1材料与仪器
材料采自甘肃省河西学院校园,经张勇教授鉴定为蝶形花科植物国槐(SophorajaponicaL.)的树叶,将叶子洗净、阴干、粉碎、过筛(60目)经石油醚脱脂后保存备用。
芦丁、ABTS(2,2′-朕氮-双(3-乙基苯并噻吡咯林-6-磺酸)、DPPH(二苯代苦味肼基)、Neocuproine(新铜试剂)、Ferrozine(菲咯嗪) 均购自Sigma公司;甲醇、乙醇、NaNO2、Al(NO3)3、NaOH、亚油酸等药品 均为国产分析纯。
AE200电子分析天平 Mettler Toledo公司;S24分光光度计 上海棱光技术有限公司;RE-2000A旋转蒸发器 巩义市京华仪器有限责任公司;SHZ—2000循环水式真空泵 河南省巩义市英峪予华仪器厂;KQ-250B型超声波清洗器 昆山市超声仪器有限公司;BF-26恒温控制器 杭州雪中炭恒温技术有限公司;CR21G-II离心机 日本日立公司;AP-9925无油真空泵 天津奥特赛恩斯仪器有限公司。
1.2实验方法
1.2黄酮的提取及含量测定
1.2.1 国槐叶黄酮的提取
1.2.1.1 超声波辅助双水相体系提取国槐叶黄酮 超声波辅助双水相体系提取国槐叶黄酮采用文献[14]。
1.2.1.2 回流提取 称取2g国槐叶粉末,按料液比1∶40加入95%乙醇,在温度80℃、回流1.5h,减压过滤,滤液在45℃,0.08Mpa减压浓缩后置于50mL容量瓶中,用体积分数70%的乙醇定容至刻度,测定提取液黄酮含量。
1.2.1.3 半仿生提取 半仿生提取参照文献[15]。称取2g国槐叶粉末,按料液比1∶40加入蒸馏水,用HCl调pH至2,在温度37℃、超声提取10min、冷却后离心,取上清液移至蒸馏烧瓶中。将沉淀加40mL蒸馏水于锥形瓶中,用石灰乳调pH至7.5,在温度37℃、超声时间10min、冷却后离心,合并2次上清液,将沉淀加40mL蒸馏水于锥形瓶中,用石灰乳调pH至8.5,在温度37℃、超声提取10min、冷却后离心5min,合并3次上清液,将上清液在45℃,0.08Mpa减压浓缩,将浓缩液移至50mL容量瓶中,用体积分数70%的乙醇定容至刻度,测定提取液黄酮含量。
1.2.1.4 水提提取 水提提取国槐叶黄酮参照文献[17]。称取2g国槐叶粉末,按料液比1∶40加入蒸馏水,用1mol/L HCl调pH至4,沸水浴提取30min,冷却后离心,上清液在45℃,0.08Mpa减压浓缩后置于50mL容量瓶中,用体积分数70%的乙醇定容至刻度,测定提取液黄酮含量。
1.2.1.5 超声波辅助双水相碱性体系提取 称取2g国槐叶粉末,按料液比1∶40加入质量分数30%乙醇和质量分数20%硫酸铵组成的双水相体系,用1mol/L NaOH调pH至8,在温度41℃、超声提取21min、冷却后转入分液漏斗中分相,将上相在45℃,0.08Mpa减压浓缩后置于50mL容量瓶中[14],用体积分数70%的乙醇定容至刻度,测定提取液黄酮含量。
1.2.2 国槐叶黄酮含量测定
1.2.2.1 标准曲线的绘制 标准曲线的制作参照文献[18],准确称取芦丁0.02g于100mL烧杯中,加体积分数70%乙醇超声溶解,溶解后,用体积分数70%乙醇定容至刻度。准确吸取0.00、0.50、1.00、1.50、2.00、2.50、3.00mL芦丁标准溶液于10mL容量瓶中,加体积质量5%亚硝酸钠溶液0.3mL,混匀,静置6min。加入体积质量10%硝酸铝溶液0.30mL,混匀,静置6min,加体积质量4%氢氧化钠溶液4mL,用体积分数30%乙醇定容至刻度,摇匀,静置15min。以不加芦丁为空白对照。在510nm下测定吸光值。以芦丁含量(mg)为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.2.2 黄酮含量的测定 准确吸取0.5mL黄酮提取物于10mL容量瓶中根据标准曲线制作方法测定样品的吸光度,根据回归方程计算黄酮含量。
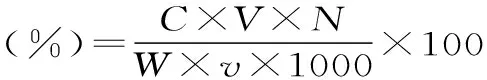
式中:C为提取物中黄酮含量(mg),V为总样品体积(mL),W为样品重量(g),v为测定的样品体积(mL),N为稀释倍数。
1.3抗氧化活性测定
1.3.1 不同方法黄酮提取物对DPPH自由基的清除作用 参照文献[19-20]稍作修改,在试管中分别加入2mL不同提取方法提取的不同质量浓度的国槐叶黄酮提取物,加入2.00mL0.15mmol/LDPPH乙醇溶液,摇匀,放置30min,以2.00mL无水乙醇代替样品和2.00mL体积分数70%乙醇混合后作为参比,测定517nm波长处的吸光度(Ai)。空白对照组以2.00mL无水乙醇代替样品,测定517nm波长处的吸光度(A0),DPPH自由基清除率按以下公式计算。
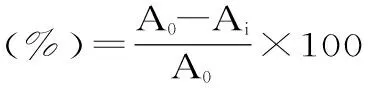
式中:A0-不加黄酮的吸光值,Ai-样品的吸光值。
1.3.2 不同方法黄酮提取物对ABTS自由基的清除作用 参照文献[14]稍作修改,在试管中分别加入用不同提取方法提取的不同质量浓度的国槐叶黄酮提取物0.2mL,然后加入1.2mL的ABTS,再用体积分数 70%的乙醇补充至4mL,混合,静置6min,在745nm波长下测吸光度Ai;以体积分数70%乙醇代替样液作为空白对照在745nm波长下测吸光度A0,ABTS自由基清除率按以下公式计算。
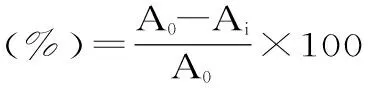
式中:A0-不加黄酮的吸光值,Ai-样品的吸光值。
1.3.3 不同方法黄酮提取物对铁离子的螯合能力 铁离子的螯合能力参见文献[21],在试管中分别加入1.0mL不同质量浓度的国槐叶黄酮提取物与2.5mL甲醇,加入0.1mL2mmoL/LFeCl2混合,再加入0.2mL5mmol/LFerrozine试剂,充分混匀。室温条件下反应20min后,在562nm波长处测定吸光度(Ai);同时用乙醇代替提取物测对照A0。每个样品重复3次,按下式计算铁离子螯合率。
式中:A0-不加黄酮的吸光值,Ai-样品的吸光值。
1.3.4 不同方法黄酮提取物的铜离子还原力测定 参照文献[21-22],还原力以吸光度的大小来表示,吸光度越大还原力越强。
1.3.5 不同方法黄酮提取物抗脂质过氧化活性的测定 硫氰酸铵比色法[23],对亚油酸过氧化的抑制率按下式计算。
式中:A0-不加黄酮的吸光值,Ai-样品的吸光值。
1.4数据处理
采用Excel统计软件进行数据处理与作图,多重比较采用DPS12.5软件进行分析。以上测定均重复三次,图中数据均为三次重复的平均值加标准差。
2 结果与讨论
2.1不同提取方法提取国槐叶黄酮的比较
根据标准曲线得直线回归方程:Y=0.7350x-0.0159;R2=0.9932,依据回归方程计算不同提取方法提取物中黄酮含量结果见图1,从图1可以看出,几种提取物中均含有黄酮类化合物,其中,回流提取物中黄酮含量最高,其次为超声波辅助双水相和超声波辅助双水相碱性提取物,水提提取最低,多重比较显示,回流提取与超声波辅助双水相提取以及超声波辅助双水相与超声波辅助双水相碱性提取黄酮含量差异不显著(p>0.05),而与半仿生,水提提取之间黄酮含量差异显著(p<0.05),以上结果表明,国槐叶黄酮易溶于乙醇,醇提有利于黄酮的溶出。
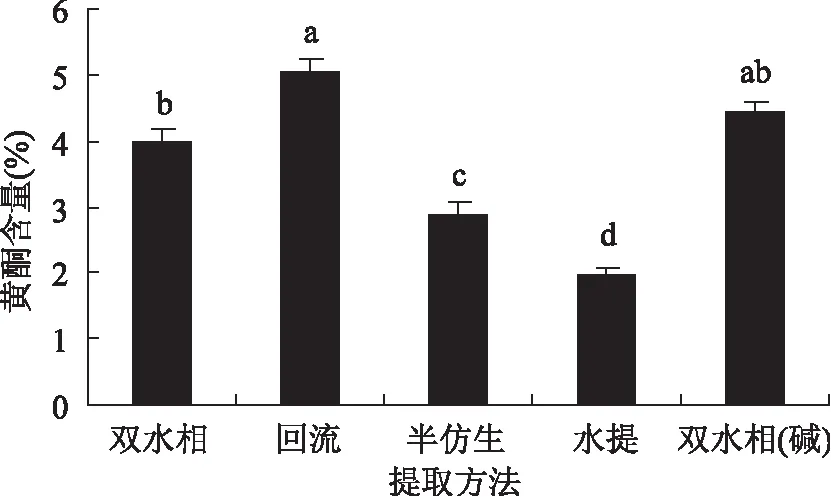
图1 提取方法对国槐叶黄酮的影响Fig.1 Effect of extraction methods on flavonoids content from Sophora japonica leaves
2.2抗氧化活性测定
2.2.1 国槐叶不同方法黄酮提取物对DPPH自由基的清除作用 国槐叶5种方法提取物对DPPH自由基的清除效果见图2。从图2可以看出,当对DPPH自由基的清除率为50%时,超声波辅助双水相提取、回流提取、半仿生提取、水提提取、超声波辅助双水相碱性提取的所需国槐叶黄酮分别为64.92、88.00、80.00、68.00和74.00μg/mL,超声波辅助双水相提取的国槐叶黄酮提取物对DPPH自由基清除能力最佳,李彩霞等[14]对超声波辅助双水相提取的国槐叶黄酮提取物对DPPH自由基清除能力进行了研究,提取液未减压浓缩直接测定DPPH自由基清除能力,而本实验提取液提取后经45℃减压浓缩,置于室温避光条件下保存,在浓缩和存贮过程中有部分黄酮类物质可能被氧化,因此测定的IC50高于文献所报道的值。后续对其影响稳定性的因素需要进一步研究。
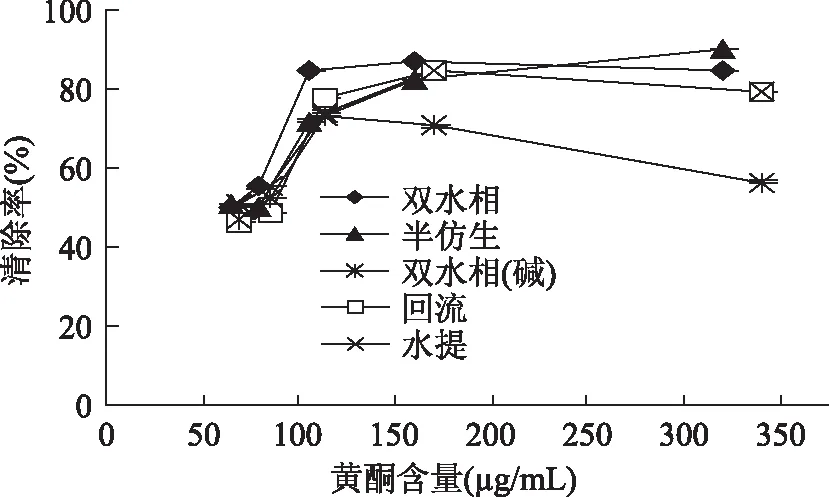
图2 对DPPH自由的清除作用Fig.2 Scavenging effect of flavonoids on DPPH radical
2.2.2 国槐叶不同方法黄酮提取物对ABTS自由基的清除作用 从图3可知,超声波辅助双水相提取、回流提取、半仿生提取、水提提取、超声波辅助双水相碱性提取的提取物中黄酮质量浓度为34μg/mL时,对ABTS自由基清除率分别为57.01%、21.67%、18.00%、39.70%、72.50%,该数据表明,超声波辅助双水相碱性和超声波辅助双水相提取的国槐叶黄酮提取物对ABTS自由基清除能力最好。

图3 对ABTS自由的清除作用Fig.3 Scavenging effect of flavonoids on ABTS radical
2.2.3 国槐叶不同方法黄酮提取物对铁离子的螯合能力 抗氧化活性的一个重要机制是螯合某些金属离子,而后者可以催化氢过氧化物的降解以及Fenton类反应,从而抑制了氧化作用,因此,亚铁离子螯合能力的测定在天然产物抗氧化活性评价中具有非常重要的意义[24]。
国槐叶不同提取方法黄酮提取物对亚铁离子螯合能力结果见图4。从图4可以看出,超声波辅助双水相提取、回流提取、半仿生提取、水提提取、超声波辅助双水相碱性提取的提取物中黄酮质量浓度为200μg/mL时,对亚铁离子的螯合力分别为59.62%、35.82%、33.33%、53.32%、83.45%,其变化趋势与对ABTS自由的变化趋势一致,即超声波辅助双水相碱性提取的国槐叶黄酮提取物对铁离子螯合能力最佳,其次为超声波辅助双水相提取。

图4 铁离子的螯合能力测定Fig.4 Determination of iron ion chelating ability
2.2.4 国槐叶不同方法黄酮提取物对铜离子的还原力 还原能力是衡量抗氧化活性的一个重要指标,也是抗氧化机理之一。抗氧化剂通过自身的抗氧化作用给出电子而清除自由基,还原力越强,抗氧化性越强,因此可以通过检测提取物还原力的大小来说明抗氧化活性的大小[25]。
从图5可以看出,当还原能力为50%时(还原能力实验中450nm处OD值为0.5 时样品的浓度)5种提取物中黄酮的质量浓度为超声波辅助双水相(105.61μg/mL)、回流(112.18μg/mL)、半仿生(128.30μg/mL)、水提(106.50μg/mL)、超声波辅助双水相(碱)126.00μg/mL,对铜离子还原力的顺序为超声波辅助双水相>水提>回流>超声波辅助双水相(碱)>半仿生。
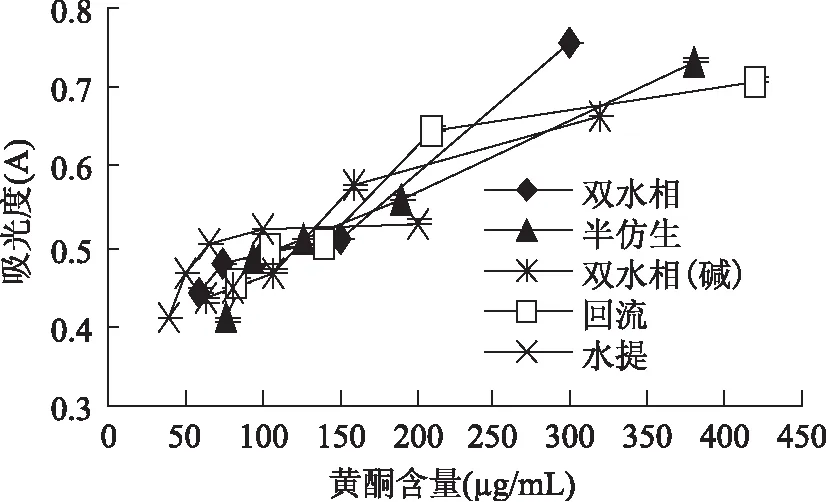
图5 铜离子还原力的测定Fig.5 The determination of copper ion reducing power
2.2.5 国槐叶不同方法黄酮提取物对抗脂质过氧化活性的影响 亚油酸体系是评价食品中抗氧化剂作用最常见的检测体系。含有不饱和脂肪酸的油脂,在各种条件的催化下,脂质氧化产生的过氧化物将Fe2+氧化成Fe3+,Fe3+与硫氰酸反应,生成的硫氰酸铁在510nm处有强吸收[26],如果在反应体系中添加抗氧化剂,就会抑制亚油酸的氧化,吸光值越小,说明抗氧化能力越强。国槐叶不同提取方法黄酮提取物抗脂质过氧化能力的结果见图6。从图6可以看出,在提取物黄酮质量浓度为0.8mg/L时,对亚油酸的抑制能力的强弱为回流(80.53%)>超声波辅助双水相(碱 61.44%)>半仿生(42.42%)>超声波辅助双水相(39.16%)>水提(35.12%),说明回流提取物的抗脂质过氧化的能力较强。
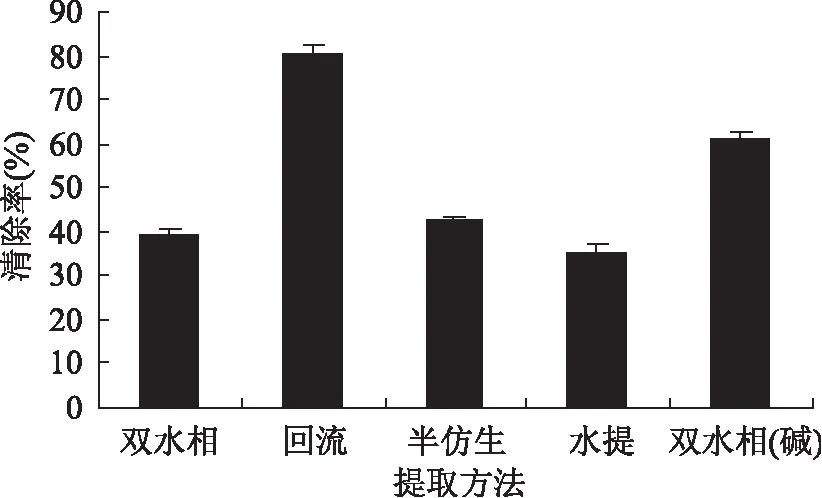
图6 黄酮提取物的抗脂质过氧化活性Fig.6 Inhibitory activity of FTAP on linoleic acid peroxidation
3 结论与讨论
黄酮是一类复杂的化合物,不同极性的提取剂、不同的提取方法对特定结构的组分溶出有一定选择性[27],对不同的方法提取的黄酮的功能进行分析,有助于进一步探讨黄酮各种活性的构效关系。本实验结果表明,回流提取物中黄酮含量较高,其次为超声波辅助双水相和超声波辅助双水相碱性体系,水提提取最低。半仿生和水提提取,其溶剂为蒸馏水,提取效率相对前三种方法较低,说明国槐叶黄酮易溶于有机溶剂中。5种提取物对几种自由基均具有抗氧化活性,对自由基的清除效果显示出醇提取物的抗氧化活性优于水提取物。
5种提取方法所得国槐黄酮含量不同,回流提取黄酮含量最高,但从抗氧化活性角度分析,双水相提取活性更高,其原因是双水相提取时间短,温度低活性成分保持较好。因此,中草药提取方式的取舍并不能以简单的提取率为依据,应该跟踪检查其组分和活性,以探究各组成成分与抗氧化活性的关系。国槐作为重要的药用植物,目前,对于槐米和槐角研究较多,但是国槐叶资源丰富,活性成分较多[28],为充分利用该资源,探索活性成分提取技术,结果显示超声波辅助双水相技术提取物中显示出更好的抗氧化性;活性成分易溶于乙醇中,乙醇毒性低,相比较水提取杂质少,后续处理省时,该研究为国槐叶活性成分的开发和利用奠定了基础。
[1]乌兰格日乐,白海泉,翁慧.黄酮的抗氧化活性研究进展[J].内蒙古民族大学学报,2008,23,277-280.
[2]张汆,阚建全,陈家道,等.生物类黄酮抗癌作用研究进展[J].食品研究与开发,2003,24(3):38-41.
[3]Cook N C,Samman S.Flavonoids-Chemistry,metabolism,cardioprotective effects,and dietary sources[J]. The Journal of Nutritional Biochemistry,1996,79(2):66-76.
[4]余晓晖,赵磊,侯嘉,等.不同提取方法对淫羊藿中总黄酮提取率的比较[J].中成药,2011,33(7):1257-1259.
[5]陈利梅.超声波辅助双水相提取条斑紫菜黄酮类物质及其抗氧化活性研究[J].食品科学,2012,33(4):41-46.
[6]周清,姜浩,高云涛,等.丙醇-硫酸铵双水相体系与超声集成提取旱莲草总黄酮的研究,昆明冶金高等专科学校学报,2010,26(5):80-83.
[7]薄丽华,张赞平,魏振国,等.国槐种胚愈伤组织培养与异黄酮量的分析[J].中草药,2013,43(14):1984-1988.
[8]杨鑫,张秀省,穆红梅.国槐主要药用成分及提取方法研究进展[J].北方园艺,2011,(19):175-178.
[9]Paniwnyk L,Beaufoy E,Lorimer J P,etal.The extraction of rutin from flower buds of sophora japonica[J]. Ultrasonnics sonochemistry,2001,(8):299-301.
[10]龚盛昭,何远伦,杨卓如.微波提取芦丁的协同效应研究[J].食品科学,2004,25(5):135-137.
[11]田中民,万明习.中药槐角中槐角苷超声提取工艺的研究[J].中国药学杂志,2003,38(5):351-353.
[12]丛艳波,张永忠,刘潇.亚临界水提取槐角中总异黄酮的研究[J]. 中草药,2010,41(5):717-720.
[13]王璟,刘景东,勾凌燕,等.国槐槐叶中芦丁含量与生长时间关系的研究[J]. 现代中药研究与实践,2010,24(3):65-66.
[14]李彩霞,李复兴,李鹏,等.国槐叶黄酮的抗氧化活性研究[J].天然产物研究与开发.2013.25(5),676-680,683.
[15]许灵君,欧阳玉祝,吴道宏等.双水相体系协同超声提取法分离金银花总黄酮[J].食品与发酵技术,2010,46(6):93-96.
[16]于有伟,武瑞芝,王向东.超声波协同半仿生法提取羽衣甘蓝叶黄素工艺优化研究[J].陕西农业科学,2012,58(3):3-6.
[17]刘志刚,曾祥腾,孙维峰,等.正交实验优化土茯苓黄酮类成分提取工艺研究[J].中华中医药学刊,2010,28(3):19-21.
[18]高海宁,李彩霞,张勇,等.“黑美人”土豆色素体外抗氧化性研究[J].天然产物研究与开发,2012,24:224-228,233.
[19]Liu X L,Cui C,Zhao M M,etal.Identification of phenolics in the fruit of emblica(Phyllanthus emblica L.)and their antioxidant activities[J].Food Chemistry,2008,109(4):905-915.
[20]韦庆益,高建华,袁尔东,等.食品生物化学实验[M].广东:华南理工大学出版社,2012.161-162.
[21]刘金串,孟江飞,郭志君,等.膨大处理对红地球葡萄酚类物质及抗氧化活性的影响[J].食品科学,2012,33(5):7-12.
[22]Apak R,Gucuiu K G,Ozyurek M,etal. Novel total antioxidant capacity index for dietary polyphenols and vitamins C and E,using their cupric iron reducing capability in the presence of neocuproine:CUPRAC method[J]. Journal of Agricultural and Food Chemistry,2004,52(26):7970-7981.
[23]张京芳,王冬梅,张强.香椿叶抗脂质过氧化物的分离及抗氧化特性[J].农业工程学报,2009,25(1):285-290.
[24]Manian R,Anusuya N,Siddhuraju P,etal. The antioxidant activity and free radical scavenging potentia two difflerent solvent extracts of Camellia sinensis(L.)O.kuntz,Ficus bengalensis L. and Ficus racemosa L.[J].Food Chemistry,2008,107(3):1000-1007.
[25]魏磊,郑朝辉,侯成林,等.四种野生食用菌多糖的抗氧化活性[J]. 微生物学通报,2011,38(10):1533-1539.
[26]王金晶,单岩,刘春凤,等.酒花原花青素抗氧化性能研究食品工业科技,2013,34(8):118-122,128.
[27]栗本文,赵熙,黄怀生,等.绿茶总黄酮提取方法及对羟基自由基清除效果比较研究[J].茶叶通讯,2012,39(4):14-17.
[28]刁义平,束晓云,唐于平.槐叶化学成分研究[J].中国实验方剂学杂志,2011,17(6):89-92.
Study on the extraction method and antioxidant activity of flavonoids fromSophorajaponicaL.
LIXiao-yong1,HUOXi-dong1,YANGZi-yong1,ZHANGYong1,2,LICai-xia1,2,*
(1.College of Agriculture and Biotechnology,Hexi University,Zhangye 734000,China;2. Key laboratory of Hexi Corridor Resources Utilization of Gansu Universities,Hexi University,Zhangye 734000,China)
The study aimed to explore the flavonoids contents and antioxidant activity of diffrerent extracts fromSophorajaponicaL by ultrsonoc-assisted aqueous two-phase extraction(UATPE),reflux extraction(RE),Semi-bionic extraction(SBE),water extraction(WE),Ultrasonic assisted aqueous two-phase(alkaline UATPEA),respectively. The results indicated that the content of flavonoids extracted by RE was the highest,which showed a significant difference(p<0.05)compared with other methods except for UATPE(p>0.05). The antioxidant results showed that flavonoids extracts by the five different methods obtaining had strong antioxidant activity.The scavenging ability of DPPH free radical and reduction of copper ions of flavonoids extracted by UATPE was the strongest. In addition,ABTS radical scavenging effect and iron ion chelating power of UATPEA flavonoids extractes were the best than that of other methods. Moreover,the extracts obtained by different methods inhibition linoleic acid was RE>UATPE>SBE>UATPEA>WE. The results indicated that the flavonoids inSophorajaponicaL are soluble in organic solvent. The extracts obtained by UATPE has better antioxidant activity.
SophorajaponicaL. leave;flavonoids;extraction methods;antioxidant activity
2013-12-12 *通讯联系人
李小勇(1991-),男,本科,研究方向:天然产物开发与利用。
国家中医药管理局2012年中医药行业科研专项 (201207002)。
TS201.2
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.001
