慢性牙周炎合并血管钙化大鼠实验模型的建立
2014-09-20刘桂荣潘克清
姜 帅,邓 婧,刘桂荣,潘克清
(青岛大学医学院附属医院山东省教育厅口腔临床医学重点实验室,山东青岛266003)
血管钙化是高血压、动脉粥样硬化(atherosclerosis,AS)、糖尿病、肾病性血管病变及血管损伤老化等病理过程中普遍存在的现象,是心血管疾病的主要危险因子之一,有研究认为血管钙化是在慢性炎症刺激下软组织钙化的特殊表现[1]。牙周炎是一种世界范围内广泛流行的慢性非特异性感染性疾病,是心血管疾病(包括AS、心肌梗塞和中风)、糖尿病、呼吸系统感染等的危险因素[2]。但牙周炎是否对血管钙化也有一定的促进作用,目前尚未见详细报道。采用合适的方法建立一种合适的动物模型,是研究牙周炎与血管钙化的关系及其发病机制的重要条件。因此,本实验通过局部结扎、牙周混合致病菌感染并结合维生素D3肌注和尼古丁灌胃的方法,建立大鼠牙周炎合并血管钙化的复合动物模型,以期为进一步探讨牙周炎与血管钙化之间的关系奠定基础。
1 材料和方法
1.1 主要材料和设备
SPF级Wistar大鼠[由青岛市药品监督所提供,许可证号:SCXK(鲁)2009 0007];EG1160型病理组织包埋机(LEICA,德国);AB204-S分析天平(Mettler,瑞士);Unique-R20 超纯水仪(Sartorius,德国);锥形束 CT(VG11077S,NewTom VG,意大利);维生素D3注射液(批号009010,上海第九制药厂);尼古丁(sigma公司,美国);BHI液体培养基(青岛海博);牙周混合致病菌菌悬液:采集重度慢性牙周炎患者的龈下菌斑,并参照孟祥娇等[3]报道的方法,用BHI液体培养基制成细菌密度为1.5×109CFU/mL的菌悬液。
1.2 方法
1.2.1 血管钙化合并慢性牙周炎动物模型的建立
取雄性Wistar大鼠20只(体质量200±20)g,常规环境下适应性饲养1周后,随机分为血管钙化+慢性牙周炎组(VDN+CP组)、正常对照组(C组),每组10只。所有大鼠均于禁食禁水24 h后,分别按照实验设计进行相应干预处理。VDN+CP组大鼠在 100g/L水合氯醛腹腔注射(0.3 mL/100 g体质量)麻醉下,以4~0丝线分别结扎左、右侧上颌第二磨牙牙颈部(丝线尽量置于龈沟内),并局部接种牙周混合致病菌菌悬液(此后每周接种1次);然后参照Niederhoffer等[4]报道的血管钙化建模方法,在实验第1天9∶00每只大鼠肌肉注射维生素D3(3×105U/kg)1次,并分别于9∶00和18∶00用溶有尼古丁的花生油各灌胃1次(剂量为尼古丁25 mg/kg,花生油5 mL/kg)。正常对照组大鼠按建模组相同方法麻醉后,不结扎左右上颌第二磨牙,只在局部接种等体积生理盐水;并于实验第1天9∶00肌注等体积生理盐水,9∶00和18∶00各灌胃1次花生油(5 mL/kg)。上述处理结束后,所有大鼠均在相同环境下常规饲养8周,每周称量1次体质量,并检查结扎情况(若丝线脱落或位于龈上时,则重新结扎)。
1.2.2 牙周临床指标检查
建模结束后,由同一人使用改良牙周探针分别测量各受试牙的牙周探诊深度(PD)及龈沟出血指数(SBI),每个实验牙各测颊侧、腭侧两个位点,取均值。SBI评定标准采用Mazza(1981)提出的0~5分记分法,0为牙龈健康;1为牙龈轻度水肿,探诊不出血;2为仅在探诊处呈点状出血;3为出血沿龈缘扩展;4为出血溢出龈缘;5有自发出血倾向或溃疡形成。
1.2.3 牙槽骨丧失情况观察
建模结束(8周)后处死所有大鼠,分别解剖取出其含第二磨牙的双侧上颌骨,并浸泡于1mol/L的氢氧化钠溶液中。待软组织去净后,肉眼观察各实验牙的牙槽骨吸收情况;然后再用CBCT对其进行扫描(电压80 Kv,电流6.2 mA,扫描范围16 cm×7 cm,分辨率为0.2 mm)。所采集的数据用CT机器自带程序进行影像重建后,采用Profile tools软件测量各实验牙釉-牙骨质界到牙槽嵴顶的距离。
1.2.4 心脏重量及心重指数测定
解剖各大鼠并立即摘取其心脏,生理盐水彻底清洗后剪去血管,并用滤纸吸去残留血液;然后称量全心重量,以全心重/体质量(HW/BW)作为该大鼠的心重指数。
1.2.5 胸主动脉HE染色观察
取各大鼠的胸主动脉全长,用40 g/L多聚甲醛固定后,石蜡包埋、连续切片、HE染色,光学显微镜下观察血管的组织病理学变化。
1.3 统计学分析
2 结果
2.1 两组大鼠牙周临床指标比较
建模结束后,正常对照组(C组)牙周组织正常,牙龈呈粉红色,质地致密坚韧,无龈沟出血情况,无炎性改变;VDN+CP组实验牙则出现明显的牙周炎症,牙龈红肿,探诊易出血,SBI和PD均明显高于C组(P<0.05)(表1)。
表1 两组动物SBI和PD比较(n=10,s)

表1 两组动物SBI和PD比较(n=10,s)
*与C组相比P<0.05
组别 SBI PD(mm)0.5±0.52 0.16±0.07 VDN+CP 3.2±0.78* 1.22±0.33 C*
2.2 两组大鼠牙槽骨丧失情况比较
建模8周后取各组大鼠带有3个磨牙的上颌骨,肉眼观察可见C组牙槽骨无明显吸收,牙槽嵴高度无明显降低;而VDN+CP组牙槽嵴高度则较C组明显降低,部分标本牙槽骨吸收近根尖(图1)。
采用Cone beam CT对各组颌骨标本进行扫描,并重建牙齿、牙槽骨硬组织表面影像,则可更直观地比较两组牙槽骨的骨丧失情况(图2)。利用profile tools软件测量各组实验牙釉-牙骨质界到牙槽嵴顶点的距离显示,VDN+CP组的牙槽骨吸收值明显高于C组(P<0.05)(表2)。

图1 肉眼观两组牙槽骨丧失情况

图2 CBCT观察两组牙槽骨丧失情况
表2 两组牙槽骨吸收值比较(n=10,s)
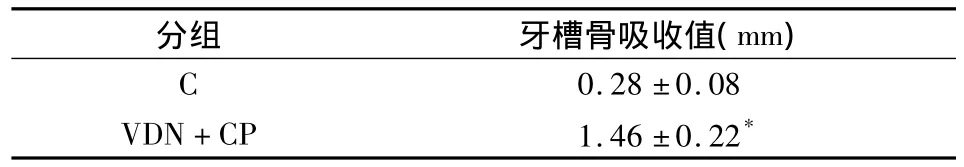
表2 两组牙槽骨吸收值比较(n=10,s)
*与C组相比P<0.05
分组 牙槽骨吸收值(mm)0.28±0.08 VDN+CP 1.46±0.22 C*
2.3 胸主动脉病理形态学观察
正常对照组胸主动脉HE染色观察显示,其内外壁轮廓平滑而完整,管壁呈厚度均匀的环形排列,且染色深浅基本一致;管腔内未见血栓形成和脱落的坏死组织;内膜、中膜和外膜分界清楚,内膜较薄,表面为单层内皮细胞覆盖;中膜壁较厚,并含有多层呈波浪状平行排列的弹性膜,弹性膜之间夹杂平滑肌纤维和胶原纤维;外膜较薄,为疏松结缔组织(图3a)。
VDN+CP组胸主动脉HE染色观察显示,其内外壁可见轮廓凹凸不平的灶状病变,管壁厚薄不均,染色深浅不一;内膜部分已被破坏,细胞排列紊乱;中膜部分区域有明显萎缩,弹性纤维层结构不清,且排列疏松、相互交织,延展性降低;平滑肌细胞减少或萎缩,且排列紊乱并与弹力纤维层分离,部分胞浆出现空泡化,细胞核呈变圆或固缩成点、线状甚至消失,核仁不清;有部分中膜的平滑肌细胞移入内膜,并增生产生结缔组织,使内膜增厚(图3b)。
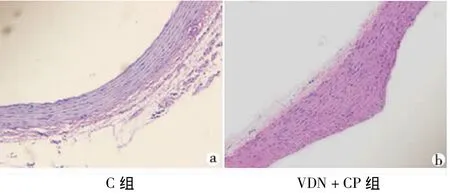
图3 两组胸主动脉病理形态学观察(HE×20)
2.4 两组心脏重量及心重指数比较
建模结束后,取各大鼠的心脏进行称重显示,VDN+CP组大鼠的心脏重量(HW)及心重指数(HW/BW)均明显高于对照组(P<0.05)(表3)。
表3 各组大鼠心脏重量和心重指数的比较(n=10,s)

表3 各组大鼠心脏重量和心重指数的比较(n=10,s)
*与对照组相比P<0.05
组别 体质量(g)心重(g)心重指数C 419.2±10.73 1.15±0.45 0.0027±0.0001 VDN+CP 398.6±10.88 1.30±0.55* 0.0033±0.0001*
3 讨论
血管钙化作为心血管疾病的主要危险因子,普遍存在于动脉粥样硬化、高血压、肾病性血管病变以及血管损伤、老化等病理过程中。既往认为,血管钙化是被动的过程,作为与衰老伴行的退行性病变,是血管老化的标志。但近年越来越多的研究发现,血管钙化的形成过程与骨发育类似,是一种可高度调控的生物学过程[5-6]。有研究认为,血管钙化是在慢性炎症刺激下软组织钙化的特殊表现[1]。牙周炎是一种慢性非特异性感染性疾病,不仅可破坏牙周组织,导致牙周袋形成、牙齿松动移位,而且有炎症的牙周组织中的细菌及其产物更易进入外周血及深层组织,大量的炎症介质也会随着血液循环与全身各重要器官、系统相互作用,诱发或加重某些全身系统性疾病。Egelberg等报道,牙周损害可以促进牙周致病菌在全身的播散[7]。封艳等也报道,宿主对细菌及其毒性产物刺激的免疫炎症反应不仅可使牙周组织受到破坏,异常的炎症反应还会增加患糖尿病和心血管疾病的危险性[8]。但牙周炎是否与血管钙化有一定的相关性,目前尚未见详细报道。为此,本实验选择Wistar大鼠作为实验动物,通过丝线结扎牙颈部、局部接种牙周混合致病菌,并结合维生素D3肌注和尼古丁灌胃,建立牙周炎合并血管钙化的复合动物模型,以期探讨牙周疾病与血管钙化的相关性。
关于牙周炎动物模型的制备方法,国内外已有相关报道,目前常用的方法是采用全身因素或局部刺激[9]。全身因素主要采用免疫抑制剂、激素等;局部刺激因素主要采用高糖饮食、结扎、手术刺激、接种牙周特异致病菌等。但是,采用全身因素的制备方法容易破坏动物的免疫系统,导致某些细胞因子的异常表达,从而使测量指标出现偏差。因此,本实验采用了丝线结扎+局部接种牙周致病菌的方法[9-111],使实验大鼠口腔的病变过程更符合临床常见的牙周炎的发病过程。结果表明,建模组的牙周探诊深度(PD)、龈沟出血指数(SBI)以及牙槽骨丧失值均明显高于正常对照组(P<0.05),说明实验动物形成了慢性牙周炎。
目前制备鼠血管钙化模型的方法主要有药物诱导、基因敲除、慢性肾功能衰竭和高脂饮食近交培育等4种。其中,药物诱导与另3种其他建模方法相比,具有操作简便、建模周期相对较短、成活率高,成本较低的优点,是目前制备血管钙化动物模型的首选[12]。而且,华法令、维生素 D3、尼古丁、氯化钙等药物的单独或联合应用均可诱导大鼠和小鼠形成动脉钙化。因此,本实验参照Niederhoffer等[4]报道的方法,采用维生素D3肌注联合尼古丁灌胃制备大鼠血管钙化模型,其中大剂量维生素D3可增加动脉组织中钙的含量[13];而尼古丁不仅可损伤动脉血管组织,同时还可使维生素D3的作用进一步增强[14],二者合用可造成动脉钙超载,引起动脉中膜、弹性纤维钙沉积,最终形成血管钙化。
有研究表明,心肌功能和结构发生改变与长期血管钙化也有密切关系,本结果显示,VDN+CP组大鼠的心脏重量及心重指数均明显高于对照组(P<0.05),说明VDN+CP组大鼠可能发生心肌肥大的现象,与以往的相关研究结果一致[15],但牙周炎是否会加重此现象,还需要进一步研究观察。
结合牙周临床指标检查、锥形束CT扫描以及心血管组织病理学观察等综合判定,通过维生素D3肌注+尼古丁溶于花生油灌胃法和丝线结扎+细菌接种的方法可成功建立实验所需的动物模型,该模型可用于牙周炎与血管钙化相关性的进一步研究。
[1]Li JJ,Zhu CG,Yu B,et al.The role of inflammation in coronary artery calcification [J].Ageing Res Rev,2007,6(4):263-270.
[2]Gulati M,Anand V,Jain N,et al.Essentials of periodontal medicine in preventive medicine[J].Int J Prev Med,2013,9(4):988-994.
[3]孟祥娇,于新波,邓婧.氢饱和水对大鼠实验性牙周炎抗炎作用的初步观察[J].齐鲁医学杂志,2012,27(4):358-360.
[4]Niederhoffer N,Bobryshev YV,Lartaud-Idjouadiene I,et al.Aortic calcification produced by vitamin D3 plus nicotine[J].Vasc Res,1997,34(5):386-398.
[5]Wallin R,Wajih N,Greenwood GT,et al.Arterial calcification:A review of mechanisms,animal models,and the prospects for therapy[J].Med Res Rev,2001,21(4):274-301.
[6]Mody N,Tintut Y,Radcliff K,et al.Vascular calcification and its relation to bone calcification:possible underlying mechanisms[J].Nucl Cardiol,2003,10(2):177-183.
[7]Egelberg J.Local effect of diet on plaque formation and development of gingivitis in dogs.Effect of hard and soft diets[J].Odontol Revy,1965,16:31-41.
[8]封艳,钟良军,张源明.牙周炎与动脉粥样硬化[J].牙体牙髓牙周病学杂志,2005,15(12):699-702.
[9]史凤芹,于世凤,庞淑珍.牙周炎动物模型初步研究[J].中华口腔医学杂志,1994,29(1):50-52.
[10]Jain A,Batista EL,Serhan C,et al.Role for periodontitis in the progression of lipid deposition in an animal model[J].Infect Immun,2003,71(10):6012-6018.
[11]王晓敏,于世凤.牙周炎动物模型的建立及技术关键[J].牙体牙髓牙周病学杂志,1999,9(1):89-91.
[12]段晓辉,齐永芬,唐朝枢.血管钙化动物模型的研究进展[J].中国动脉硬化杂志,2008,16(2):153-157.
[13]Wang SY,Zhou HH.The effect of vitamin D receptor in intestinal tract tissue [J].China Pharmacol Bull,2007,23(2):151-154.
[14]Grases F,Sanchis P,Perell J,et al.Effect of crystal lization in hibitorson vascular c-alcifications induced by vitamin D:apilot study in Sprague Dawley rats[J].Circ J,2007,71(7):1152-1156.
[15]Jegger D,Silve R,Jeanrenaud X,et al.Ventricular-arterial coupling in a rat model of reduced arterial compliance provoked by hypervitaminosis D and nicotine[J].Am J Physiol Heart Circ Physiol,2006,291(4):H1942-1951.
