Piezos离子通道在大鼠牙周组织中表达的实验研究
2014-09-20黄世友段银钟
康 婷,黄世友,李 鹏,史 婷,余 擎,段银钟
(1.第四军医大学口腔医院正畸科军事口腔医学国家重点实验室,陕西西安710032;2.解放军第422医院,广东湛江524005;3.成都军区机关医院,四川成都610000;4.河南护理职业学院,河南安阳455000)
当活细胞和有机体受到环境中的机械刺激时,机械信号随即被转化成生物信号,并将其整合使之表现为细胞反应,这一现象称为机械转导[1]。机械转导与一大类细胞膜分子相关,主要包括离子通道、特异性细胞骨架蛋白、细胞连接分子、G蛋白耦合受体和激酶等[2-3]。在最近的研究中,学者们多倾向于将离子通道作为一种具有传导性的分子,并已确定了最有可能的分子种类。目前认为,机械敏感性通道(Mechanosensitive channel,MSCs)或称为机械门控性通道(Mechano-gated channel),是活细胞表面的机械刺激转化为细胞内电信号或化学信号时主要的机械感受器,并与细胞骨架一起构成机械感受器体系[4-6]。压电离子通道(Piezo)是最近发现的一种新型机械敏感离子通道,2010年Coste等采用RNA干扰技术通过降低Neuro2A细胞的机械反应,确定了其基因序列,并结合全细胞刺激/记录的膜片钳和分子生物学的方法对其进行了验证[7]。目前,关于Piezo的特性和功能还有很多重要方面尚未明确。
牙周膜(又称牙周韧带)由致密的结缔组织构成,其成分主要有纤维、基质、牙骨质小体和细胞(成纤维细胞、成骨细胞、破骨细胞、成牙骨质细胞以及少量干细胞),并且有血管、神经、淋巴管分布。牙周膜作为连接牙齿和牙槽窝的组织,不仅可以缓冲咀嚼压力,还可承受各种正畸力,是正畸矫治的重要生物学基础[8-10]。Piezos是与机械反应有关的基因产物,因其具有机械敏感性而可被机械力直接激活[11],并参与细胞对伤害性刺激的反应[12]、细胞数量的自我平衡[13]以及细胞容积的调控[14],在多种细胞和组织上均有其表达;但目前尚没有研究证明Piezos蛋白在牙周组织中的表达及相关功能。本实验拟通过间接免疫荧光技术,在蛋白水平观察压电离子通道Piezos蛋白在牙周组织的表达,以了解其定位特点,并结合有关Piezos离子通道生理特性的研究基础,初步探讨Piezos蛋白在牙周组织机械感受中的作用。
1 材料和方法
1.1 主要材料、试剂和仪器
雄性Sprague-Dawley(SD)大鼠(第四军医大学动物实验中心提供);170 g/L EDTA脱矿液(上海Sangon生物工程技术公司);0.01 mol/L柠檬酸盐抗原修复液(自配,柠檬酸0.4 g、柠檬酸钠2.4 g,溶于1 000 mL三蒸水中,调节pH至6.0左右);Piezo1和Piezo2兔抗大鼠多克隆抗体(Abcam,英国);Alexa Fluor® 488标记山羊抗小鼠IgG荧光二抗(北京中衫金桥生物技术公司);生物组织自动脱水机(TS-12U)、生物组织包埋机(BMIX)、摊片烤片机(CS-VI)(孝感宏业医用仪器有限公司);石蜡切片机(RM 2235,Leica公司,德国);激光共聚焦显微镜(FV-1000,Olympus公司,日本)。
1.2 方法
1.2.1 牙周组织标本制备和切片
取8周龄雄性SD大鼠(体质量200 g左右,牙列完整,无畸形及龋损),用戊巴比妥过量麻醉处死后,取双侧上颌包含后牙及其周围牙槽骨的骨块,置新鲜配制的40 g/L多聚甲醛液中固定24 h(4℃)。然后将固定后的各组织块分别置50 mL 170 g/L EDTA液中进行脱钙,每3 d更换1次脱钙液。待针刺标本可以轻松穿透时(约2个月),取出标本流水冲洗24 h(充分去除残留EDTA),并分别用600、700、800、950 mL/L(2 份次)乙醇脱水各12 h;正丁醇浸泡12 h后再分别放入无水乙醇(3份次)中脱水各12 h、1∶1乙醚/无水乙醇1 h、氯仿(3份次)各30 min;最后在57℃下浸蜡3 h。取上述处理后的各标本,分别用慢速打磨机进行修整,以便控制切片方向;然后常规石蜡包埋,并沿牙齿矢状向作连续切片(片厚3 μm)、49℃展片、阳离子防脱载玻片捞片,60℃烤片2~3 h后用于免疫组化检测。
1.2.2 间接免疫荧光检测
上述组织切片常规脱蜡至水,并分别置于0.01 mol/L柠檬酸盐抗原修复液中,微波加热修复抗原后,滴加山羊血清封闭30 min(室温);滴加5 μg/mL的 Piezo1抗体和 Piezo2抗体(一抗),4 ℃孵育过夜;PBS摇洗 10 min×3次,滴加 Alexa Fluor® 488标记的山羊抗小鼠 IgG荧光二抗(1∶50稀释),37℃孵育1 h;PBS摇洗10 min×3次,滴加2 μg/mL的 DAPI,30℃孵育30 min进行衬染;最后滴加防淬灭封片剂封片,并置于激光共聚焦显微镜下进行观察。分别在每张组织切片上确定上颌第一磨牙根中1/3部位的牙周膜后,从中随机选择5个视野,使用ImagePro Plus测定其灰度值。
1.3 统计学分析
采用SPSS 13.0软件进行统计分析,Piezo1和Piezo2的表达量比较用随机设计t检验,检验水准α=0.05。
2 结果
Piezo1和Piezo2在牙周成纤维细胞中均呈阳性表达,其中Piezo2的表达量低于Piezo1,其灰度值分别为281.9±32.4和115.5±42.2,差异有统计学意义 (P<0.05)。但Piezo1和Piezo2两种蛋白在不同部位牙周膜里的表达分布并不均匀(荧光强弱不一致),在根侧牙周膜成纤维细胞中Piezos的表达沿牙周主纤维的走形呈斜行分布;在靠近固有牙槽骨处的牙周膜中的成骨细胞上也有少量表达,而且在这些细胞中的表达部位集中于胞膜上,部分在胞浆里;但在固有牙槽骨中的骨细胞中未见有Piezos蛋白的特异性阳性表达,只在牙槽骨的孔隙中有团状的阳性表达(图1~2)。
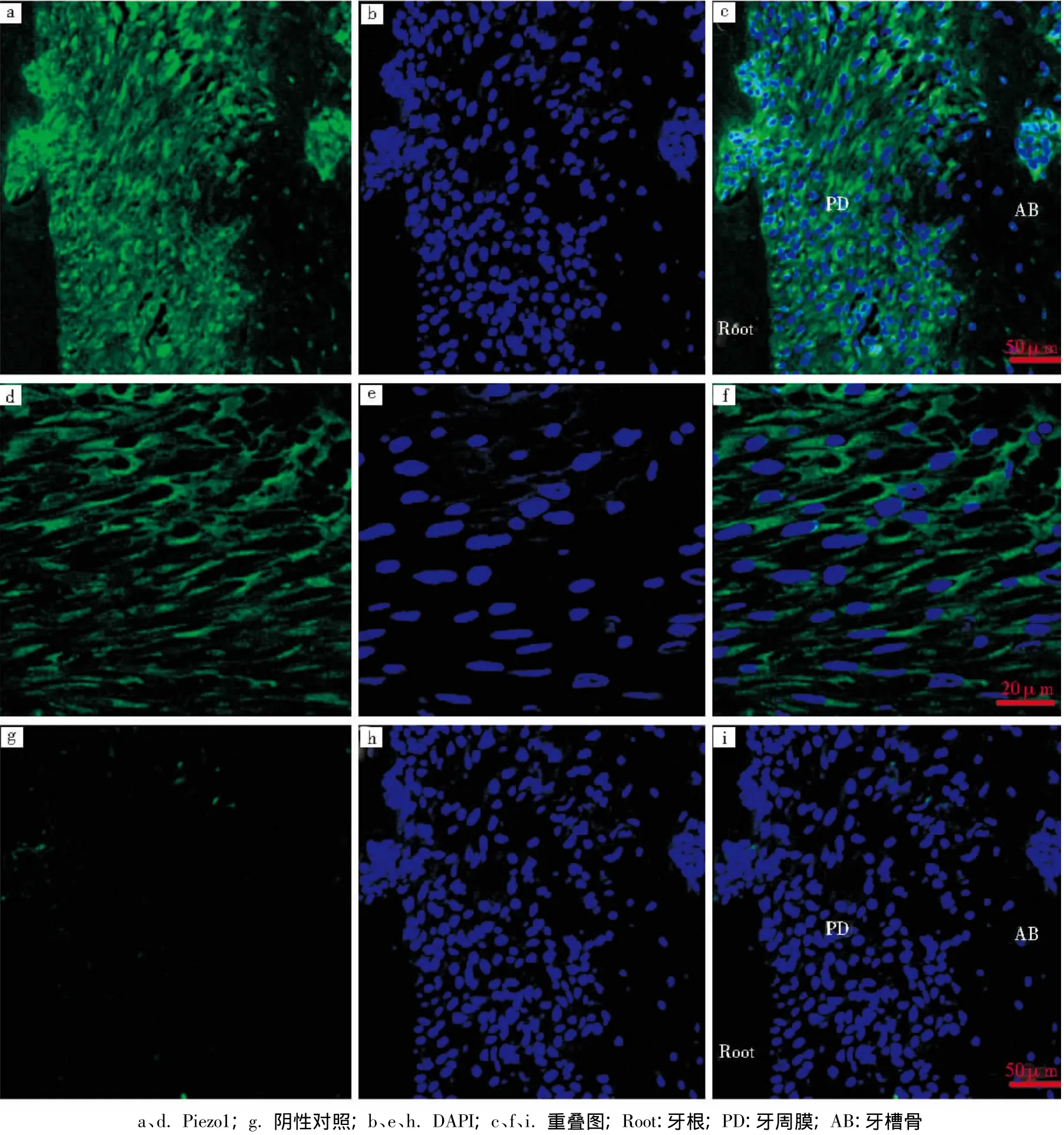
图1 Piezo1在牙周组织中的表达
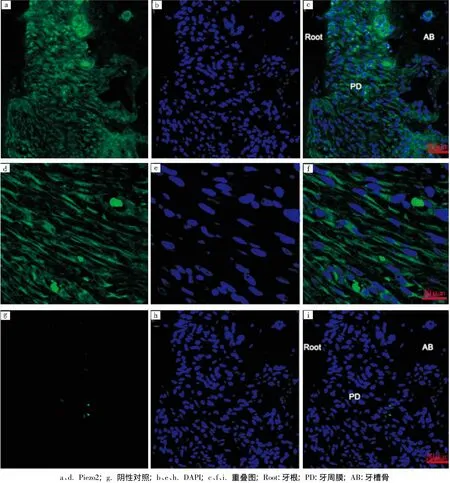
图2 Piezo2在牙周组织中的表达
3 讨论
牙周膜中有大量纵横交错的胶原纤维束,其间布满细胞和组织液,而这些血液来源的组织液充满了牙周膜的所有空腔。牙周膜之所以能在复杂的咀嚼运动中有效地发挥减震器的功能,正是因为具备了这种多液体、多孔、富有弹性的网架结构,而其形态的维持依赖于咬合力对牙周组织的刺激[15]。体内研究证明,牙周膜内的基质细胞,特别是成纤维细胞和成骨细胞均具有获得机械信号的效应器,不但能够感受机械力,还可产生一系列维持牙周膜宽度和保护细胞的多样性的反应[16]。牙周膜和牙槽骨的细胞特征表明,当咀嚼力作用于牙齿时,可由牙周膜来完成牙槽骨的快速改建[17-18]。因此,咀嚼力下的牙周膜机械转导决定了牙槽骨骨量和牙周膜形态的维持[19]。机械转导与离子通道、特异性细胞骨架蛋白等有密不可分的关系,而Piezos离子通道则是一类具有传导性的分子,并因其能快反应而成为效率很高的压力感受器[20];但牙周膜成纤维细胞是否也表达该通道蛋白,目前尚未见相关报道。
本实验通过间接免疫荧光标记观察发现,Piezo1和Piezo2蛋白在牙周膜中均呈阳性表达,其中Piezo1的表达量明显高于Piezo2,与Coste等[7]报道的Piezo2比Pierol表达水平更低的结果类似。虽然不能排除其他离子通道在牙周膜感受机械力时的作用,但由于Piezos离子通道具有完整的机械敏感性[7],仍然可以推测该通道在牙周膜中可能具有独立的机械敏感感知功能;并且可能存在与其他离子通道不同的激活模式。本实验中发现,固有牙槽骨中的成熟骨细胞未见Piezos的表达,而在牙周膜成纤维细胞中有大量表达。由此可以推测,在非外力移动牙齿的状态下,牙周膜中的成纤维细胞伴随牙周膜主纤维生长,处在感受咀嚼力的前沿,连同位于固有牙槽骨表面的成骨细胞一起,可能都是活跃的Piezos离子通道表达细胞。虽然细胞感知咀嚼力引起的形变、压力和受力的分子机制仍不够清楚,但是根据该离子通道的表达情况,至少可以推测其参与了牙周膜感知的功能。
本实验证实了牙周组织,特别是牙周膜中有丰富的机械敏感性离子通道 Piezos的表达,其中Piezo2的表达量明显低于Piezo1。鉴于牙周膜是牙周组织中对牙齿受到的机械力刺激进行感受的第一效应器,而Piezos作为一个在其他组织中已被证实与细胞机械转导及伤害性感受有关的机械敏感离子通道,可能在其中扮演了感受器的角色。该发现为进一步研究牙周组织对于咀嚼力、正畸力的分子生物学反应奠定了一定的基础。
[1]Huang H,Kamm RD,Lee RT.Cell mechanics and mechanotransduction:pathways,probes,and physiology[J].Am J Physiol Cell Physiol,2004,287(1):C1-C11.
[2]Matthews BD,Thodeti CK,Tytell JD,et al.Ultra-rapid activation of TRPV4 ion channels by mechanical forces applied to cell surface beta1 integrins[J].Integr Biol,2010,2(9):435-442.
[3]Anishkin A,Kung C.Stiffened lipid platforms at molecular force foci[J].Proc Natl Acad Sci USA,2013,110(13):4886-4892.
[4]Gillespie PG,Walker RG.Molecular basis of mechanosensory transduction[J].Nature,2001,413(6852):194-202.
[5]Hamill OP,Martinac B.Molecular basis of mechanotransduction in living cells[J].Physiol Rev,2001,81(2):685-740.
[6]Chalfie M.Neurosensory mechanotransduction[J].Nat Rev Mol Cell Biol,2009,10(1):44-52.
[7]Coste B,Mathur J,Schmidt M,et al.Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels[J].Science,2010,330(6000):55-60.
[8]Cho MI,Garant PR.Development and general structure of the periodontium[J].Periodontol,2000,2000,24(1):9-27.
[9]Henneman S,Von den Hoff JW,Maltha JC.Mechanobiology of tooth moverment[J].Eur J Orthod,2008,30(3):299-306.
[10]Krishnan V,Davidovitch Z.On a path to unfolding the biological mechanisms of orthodontic tooth movement[J].J Dent Res,2009,88(7):597-608.
[11]Martinac B.The ion channels to cytoskeleton connection as potential mechanism of mechanosensitivity[J].Biochimi Biophys Acta,2014,1838(2):682-691.
[12]Dubin AE,Schmidt M,Mathur J,et al.Inflammatory signals enhance piezo2-mediated mechanosensitive currents[J].Cell Rep,2012,2(3):511-517.
[13]Fernandez-Gonzalez R,Zallen JA.Feeling the squeeze:livecell extrusion limits cell density in epithelia[J].Cell,2012,149(5):965-967.
[14]Gottlieb PA,Bae C,Gnanasambandam R,et al.Piezo1 mutations identified in xerocytosis alter the inactivation rate[J].Biophys J,2013,104(2,S1):467a-467a.
[15]李晶,洪岩松,钟鸣,等.咬合力丧失影响大鼠牙周组织中iNOS mRNA的表达[J].现代口腔医学杂志,2006,20(4):394-396.
[16]Wise GE,King GJ.Mechanisms of tooth eruption and orthodontic tooth movement[J].J Dent Res,2008,87(5):414-434.
[17]Toms SR,Lemons JE,Bartolucci AA,et al.Nonlinear stressstrain behavior of periodontal ligament under orthodontic loading[J].Am J Orthod Dentofacial Orthop,2002,122(2):174-179.
[18]Krishnan V,Davidovitch Z.Cellular,molecular,and tissuelevel reactions to orthodontic force[J].Am J Orthod Dentofacial Orthop,2006,129(4):469.e1-469.e32.
[19]McCulloch CA,Lekic P,McKee MD.Role of physical forces in regulating the form and function of the periodontal ligament[J].Periodontol,2000,2000,24(1):56-72.
[20]Ross TD,Coon BG,Yun S,et al.Integrins in mechanotransduction[J].Curr Opin Cell Biol,2013,25(5):613-618.
