3D培养牙周膜干细胞生物学特性的初步研究
2014-09-20罗傲翔吴补领吴靖漪李心竹
罗傲翔,吴补领,侯 晋,吴靖漪,胡 娇,李心竹
(广东广州:1.南方医科大学南方医院,510515;2.南方医科大学口腔医学院,510515;3.南方医科大学附属广东省口腔医院,510280)
牙周膜干细胞(Periodontal ligament stem cells,PDLSCs)是存在于牙周组织中的干细胞,由Seo等[1]2004年首次从健康成年人牙周膜组织中分离,并发现其具有成体干细胞的特性,可作为牙周组织再生的种子细胞。但常规贴壁培养的牙周膜干细胞会随着体外培养时间的延长,而渐渐丧失间充质干细胞的多向分化特性。有研究发现,3D培养的细胞具备更好的细胞表型,更接近人体三维组织结构;并因其可最大程度地维持细胞的性状而备受组织工程研究的关注[2]。现行的3D细胞培养方法有:多孔细胞支架培养[3]、动力培养系统(包括旋转式细胞反应器和搅拌式反应器)以及微基板的3D培养法。悬滴培养法(hanging drop)也是3D培养方法的一种,且其因操作简便,无需运用特殊仪器而受到广大研究者的推崇。目前,尚未对悬滴法3D培养的牙周膜干细胞的生物表型及其生物特性进行专门探讨,因此,本实验拟运用悬滴法3D培养牙周膜干细胞,并通过观察3D牙周膜干细胞聚合物在体外的形态、细胞的存活率、细胞表面标记物以及细胞矿化能力的改变,对悬滴法培养的牙周膜干细胞生物学特性进行初步的研究,以期为牙周组织再生奠定基础。
1 材料和方法
1.1 主要试剂和仪器
DMEM培养基、胎牛血清(Hyclone,美国);Ⅰ型胶原酶、胰蛋白酶(Gibco,美国);Hanging Drop培养板(Perfecta3D Hanging Drop Plates 3D,美国);培养瓶、6孔板、24孔板(Corning Costar,美国);Mxpro-Mx7500荧光定量 PCR仪(Stratagene,美国);智能激光共聚焦显微镜(Olympus FV10i-W型,日本);倒置光学显微镜(Olympus,日本);流式细胞仪(BD,美国);碘化丙啶(Propidium Iodide,PI);钙黄绿素(Calcein-AM)(Sigma,美国);RNeasy Mini Kit(Qiagen,德国);CD44、CD29、CD90、CD105荧光素标记鼠抗人抗体(biolegend,美国)。
1.2 PDLSCs的分离培养
收集18~25岁志愿者(知情同意)因正畸减数而新鲜拔除的无龋损、无牙周病的前磨牙或第三磨牙,用含双抗的PBS反复冲洗后,刮取根中1/3牙周膜并将其剪成0.5 mm×0.5 mm×0.5 mm大小的组织块;用Ⅰ型胶原(625 U/mL)37℃消化10 min使组织松散后,1 000 r/min离心5 min,弃上清;加入少量DMEM培养液并轻轻吹打,使细胞悬液与松散的组织呈混匀状态后,将其移至6孔板内铺平,并用盖玻片压于组织之上;分别于每孔加入2 mL培养液,放入37℃、50 mL/L CO2培养箱中进行培养。3 d后半量换液,此后隔天换液,待细胞生长至80%融合时,常规传代培养[4]。
1.3 3D PDLSCs培养
取第3代PDLSCs,根据文献报道和预实验结果,按接种细胞数量不同分为3组:2.5×104组、5×104组、1×105组。然后将3组细胞分别接种于Perfecta3D Hanging Drop Plates 3D培养板中,常规条件下进行培养。每天换液1次,96 h后收取各组细胞聚合物进行以下相关检测。
1.4 不同密度PDLSCs 3D培养时的细胞活性检测
取2D培养(传代贴壁高密度)的PDLSCs及不同细胞接种量(2.5×104/孔,5×104/孔、1×105/孔)下3D培养的PDLSCs细胞聚合物,倒置显微镜下观察并测量其直径后,分别于各孔中加入PI/Calcein-AM混合荧光染色液(PI终浓度为15 μmol/L,Calcein-AM 终浓度为10 μmol/L),放入孵箱中孵育24 h后荧光共聚焦显微镜观察。
1.5 2D和3D培养的PDLSCs细胞表面标记物检测
分别取第3代贴壁培养(2D)的PDLSCs和细胞接种密度为2.5×104/孔的3D培养的 PDLSCs聚合物,用胰蛋白酶消化并制备单细胞悬液后,分别加入 PE或 FITC标记的 CD44、CD29、CD90、CD105鼠抗人抗体,流式细胞仪检测标记抗体阳性细胞的百分比。
1.6 2D和3D培养的PDLSCs矿化分化能力观察
1.6.1 矿化诱导培养
取第3代PDLSCs以2.5×104/孔的密度分别接种于24孔板(2D培养)及hanging drop 3D培养板中,常规培养96 h后弃原培养液,2D培养的24孔板中直接加入矿化诱导液(含100 mL/L FBS、0.1 μmol/L 塞 米 松、50 μmol/L 维 他 命 C、10 mmol/L B-磷酸甘油的 DMEM)继续培养;hanging drop 3D培养板中的PDLSCs先移入低粘附6孔板后,再加入矿化诱导液继续培养。
1.6.2 茜素红染色观察
2D、3D培养的PDLSCs分别经矿化诱导7 d后,用茜素红进行染色,倒置显微镜下观察矿化结节形成情况并拍照。
1.6.3 矿化相关基因表达水平的检测
2D和3D培养的PDLSCs经矿化诱导7 d后,分别用RNeasy Mini Kit提取细胞总RNA,并逆转录合成cDNA。根据Genbank查得骨桥蛋白(OPN)、碱性磷酸酶(ALP)和GAPDH的基因序列分别为NM000582.2、NM001127501.2和NM002046.4后,运用Oliga 6.0软件设计特异性引物,并由上海生工生物工程有限公司合成(具体序列见表1)。然后用荧光定量PCR(qRT-PCR)仪分别检测2D、3D培养的PDLSCs中OPN、ALP RQ mRNA的水平,并使用仪器自带软件对其结果进行定量分析。

表1 qRT-PCR引物序列
1.7 统计学分析
采用SPSS 13.0统计软件对qRT-PCR结果进行统计分析,组间比较用t检验,检验水准α=0.05。
2 结果
2.1 细胞形态学观察及细胞活性分析
2.1.1 原代PDLSCs
改良酶消化组织块法培养7 d后,既有细胞从组织块中游出;细胞呈长梭形,胞质均匀,胞体丰满,胞核椭圆,胞质突起呈放射状,呈成纤维细胞样(图1)。
2.1.2 不同细胞量3D培养的PDLSCs聚合物
PDLSCs 3D培养96 h后,即形成一均质而致密的3D细胞聚集体,其致密程度与细胞初始接种数量呈正相关。细胞量为2.5×104/孔的细胞聚合物直径约为(0.73±0.14)mm;细胞量为5×104/孔的细胞聚合物直径约为(0.94±0.3)mm;细胞量为1×105/孔的细胞聚合物直径约为(1.24±0.23)mm(图2)。

图1 原代培养的牙周膜干细胞(倒置显微镜,×10)

图2 不同细胞量3D培养的PDLSCs细胞聚合物直径(倒置显微镜×10,bar=100 μm)
2.1.3 不同密度PDLSCs 3D培养时细胞活性比较
3D及2D培养96 h后的PDLSCs聚合物经Live/Dead染色激光共聚焦显微镜观察可见,3D培养情况下,接种细胞数量为2.5×104时,细胞存活率较高,聚合物中心未见明显的坏死现象(图3a);接种细胞数量为5×104时,细胞存活率虽有所降低,但活细胞数目仍然较多(图3b);当接种细胞数为1×105时,细胞存活率低且聚合物中心坏死明显(图3c);而2D的PDLSCs未发现细胞坏死现象(图3d)。因此选择2.5×104的细胞接种量进行后续实验。
2.2 干细胞表面标记物检测结果
流式细胞术检测显示,第3代PDLSCs(2D培养)均阳性表达间充质干细胞表面标志物CD44、CD29、CD90、CD105,其阳性率分别为 99.13%、98.17%、100%、78.21%;2.5×104/孔的接种密度3D培养的PDLSCs亦阳性表达间充质干细胞表面标记物 CD44、CD29、CD90、CD105,其阳性率分别为 99.58%、88.19%、99.51%、51.25%(图 4)。

图3 2D、3D培养96 h后的PDLCs聚合物Live/Dead染色观察(共聚焦显微镜×20)

图4 2D、3D培养的PDLSCs干细胞表面标记物流式细胞仪检测结果
2.3 3D和2D培养的PDLSCs矿化分化能力比较
2.3.1 矿化结节形成情况比较
2D和3D培养的PDLSCs矿化诱导7 d后,茜素红染色显示:2D培养的PDLSCs仅可见少数红色矿化结节,而2.5×104/孔细胞密度3D培养的PDLSCs则可见大量的茜素红阳性染色物质(图5)。

图5 2D、3D培养的 PDLSCs矿化诱导7 d后茜素红染色观察(倒置显微镜 ×10)
2.3.2 矿化相关基因表达水平的比较
2D和3D培养的PDLSCs矿化诱导培养7 d后,荧光实时定量PCR检测结果显示,3D培养的PDLSCs各矿化相关基因ALP及OPN mRNA的表达水平(RQ值)均明显高于2D培养的PDLSCs(P<0.05),表明3D培养有利于PDLSCs的矿化向分化(图6)。
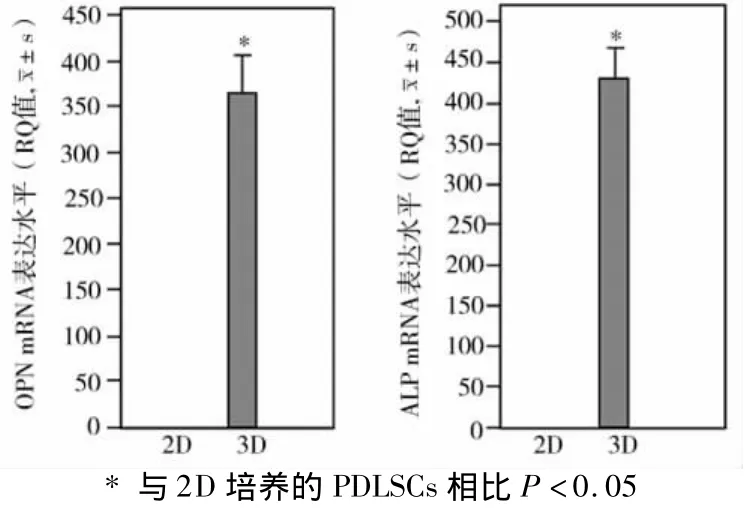
图62 D、3D培养的PDLSCs各矿化相关基因表达水平的比较
3 讨论
本实验运用悬滴法3D培养PDLSCs,观察到PDLSCs可聚合成3D细胞聚合物。与其他3D培养方法(如微基板、生物反应器、支架材料等)相比,悬滴法操作简便,并且可使细胞紧密聚合,从而促进细胞间的相互作用,提高干细胞的生物学特性。Bartosh TJ等(2010)使用悬滴法3D培养骨髓间充质干细胞,结果显示该方法培养后的骨髓间充质干细胞克隆形成能力及分泌抗炎因子能力均显著增强,并且仍保持其多向分化的潜能[5]。PDLSCs是牙周组织再生的重要的种子细胞,具有取材方便、获得率高、增殖能力强等优势,并且在体外特定培养条件下,可分化为成骨细胞、脂肪细胞、软骨细胞;在体内可生成牙骨质样组织和牙周膜样组织,具有牙周再生的潜能。因此PDLSCs近年来已成为口腔组织工程种子细胞研究的热点之一[6]。另外,通过3D法培养PDLSCs可以大量获得种子细胞并可提高其生物学特性,因此,悬滴法3D培养PDLSCs在牙周组织再生修复中具有一定的应用前景。
本实验应用HangingDrop 96孔3D培养板对PDLSCs进行3D培养后,Live/Dead染色观察显示:当接种细胞的密度为2.5×104/孔时,细胞活性较好;而当细胞接种数量为5×104/孔或1×105/孔时,细胞存活率则相对降低,说明3D细胞聚合物的死亡率与初始接种细胞的数目及细胞聚合体的直径相关。初始接种5×104/孔和1×105/孔的PDLSCs可能由于细胞聚合体的直径过大,使得营养物质及氧气不能到达细胞聚合物的中心[5],从而导致其中心的细胞死亡率增高;而且96孔的Perfecta3D Hanging Drop Plates每孔只能接种40~60 μL的培养基,不足以供给5×104~1×105/孔细胞充足养分。
流式细胞术检测间充质干细胞表面标记物结果显示,PDLSCs均阳性表达 CD29、CD44、CD90、CD105等间充质干细胞表面标记物,说明所获得的细胞为间充质来源,且具有克隆化生长和诱导分化的潜能[7]。PDLSCs经过3D培养后,仍表达以上标记物,虽然某些标记物如CD29、CD105的表达水平有所下降,但总体来说,其表达仍为阳性。这些间充质干细胞表面标记物阳性表达率下降可能是由于经过3D培养后,单个细胞体积变小,细胞表面积相对减少,从而影响检测的阳性率,且细胞间相互紧密三维排列而不是贴附于培养皿的表面,可能使表面标记物的表达产生轻微变化[8]。
Wang W等(2009)使用微基板3D培养人骨髓间充质干细胞时发现,3D培养的骨髓间充质干细胞矿化分化效率显著高于2D培养的骨髓间充质干细胞[9]。但目前尚未有对悬滴法3D培养的PDLSCs矿化分化影响的研究报道。本实验运用常规矿化诱导条件诱导悬滴法3D培养的PDLSCs细胞聚合物,从茜素红染色可见,矿化诱导7 d后,3D培养的PDLSCs细胞聚合物内有大量的矿化沉积物,其矿化结节形成数目显著高于常规贴壁培养(2D)的PDLSCs;荧光实时定量PCR检测结果显示,3D培养的PDLSCs经矿化诱导7 d后,其矿化相关基因ALP和OPN mRNA的表达水平均明显高于2D培养的PDLSCs(P<0.05)。以上结果表明,3D培养的PDLSCs的矿化分化能力要优于2D贴壁培养的 PDLSCs。这可能是因为3D培养的PDLSCs细胞排列更加紧密,并使细胞间的微环境发生改变,从而使干细胞表面膜分子间的一系列信号转导及细胞内的信号传导发生变化,而促进了PDLSC的分化[9-10]。Jing W 等(2010)研究发现,间充质干细胞矿化分化过程中notch通路的激活可以促进其矿化分化[11],而wnt信号通路也在骨的发生发展上起重要的作用[12]。因此,在以后实验中还需进一步探究notch信号通路和wnt信号通路在3D培养的PDLSCs上的改变。
综上所述,应用HangingDrop 96孔培养板3D培养的PDLSCs,当细胞接种数量为2.5×104/孔时,细胞聚合物中的细胞能保持较高的生存活性,并能显著促进其矿化分化的能力。提示,3D悬滴培养法是一种较理想的细胞培养方法。随着口腔组织工程研究的进一步深入,3D培养PDLSCs以大量获得种子细胞并且提高种子细胞的多向分化潜能将会是一项重要的研究,为实现完全性和功能性的牙周组织再生、为探索新型的牙周病治疗手段提供理论和实验依据。
[1]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cell from human Periodontalligament[J].lancet,2004,364(9429):149-155.
[2]Voytik-Harbin SL.Three-dimensional extracellular matrix substrates for cell culture[J].Methods Cell Bio,2001,63:561-581.
[3]Miranda SC,Silva GA,Hell RC,et al.Three-dimensional culture of rat BMMSCs in a porous chitosan-gelatin scaffold:A promising association for bone tissue engineering in oral reconstruction[J].Arch Oral Biol,2011,56(1):1-15.
[4]麻丹丹,高杰,吴补领.改良组织块酶消化法培养人龋损牙髓干细胞的实验研究[J].牙体牙髓牙周病学杂志,2011,21(7):371-374.
[5]Bartosh TJ,Ylöstalo JH,Mohammadipoor A,et al.Aggregation of human mesenchymal stromal cells(MSCs)into 3D spheroids enhances their antiinflammatory properties[J].Proc Natl Acad Sci U S A,2010,107(31):13724-13729.
[6]孟焕新.牙周病学[M].3版.北京:人民卫生出版社,2011:140-164.
[7]Lin NH,Menicanin D,Mrozik K,et al.Putative stem cells in regenerating human periodontium[J].J Periodontal Res,2008,43(5):514-523.
[8]Frith JE,Thomson B,Genever PG,et al.Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential[1].Tissue Eng Part C Methods,2010,16(4):735-749.
[9]Wang W,Itaka K,Ohba S,et al.3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cell[J].Biomaterials,2009,30(14):2705-2715.
[10]Kramer PR,Nares S,Kramer SF,et al.Mesenchymal stem cells acquire characteristic of cells in the periodontal ligament in vitro[J].J DENT Res,2004,83(1):27-34.
[11]Jing W,Xiong Z,Cai X,et al.Effects of gamma-secretase inhibition on the proliferation and vitamin D(3)induced osteogenesis in adipose derived stem cells[J].Biochem Biophys Res Commun,2010,(392):442-447.
[12]Wang S.Kawashirnab N,Sakamotoc K,et al.Osteogenic differentiation of mouse mesenchymal progenitor cell,Kusa-A1 is promoted by mammalian transcriptional repressor Rbpj[J].Biochem Biophys Res Commun,2010,400(I):39-45.
