稳转STAT6-RNAi细胞株的构建及功能鉴定
2014-09-19张玉山高国生
张玉山,高国生
(1.南阳市中心医院 感染科,河南 南阳 473000;2.宁波市感染病医院 肝病科,浙江 宁波 315000)
稳转STAT6-RNAi细胞株的构建及功能鉴定
张玉山1,高国生2
(1.南阳市中心医院 感染科,河南 南阳 473000;2.宁波市感染病医院 肝病科,浙江 宁波 315000)
目的 探讨RNAi慢病毒载体对HepG2稳转细胞株增殖、迁移的影响。方法 感染实验分为4组:空白对照组(未经处理的HepG2细胞),阴性对照组(只感染 pLVTHm空病毒),感染pLVTHm-STAT6-RNAi组,感染pLVTHm-STAT6-ORF组。运用病毒感染HepG2细胞获得稳定表达STAT6-ORF和STAT6-RNAi的细胞株,利用PCR和Western blot的方法检测稳定细胞株中STAT6的表达丰度。CCK-8法检测稳转细胞株的细胞活性及Transwell实验检测稳转细胞迁移能力变化。结果 通过TET的筛选,成功获得了STAT6-ORF以及STAT6-RNAi的HepG2稳定表达细胞株。与对照组细胞相比,过表达STAT6-ORF转染的细胞增殖快(F=4.279,P=0.021),迁移率高;而STAT6-RNAi转染后,细胞增殖缓慢,随培养时间延长及传代(HepG2传到第三代细胞绝大部分细胞已经死亡),细胞逐渐崩解、漂浮死亡,细胞活性显著降低(F=290.114,P<0.001),迁移能力显著下降。结论 成功构建STAT6-RNAi和STAT6-ORF稳定株,为后期建立动物模型,体内验证STAT6的生物学功能奠定了物质基础。
慢病毒包装;STAT6 RNAi干涉;感染;HepG2细胞
原发性肝癌(primary hepatic cancer,PHC)是一种原发于胆管细胞或肝细胞的癌症,是临床上最常见的恶性肿瘤之一,全球发病率居恶性肿瘤第五位。近年来,随着环境因素和社会因素的改变,肝癌的发病率也明显提高,而且患者年龄呈年轻化趋势。研究表明,肿瘤细胞及其周围免疫细胞分泌的炎性因子可激活炎症相关信号通路,诱导肿瘤免疫抑制微环境的形成,参与肝癌的发生、发展和转移的过程。本研究拟通过构建STAT6-RNAi和STAT6-ORF稳定株,探讨RNAi慢病毒载体对HepG2稳转细胞株增殖、迁移的影响,为后期建立动物模型,验证STAT6的生物学功能提供物质基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞株:人肝癌HepG2细胞株,由南方医科大学基因工程研究所提供。
1.1.2 主要试剂:PrimerScriptTMRT-PCR试剂盒、DL2000标准分子量、Taq DNA聚合酶、Trizol试剂为大连TaKaRa公司产品;DMEM培养液、胰酶,为美国GIBCO公司产品;胎牛血清,杭州四季清公司;CCK-8试剂,广州展辰生物公司;聚凝胺(polybrene),美国Sigma公司;二甲亚枫(DMSO),上海生工生物公司;聚偏二氟乙烯膜,美国Millipore公司;STAT6羊抗兔单克隆抗体,美国Epitomics公司;GAPDH羊抗鼠单克隆抗体,北京博奥森生物技术公司;彩虹Marker,加拿大Fermentas公司。BCA Protein Assay Reagent Kit(Pierce)。其他试剂均为超级纯。
1.1.3 实验仪器:DYY-6c电泳仪、蛋白转膜仪为北京六一仪器厂产品;流式细胞仪(Beckman Coulter,BD);荧光倒置显微镜(Leica);Biorack 750液氮罐(Statebourne);TDL-4ZA低速离心机;GZX-9146MBE电热恒温鼓风干燥箱(上海博迅实业有限公司医疗设备厂);Multifuge 1L-R高速冷冻离心机(Thermo)。
1.2 实验方法
1.2.1 筛选建立稳定过表达和干扰STAT6细胞株
①感染目的细胞:感染前1天,胰酶消化HepG2细胞并计数细胞密度,按照2×105个/孔细胞密度接种至6孔板,加入DMEM完全培养液,置于37℃、CO2体积分数为5%饱和湿度培养箱中培养;培养24 h,融合度达到30%~50%后,在含有病毒的培养液中加入聚凝胺(polybrene,美国Sigma公司产品,工作液浓度为6μg/m L),促进病毒感染细胞;感染实验分为4组:空白对照组(未经处理的HepG2细胞)、阴性对照组(只感染pLVTHm空病毒)、感染 pLVTHm-STAT6-RNAi组、感染 pLVTHm-STAT6-ORF组;吸去细胞中的培养液后,加入含有10倍稀释病毒量的完全培养液1mL/孔(稀释倍数从103到107);第2天吸去细胞中含有病毒的培养液,加入2mL新鲜的完全培养液,继续37℃、CO2体积分数为5%饱和湿度培养箱中过夜培养。
② 筛选HepG2细胞:HepG2细胞分别在0、5、10、50和100 μg/mL盐酸四环素(tetracycline,TET)情况下处理24 h后,采用CCK-8法测定细胞活性,以确定TET的半致死浓度;荧光显微镜下,通过载体报告子GFP检测感染效率,然后以TET的半致死浓度处理感染效率为50%以上的HepG2细胞数次;筛选出STAT6-ORF以及STAT6-RNAi的稳定表达HepG2细胞,并以1/2半致死量的TET维持培养。
③CCK-8检测细胞活性:按试剂盒说明进行操作。
1.2.2 STAT6表达检测
①RT-PCR检测:细胞按1×106密度接种于六孔板培养,经处理后去上清,每孔加入1m L Trizol,静置5min充分裂解(Trizol变粘稠)后吸到1.5 mL EP管中,或液氮速冻后-80℃保存备用;加Trizol1/5体积(200μL)的氯仿剧烈振荡,室温静置5min,4℃,12 000 g离心15 min;将上清移到新EP管,加等体积(500 μL)异丙醇混匀,室温静置10min,4℃,12 000 g离心10min;弃上清,500μL 75%乙醇洗涤;4℃,12 000 g离心2min,重复1次;空甩一次(常温12 000 g离心1min);超净台内把柱子盖打开吹1~2min,将柱子放到新的1.5mLEP管;加入10~40μLDEPC水(依材料多少而稀释),62℃2min,常温12 000 g离心1min,管内即为RNA。取1μL分光光度计(eppendorf,AG)检测纯度和浓度,1μL进行琼脂糖电泳检测其完整性,余下部分立即保存于-80℃超低温冰箱中,或立即用于反转录反应。
反转录反应根据Primer Script TMRT-PCR试剂盒步骤进行操作。
用于RT-PCR反应引物与条件如下:基因STAT6,检测长度880 bp,反应条件94℃,5 min;94℃,30 s,55℃,30 s,72℃,1 min,38 cycles;72℃,8min。基因GAPDH,检测长度385 bp,反应条件94℃,5 min;94℃,30 s,55℃,30 s,72℃,30 s,30 cycles;72℃,8min
② Western blot检测
a.总蛋白提取:将各组细胞用胰酶消化,预冷PBS缓冲液冲洗3次,将细胞置于冰上,放置30min,加裂解液100μL充分裂解细胞。收集混合液至1.5 m LEP管中,12 000 g,4℃离心20 min。收集上清液,-20℃保存备用。
b.蛋白定量:采用BCA Protein Assay Reagent Kit进行定量。将A液和B液(50∶1)混合,室温放置30min后,取200 L混合液加入至96孔板中,然后加入不同浓度的BSA标准品及待测样品10μL(1∶10稀释),空白孔中加入双蒸水10μL调零。37℃孵育30min后,多功能酶标仪测定在570 nm处的吸光度值(OD值),以标准品的OD值绘制成标准曲线,根据标准曲线计算蛋白浓度,以保证上样量一致。
c.蛋白电泳:按分子生物学试验指南制备分离胶和浓缩胶,经BCA蛋白定量检测后,待测蛋白的上样浓度为100μg/mL。根据目的蛋白分子量的大小,选择合适浓度的聚丙烯酞胺凝胶电泳。上层浓缩胶浓度为8%,下层分离胶浓度为3%。用上样Buffer稀释蛋白样品,100℃水浴煮沸30 min,冰上放置2 min。每泳道上样30μL蛋白样品,80 V恒压跑出浓缩胶,120 V恒压至溴酚兰刚好跑出分离胶。
d.G250染色判断蛋白样品质量:卸去胶板,将凝胶置于G250染色液中,室温染色2 h后,放入脱色液中脱色,并扫描电泳结果,从中选择能跑出条带完整清晰的样品(如图2),然后调整上样量(保证蛋白上样量一致)进行跑胶,转膜等后续实验。
e.半干式电转印迹:蛋白电泳结束后,取出凝胶,在转移缓冲液中浸泡30min。按凝胶的大小比例剪好PVDF膜,置于甲醇中浸泡15min;同时按同样大小比例裁剪干转的厚滤纸,置于转移缓冲液中浸润30min。按顺利放置厚滤纸,PVDF膜,凝胶,厚滤纸至半干槽中,并用玻棒赶去每层的气泡。盖好金属板,再加上阳极电极板进行转膜。转移条件:稳压8 V室温转27min(得到较多质量>72KD的蛋白),或8 V稳压17min(得到较多质量<72KD的蛋白),或者稳压8 V室温转23min。
f.免疫染色:取出转移后的PVDF膜,用1×TBST润湿后,置于5%脱脂奶粉,37℃封闭1 h;
用抗体buffer稀释一抗(1∶500),置于杂交袋与PVDF膜进行一抗反应,4℃封闭过夜;取出PVDF膜,1×TBST洗涤,5 min,3次;PVDF膜与生物素化的二抗反应(二抗用抗体buffer稀释5 000倍),37℃杂交1.5 h;1×TBST洗涤PVDF膜,10min,2次;辣根过氧化物酶-ECL法进行检测。
g.显影定影:按照Pierce公司ECL发光检测试剂盒说明书操作,将PVDF膜平铺于保鲜膜上,吸取适量ECL显色液滴加于膜上,吸去显色液,迅速用保鲜膜将膜包好后置于暗匣内,暗房内进行压片,避光37℃反应30min。胶片进行显影和定影后,扫描记录。
1.2.3 CCK-8法检测HepG2细胞的增殖能力:实验分为4组:空白对照组(未经处理的 HepG2细胞)、阴性对照组(只感染pLVTHm空病毒)、感染 pLVTHm-STAT6-RNAi组、感染pLVTHm-STAT6-ORF组。将不同组HepG2细胞接种于96孔板(100μL/孔),置于37℃、CO2体积分数为5%饱和湿度培养箱中培养,光学显微镜下观察并记录细胞的形态。分别于24、48、72和96 h后(细胞培养24 h左右进行传代),加入10μL/孔的CCK-8溶液,操作时注意不要孔中生成气泡,因为气泡会折光影响OD值。
按CCK-8试剂盒说明书提供的方法检测细胞增殖活性,将培养板置于37℃、CO2体积分数为5%饱和湿度培养箱中孵育1.5 h,多功能酶标仪测定波长在450 nm处的吸光度值(OD值),以此反映细胞增殖活性。
1.2.4 Transwell实验检测HepG2细胞的迁移能力:实验分为4组:空白对照组(未经处理的HepG2细胞)、阴性对照组(只感染 pLVTHm空病毒)、感染 pLVTHm-STAT6-RNAi组、感染pLVTHm-STAT6-ORF组。在 Transwell上室的聚碳酸酯膜(polycarbonate membrane,PC,直径6.5 mm)上,加入稀释后的Matrigel(3.9μg/μL)60~80μL,37℃反应30min使 Matrigel聚合成凝胶。在Transwell下室中加入DMEM完全培养液600μL。用无血清培养液将待检细胞制成单细胞悬液,每组细胞设3孔。在上室孔中准确加入细胞1×105个/孔,每孔100~200μL,置于37℃、CO2体积分数为5%饱和湿度培养箱培养箱中培养0、24、48和72 h后。弃去上室液体,小心取出上室,用湿棉签轻轻拭去膜上面未穿过膜的细胞。丽春红染色30min,多余染液冲洗干净后将膜双侧封固,80℃烤干。倒置显微镜(250倍)下直接计数穿膜细胞数。
2 结果
2.1 总RNA浓度和纯度鉴定结果 各组细胞总RNA浓度和纯度测定结果见表1。电泳结果见图1。28s和18s条带完整,可以进行反转录反应。

表1 各组细胞总RNA浓度和纯度测定Tab.1 Each cell concentration and total RNA purity determination
图1 各组总RNA电泳图Fig.1 Total RNA electrophoresis results in each group
2.2 RT-PCR和Western Blot检测STAT6的表达 RT-PCR结果显示:STAT6-RNAi细胞中未检测到 STAT6(见图 2)。Western Blot结果显示:STAT6-RNAi细胞中STAT6表达明显下调(见图3)。说明STAT6-RNAi转染成功。
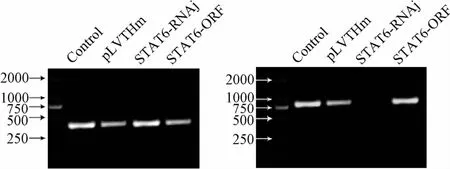
图2 RT-PCR检测慢病毒感染后HepG2细胞中STAT6的表达Fig.2 Rt-PCR reaults of STAT6 expression in HepG2 cells after infected with slow virus

图3 Western Blot检测慢病毒感染后HepG2细胞中STAT6的表达Fig.3 Western Blot results of STAT6 expression in HepG2 cells after infected with slow virus
2.3 CCK-8法检测HepG2细胞增殖 光学显微镜下观察细胞表型的改变,STAT6基因被干扰后,细胞逐渐崩解、漂浮死亡(见图4);而过表达STAT6的HepG2细胞增殖加快,从第2代开始,细胞的增殖速度明显提高。CCK-8检测结果显示,转染STAT6-RNAi的HepG2细胞活性从第2代开始下降,第3代和第4代均显著低于第1代(F=102.984,P<0.001,)。而过表达STAT6-ORF的HepG2细胞活性均显著性升高(F=20.609,P<0.001,见图 5)。

图4 STAT6-ORF和STAT6-RNAi对慢病毒感染HepG2细胞形态的影响Fig.5 Effects of STAT6-ORF and STAT6-RNAi on celluar morophology of HepG2 cell
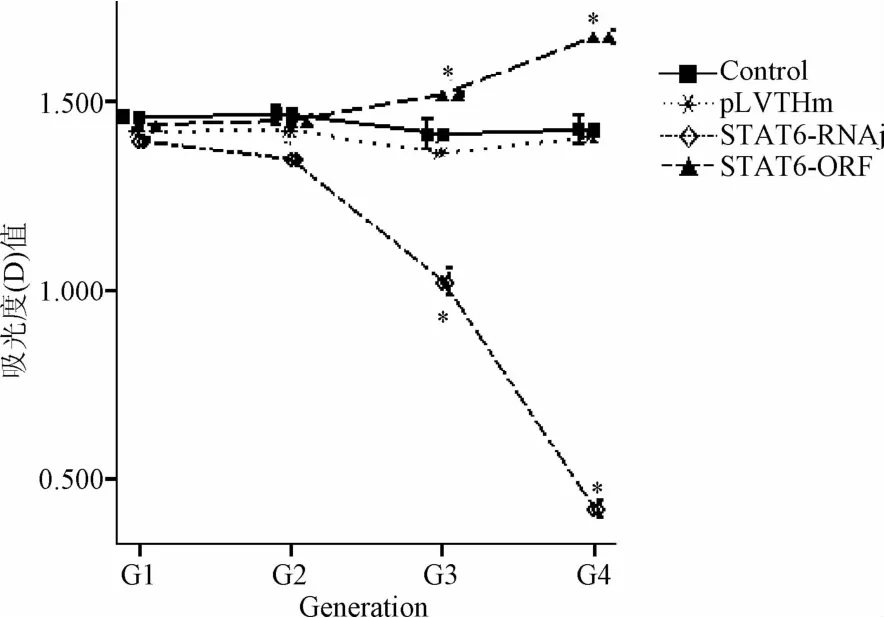
图5 STAT6-ORF和STAT6-RNAi对慢病毒感染HepG2细胞增殖活性的影响Fig.5 Effect of STAT6-ORF and STAT6-RNAion HepG2 cell proliferation after infected with slow virus
2.4 Transwell实验检测HepG2细胞的迁移能力 正常培养的HepG2细胞具有显著的迁移能力;而STAT6-RNAi转染后,细胞迁移能力显著下降(F=136.660,P<0.01);当过表达STAT6-ORF后,细胞迁移能力显著提高(F=576.219,P<0.01,见图6)。

图6 STAT6-ORF和STAT6-RNAi对慢病毒感染HepG2细胞迁移的影响Fig.6 STAT6-ORF and STAT6-RNAieffects on HepG2 cellmigration slow virus infection
3 讨论
近年来,STAT6信号通路越来越受到关注,研究表明,IL-4/STAT6信号转导对肿瘤的发生、发展有重要影响。为了深入探讨STAT6基因在肝癌细胞中的生物学功能,本研究对其进行RNA干扰和过表达实验,构建细胞模型,采用慢病毒三质粒系统感染肝癌HepG2细胞,通过TET筛选出能够稳定干扰和过表达STAT6的HepG2细胞株,进行CCK-8细胞活性实验,检测分别下调和上调STAT6的表达对HepG2细胞的增殖影响。结果发现,STAT6被干扰后,细胞增殖减慢,随着培养时间延长及传代,与感染第1代(病毒感染细胞0 h的细胞活性)比较,细胞活性从第2代开始下降,第3代和第4代均显著低于第1代(F=102.984,P<0.001),当HepG2细胞传至第3代时,绝大部分细胞已经死亡,细胞逐渐崩解、漂浮死亡;而过表达STAT6的HepG2细胞增殖加快,从第2代开始,细胞的增殖速度明显提高,细胞活性均显著性升高(F=20.609,P<0.001)。实验表明,STAT6的表达异常影响肝癌细胞的增殖能力。同时,结果表明,正常培养的HepG2细胞具有较强的迁移能力;而干扰STAT6表达后,穿过Transwell上室PC膜的细胞数量明显减少,细胞的迁移能力显著性下降(F=136.660,P<0.01);当过表达STAT6后,细胞的迁移能力显著提高(F=576.219,P<0.01),表明STAT6表达对肝癌细胞的迁移能力有重要影响。综上所述,本文通过干扰和过表达STAT6,证实了该基因在肝癌细胞中的生物学功能,直接影响肝癌的发生、发展。本研究中构建的STAT6-RNAi和STAT6-ORF稳定株,方便于后期建立动物模型,进行裸鼠成瘤实验,体内验证STAT6的生物学功能,证实该基因的临床意义。在此基础上,便于进一步研究STAT6促进肝癌细胞增殖及迁移的分子机制。
[1] Schindler C,Darnell JE Jr.Transcriptional responses to polypeptide ligands:the JAK-STAT pathway[J].Annu Rev Biochem,1995,64(5):621-651.
[2] Hebenstreit D,Wirnsberger G,H orejs-Hoeck J, et al.Signaling mechanisms,interaction partners, and target genes of STAT 6 [ J].Cytokine Growth Factor Rev,2006,17(3):173-188.
[3] Yum iko K,Hyun JL,James AJ,et al.A conditionally active form of STAT6 canmimic certain effectsof IL-4[J].Immunol,1998,161(4):1074-1077.
[4] Bowman T,Garcia R,Turkson J,et al.STATs in on cogenesis[J].Oncogene,2000,19(21):2474-24881.
[5] Huang H,PaulWE.Protein tyrosine phosphatase activity is required for IL-4 induction of IL-4 receptor A-chain [ J].J Immunol,2000,164(3):1211-1215.
[6] 盛青,何建猷,梁标.STAT6与支气管哮喘1国外医学呼吸系统分册,2004,24(1):12-141.
[7] Imada K,Leonard WJ.The Jak-STAT pathway[J].Mol Immunol,2000,37(7):1-11.
[8] Leonard W J.Role of Jak kinases and STATs in cytokine signal transduction[J].Int JH ematol,2001,73(12):271-277.
[9] Levings MK,Schrader JW.IL-4 inhibits the production of TNF-alpha and IL-12 by STAT6-dependen t and independentmechanisms[J].J Immunol,1999,162(14):5224.
[10] ZhangWJ,Walter AK,Jennifer L, et al.Human B lymphoblast cell lines defective of Stat6 signaling produce high levels of proo inflammatory cytokines IL-12,TNF-A and IFN-C[J].Int JOncology,2004,24(11):447-453.
[11] 邓继先,沈伟.用慢病毒载体制备转基因动物的研究进展[J].中国生物工程杂志,2004,24(9):16-19.
[12] Zhang B,Liu XX,He JR,et al.Pathologically decreased miR-26a antagonizes apoptosis and facilitates carcinogenesis by targeting MTDH and EZH2 in breast cancer[J].Carcinogenesis,2011,32(1):2-9.
[13] 汤海涛,安春丽.慢病毒载体的构建及其在基因治疗方面的应用[J].亚太传统医学,2009,5(2):142-144.
[14] Booz GW,Day JN,Baker KM.Interplay between the cardiacren in angiotens in system and JAK-STAT signaling:role in cardiac hypertrophy,ischemia/reperfusion dysfunction, and heart failure[J].JMol Cell Cardio,2002,34(11):1443-1453.
[15] Bolli R,Dawn B, Xuan YT.Role of the JAK-STAT pathway in protection againstmyocardial ischemia/reperfusion in jury[J].Trends Card iovasc Med,2003,13(2):72-79.
[16] L in Q,Lai R,C h irieac LR,et al.Constitutive activation of JAK3/STAT3 in colon carcinom atumors and cell lines:inhibition of JAK3/STAT3 signaling induces apoptos is and cell cycle arrest of colon carcinom a cells[J].Am JPatho,2005,167(4):969-980.
(编校:吴茜)
Construction of stably transfected STATb-RNAi in HepG2 and identification of its function
ZHANG Yu-shan1,GAO Guo-sheng2
(1.Department of Infection,Nanyang Central Hospital,Nanyang 473000,China;2.Departmen of Liver Infectious,Ningbo Disease hospital,Ningbo 315000,China)
Objective To explore the effect of RNAi lentivirus vector on stability HepG2 cell proliferation,migration.Methods The virus infected the HepG2 cells stablywere divided into four groups:controlgroup(untreatment),negative controlgroup(infected with PLV-control vector),pLVTHm-STAT6-RNAi group,and pLVTHm-STAT6-ORF goup.Expressing STAT6-ORF and STAT6-RNAi cell lines stably were obtained,and the STAT6 expression were detected by PCR and Western blot.CCK-8 assay and Transwell assay were used to detect the stably transfected cell lines activity and cell migration ability changes.Results The STAT6-ORF and STAT6-RNAi HepG2 stable expression cell line were obtained successfully by TET screening.Compared with control cells,cell proliferation in STAT6-ORF overexpression group were fast(F=4.279,P=0.021),and had high mobility;and in STAT6-RNAi group,the cell proliferated slowly,with the culture time prolonged and passage to the cells of the third generation(HepG2 most cells have died),the cells gradually disintegrated,floating die,cell activity decreased significantly(F=290.114,P<0.001),transfer capacity decreased significantly.Conclusion The STAT6-ORF and STAT6-RNAi HepG2 stable expression cell line were obtained successfully,is convenient to establish the animalmodel of late,tumor formation in nudemice,biological functions in vivo validation of STAT6,confirme the clinical significance of the gene.
lentiviral package;STAT6 RNA;interference transfection;HepG2 cells
R36.1
A
1005-1678(2014)06-0051-05
2011年浙江省医药卫生计划(2011KYB107)
张玉山,本科,副主任医师,研究方向:感染性疾病及肝脏病的临床研究,E-mail: zhang66286@163.com。
