PKC-ε、cIAP在CD44介导的髓系白血病细胞转移和增殖中的作用及可能机制
2014-09-19毕作木崔春萍孙桂珍徐冬周其锋
毕作木,崔春萍,孙桂珍,徐冬,周其锋
(1.潍坊医学院附属淄博市第一医院 血液科,山东 淄博 255200;2.中国人民解放军军事医学科学院放射与辐射医学研究所 血液学研究室,北京 100039;3.淄博市沂源县人民医院,山东 淄博 255200)
PKC-ε、cIAP在CD44介导的髓系白血病细胞转移和增殖中的作用及可能机制
毕作木1,崔春萍2Δ,孙桂珍3,徐冬1,周其锋1
(1.潍坊医学院附属淄博市第一医院 血液科,山东 淄博 255200;2.中国人民解放军军事医学科学院放射与辐射医学研究所 血液学研究室,北京 100039;3.淄博市沂源县人民医院,山东 淄博 255200)
目的 探讨PKC-ε在调节cIAP、CD44及P-gp介导的髓系白血病细胞转移、增殖及耐药中的作用及可能机制。方法采用MTT法检测白血病细胞亲本株及耐药株K562、K562R、HL60和HL60R的耐药特性;Western blot和免疫组化检测各细胞株中PKC-ε表达水平;免疫荧光和流式细胞术检测各细胞株CD44表达;软琼脂克隆形成实验检测细胞株增殖能力;免疫荧光检测PKC-ε与P-gp、cIAP和CD44共定位。结果 髓系白血病耐药株较亲本细胞株高表达PKC-ε,采用化疗药物处理可上调亲本株PKC-ε的表达。通过添加PKC激动剂或抑制剂证实:髓系白血病细胞的转移及耐药与PKC-ε的高表达有关,增殖与PKC-ε的低表达有关。细胞及转移灶中,cIAP及P-gp的表达与PKC-ε的表达变化一致,CD44的表达与PKC-ε的表达变化相反。免疫荧光结果显示PKC-ε与P-gp、cIAP及CD44分别共定位于髓系白血病细胞膜上。结论 PKC-ε通过调节P-gp和cIAP介导白血病细胞转移,同时参与调节CD44介导的白血病细胞增殖。
PKC-ε;cIAP;髓系白血病细胞;增殖;转移
蛋白激酶C(protein kinase C,PKC)参与肿瘤的耐药、转移及 增殖等各个过程[1-6]。PKC-ε是蛋白激酶C家族成员,有研究显示其能调节细胞增殖、增强细胞抗凋亡能力、改变细胞骨架结构等。在不同种类的肿瘤中,PKC-ε的表达水平与肿瘤的发生发展密切相关,其表达水平高低提示了肿瘤的预后情况[7-8]。研究证实:在鳞状细胞癌及某些其他类型的肿瘤中,PKC-ε是介导肿瘤细胞转移的重要因素。有报道表明:PKC-ε在乳腺癌细胞中通过上调cIAP的表达以增强肿瘤细胞抵抗凋亡的能力,同时还能上调P-糖蛋白(P-glycoprotein,P-gp)的表达增强肿瘤细胞的耐药性[9]。在研究肿瘤增殖特性方面,有报道显示PKC-ε可通过与CD44相互作用,调节上皮细胞的增殖及分化能力,并调节乳腺癌细胞的抗凋亡能力及抗药性[7]。目前尚无PKC-ε参与调节髓系白血病细胞耐药、增殖及转移方面的报道。本文通过研究髓系白血病细胞亲本株K562和 HL60及其耐药株K562R和HL60R的体内外的增殖情况,以PKC-ε为靶点,探讨白血病细胞转移及增殖的分子机制,以期为白血病的治疗打开新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞系与动物:人急性髓系白血病细胞系HL-60、人慢性髓系白血病急性期细胞系K562购自ATCC(美国典型培养生物典藏中心)。髓系白血病细胞系耐药株K562R、髓系白血病细胞系耐药株HL60R购自天津中国医学科学院血液病研究所。SCID小鼠,雄性,4~5周龄,购自河南大学ABSL-3动物实验中心,并饲养于无特异性抗原的SPF动物房中。
1.1.2 试剂及抗体:Doxorubicin、Vincristine购自Merck公司。RPMI 1640培养液及新生牛血清均购自 Gibco公司。Annexin V/PI凋亡检测试剂盒购自晶美公司。Mitocapture线粒体膜电位检测试剂盒购自Biovision公司。兔抗人cIAP多克隆抗体购自Abcam公司。鼠抗人P-gp、β-actin单克隆抗体均购自Santa Cruz公司。SP法免疫组化试剂盒购自迈新生物技术公司。HRP标记羊抗兔、羊抗鼠多克隆抗体均购自 Biosharp公司。Transwell小室购自Costar公司。DAB显色剂购自eBiosource公司。FITC标记鼠抗人CD44单克隆抗体,FITC标记兔抗鼠、羊抗兔二抗,PE标记羊抗兔二抗均购自Biolegend公司,鼠抗人βactin单克隆抗体购自Santa Cruz公司。DAPI购自Sigma公司。Staurosporine(PKC抑制剂),PKC激动剂(Staurosporine)均购自圣克鲁斯生物技术公司。
1.1.3 主要实验仪器:倒置荧光显微镜(IX71-F22FL/PH,Olympus公司),Nu-4850水套式二氧化碳培养箱(NuAire公司),TE2000倒置光学显微镜(Nikon公司),YS100正置光学显微镜(Nikon公司),Nu-6382E-85℃超低温冰箱(NuAire公司),BCD-176C3-20℃低温冰箱(Haier公司)。
磁力搅拌器、掌式离心机、血细胞分类计数器、恒温水浴箱、水套式恒温培养箱、高温干燥箱、脱色摇床、微量及少量电子秤等均为国产。
1.2 方法
1.2.1 溶液配置
① Tris-乙酸缓冲液(TAE):工作液(l×):40 mmol Tris-乙酸:1mmol EDTA;储存液 Tris-乙酸2 mol/L(50×):24.2 g Tris base,57.1mL冰醋酸,100mL 0.5mol/L EDTA(pH 8.0)。
②Tris-甘氨酸缓冲液(5×):15.19 Tris碱,94 g甘氨酸,50mL 10%SDS溶液(避光保存)。
③RIPA(Radio Immuno Precipitation Assay)裂解液:150 mM氯化钠溶液,1.0%NP-40 or Triton X-100,0.5%脱氧鹅胆酸,0.1%SDS(十二硫基磺酸钠),50mM Tris,pH 8.0。
1.2.2 药物敏感性实验:采用MTT法检测白血病细胞亲本 及耐药株K562、K562R、HL60和HL60R的耐药特性,计算相对 于亲本细胞株之耐药指数,达到耐药细胞实验标准即可进行后 续实验。
1.2.3 PKC-ε表达水平的检测:分别采用Western blot和免疫组化检测细胞株PKC-ε表达水平。后者具体步骤如 下:68℃烤片20 min;常规二甲苯脱蜡,梯度酒精脱水;二甲 苯I20min、二甲苯II20min、100%酒精10min、100%酒精10 m in、95%酒精5 m in、80%酒精 5 m in、70%酒精 5 m in;阻断灭 活内源性过氧化物酶:3%H2O237℃孵育10 min,PBS冲洗3×5min;抗原修复:置0.01 M枸橼酸缓冲液(pH 6.0)中用 煮沸(95℃,40 min),自然冷却20 min,PBS冲洗3×5 min。 正常羊血清工作液封闭,37℃15 m in。滴加一抗4℃冰箱孵 育过夜,PBS冲洗3×5min(用PBS缓冲液代替一抗作阴性对 照);滴加生物素标记二抗,37℃孵育30 min,PBS冲洗3×5 m in;滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃ 孵育30min,PBS冲洗3×5 min;DAB/H2O2反应染色,自来水 充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。结果 判定:高倍镜下(×400)对每张切片随机选择5个视野,每个 视野计数200个细胞,共计1000个,计算每张切片显色棕黄 色颗粒的阳性细胞百分率,切片中阳性细胞数<1%为阴性 片,阳性细胞数≥1%阳性片。并使用Image Pro Plus软件分 析平均光密度。放大倍数:400倍。一抗稀释倍数1∶100。
1.2.4 细胞株CD44表达检测:免疫荧光检测PKC激动或 抑制剂作用后细胞株CD44的表达。抗体浓度:FITC标记的CD44抗体(1∶500)。放大倍数:200倍。流式细胞术检测PKC激动或抑制剂作用后各细胞株CD44的表达,使用Flowjo 7.6.1软件分析PKC激动剂及抑制剂作用前后CD44分子平均荧光强 度的变化。
1.2.5 细胞株增殖能力检测:采用软琼脂克隆形成实验检 测PKC激动或抑制剂作用后细胞株增殖能力,收集细胞前,分别 使用PKC激动剂及抑制剂处理白血病细胞亲本株及耐药株30min,以DMSO处理组为对照。
1.2.6 PKC-ε与P-gp、cIAP和CD44共定位:采用免疫荧光 法检测PKC-ε与P-gp、cIAP、CD44的相互关系。收集细胞并使 用PBS洗一遍后细胞涂片,风干,4%PFA于25℃固定30min;PBS漂洗,5min×3次,1%BSA室温孵育30min;加入一抗FITC CD44抗体(1∶200),4℃孵育8 h;PBS漂洗,5min×3次;DAPI复染细胞核;无荧光甘油封片剂封片;荧光显微镜下观察照相,FITC激发波长为488 nm,阴性对照组以PBS代替一抗。放大倍数:200倍。
1.2.7 Transwell实验检测敏感株及耐药株的迁移能力:实验步骤如下:①制备细胞悬液。细胞血清饥饿24 h,后550×g离心5min收集细胞,PBS洗2遍,以含BSA的无血清培养基重悬。调整细胞密度至5×105/mL。②接种细胞。取细胞悬液100μL加入Transwell小室(孔径8μm)。24孔板下室加入600μL含20%FBS的培养基。③培养细胞:常规培养12 h和24 h。④结果统计:直接计数法,在镜下(100倍)计数下室中的白血病细胞数目。
1.3 统计学方法 应用SPSS16.0分析数据,正态计量资料以“±s”表示,组间比较进行t检验,计数资料组间用χ2检验,以P<0.05差异有统计学意义。
2 结果
2.1 白血病细胞亲本及耐药株的抗药性 MTT结果表明:K562R耐药指数为28,HL60R耐药指数100,达到耐药细胞实验标准,可用于下一步实验。
2.2 白血病细胞亲本及耐药株PKC-ε表达水平检测Western blot结果显示:耐药细胞株K562R及HL60R高表达PKC-ε,亲本细胞株K562及HL60低水平表达PKC-ε,2者比较差异有统计学意义(P<0.01)。采用化疗药物DOX处理亲本细胞株24h后,PKC-ε表达水平均显著上调(P<0.05)。提示PKC-ε可能参与白血病细胞耐药性的形成。
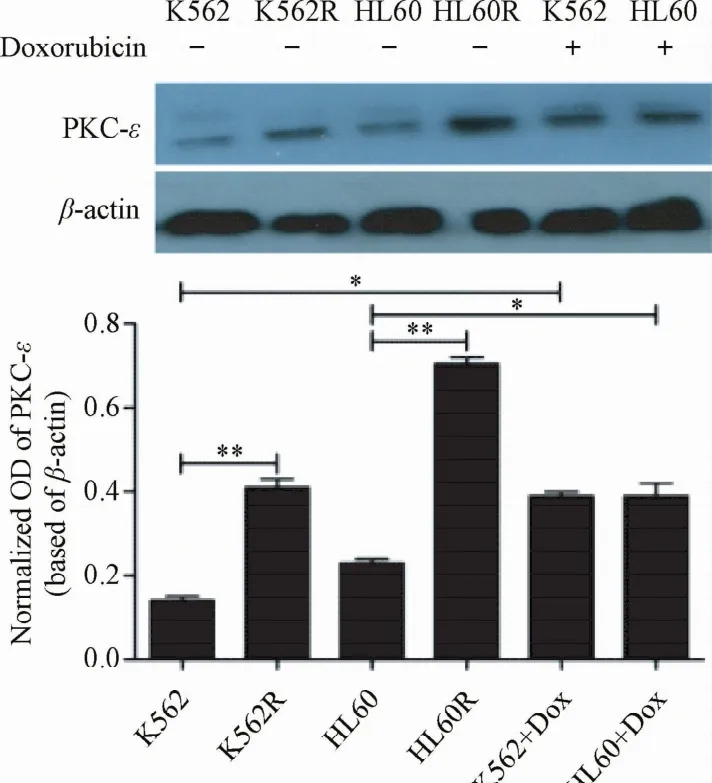
图1 耐药株及亲本株PKC-ε表达水平比较Fig.1 Comparison of PKC-εexpression in resistant strains and parents strains
2.3 PKC-ε与白血病细胞转移的研究
2.3.1 白血病细胞转移灶中PKC-ε表达水平比较:免疫组化结果显示:在脾脏、骨髓、肺脏及肝脏中,耐药株 K562R和HL60R组转移灶PKC-ε表达水平明显高于亲本株K562和HL60组(P<0.001),耐药组转移灶中PKC-ε表达平均光密度高于亲本组。正常对照组未检测出人PKC-ε的表达(见图2)。
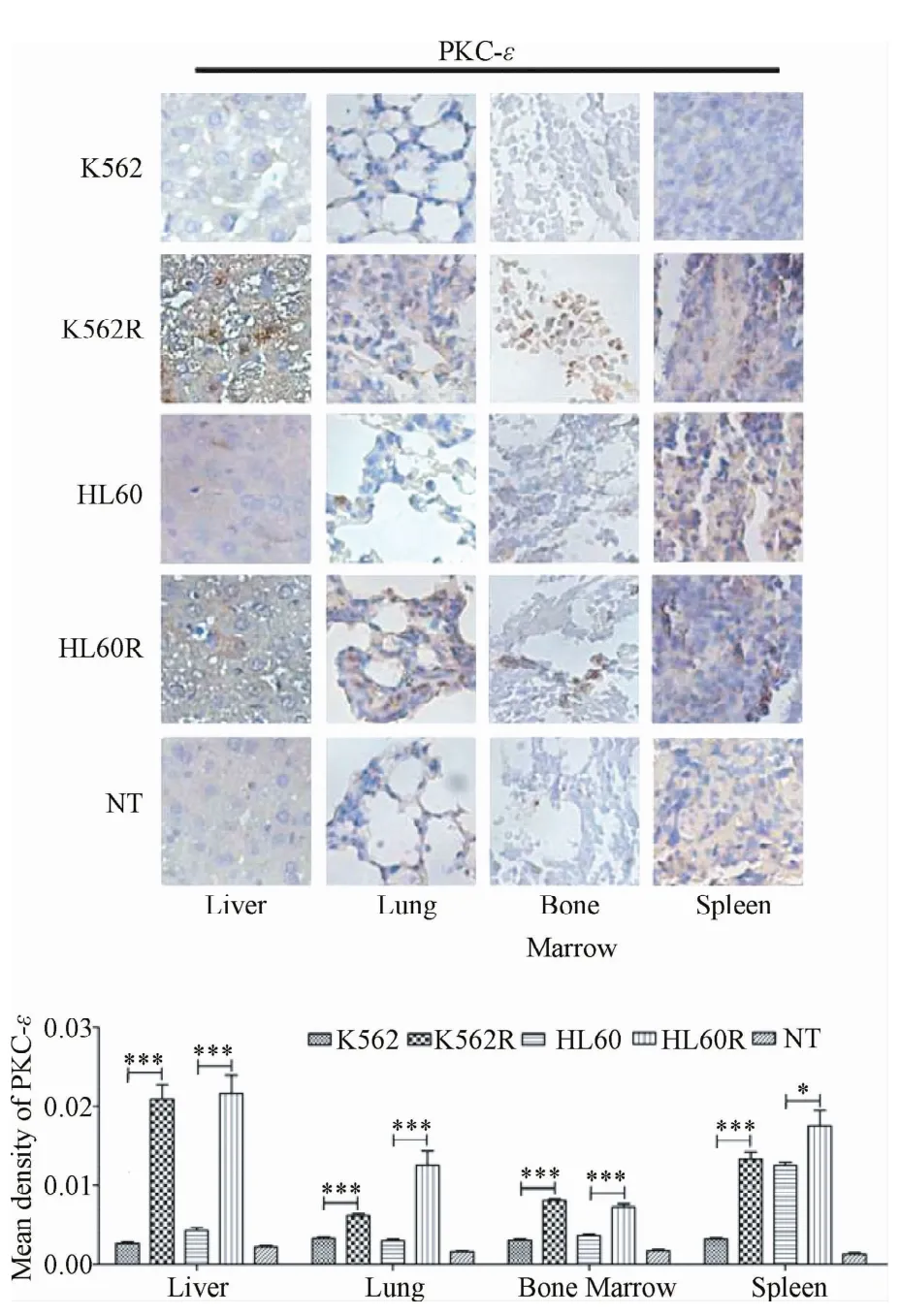
图2 器官转移灶中PKC-ε表达水平比较(×400)Fig.2 Comparison of PKC-ε expression in organ metastases( ×400)
2.3.2 PKC激动剂对白血病亲本株转移能力的影响:使用PKC激动剂PMA处理亲本细胞K562及HL60后,白血病细胞的迁移能力明显增强(P<0.05);而使用PKC抑制剂十字孢碱(staurosporine,SP)处理上述2株细胞系后,肿瘤细胞的迁移能力稍降低,但无统计学差异。同样的,PKC激动剂处理耐药细胞K562R及HL60R后,白血病细胞的迁移能力无明显改变,而使用PKC抑制剂处理上述2株细胞系后,肿瘤细胞的迁移能力明显降低(P<0.05,见图3)。

图3 PKC激动剂或抑制剂处理24 h对细胞迁移能力的影响Fig.3 Effect of PKC agonist or inhibitors treatment for 24h on cellmigration ability
2.4 PKC-ε与白血病细胞增殖的研究
2.4.1 免疫荧光检测PKC激动剂或抑制剂对白血病亲本株CD44表达的影响:免疫荧光结果显示:使用PKC激动剂PMA处理白血病细胞30 min后,亲本细胞的CD44表达水平明显下降,而耐药细胞株CD44表达水平基本维持不变;使用广谱激酶抑制剂Staurosporine处理白血病细胞30 min后,耐药细胞的CD44表达水平明显上调而亲本株CD44表达水平基本维持不变(见图4)。
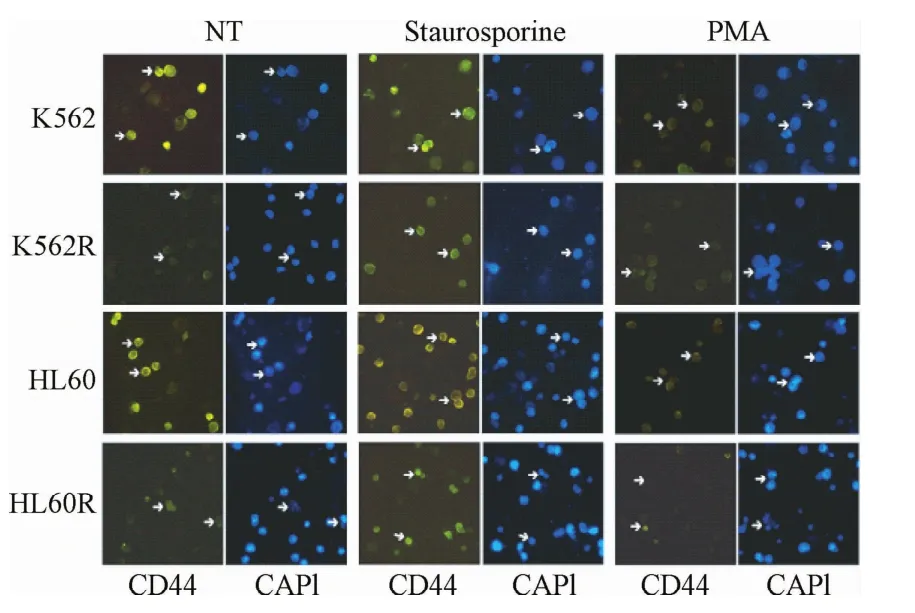
图4 PKC激动剂及抑制剂处理对细胞株CD44表达的影响Fig.4 Effect of PKC agonist or inhibitors treatment on CD44 expression
2.4.2 流式细胞术检测PKC激动剂或抑制剂对白血病细胞亲本株CD44表达的影响:流式结果显示:使用PMA处理白血病细胞30 min后,亲本细胞株CD44表达水平明显下降(P<0.05);使用Staurosporine处理白血病细胞30min后,耐药细胞株CD44表达水平明显上调(P<0.05)。与免疫荧光结果一致,提示髓系白血病细胞株中PKC-ε参与调节CD44的表达(见图5)。

图5 PKC激动剂或抑制剂处理对CD44表达的影响Fig.5 Effect of PKC agonist or inhibitors treatment on CD44 expression
2.4.3 PKC激动剂或抑制剂对白血病细胞耐药株增殖能力的影响:软琼脂克隆形成实验结果表明:使用PMA预处理细胞30min后,亲本细胞克隆形成能力明显下降(P<0.05),而耐药细胞株克隆细胞数基本维持不变;使用Staurosporine处理白血病细胞30min后,耐药细胞株的细胞克隆形成数明显增多(P<0.05),而亲本株克隆形成数基本维持不变。表明PKC-ε可能通过调控CD44表达介导髓系白血病细胞的增殖(见图6)。

图6 PKC激动剂或抑制剂处理对白血病细胞增值的影响Fig.6 Effect of PKC agonist or inhibitor treatment on leukemia cell clones forming
2.5 PKC-ε与白血病细胞耐药、转移及增殖之间的关系研究
2.5.1 PKC-ε与P-gp共定位检测:细胞免疫荧光结果显示:在亲本细胞及耐药细胞株中,PKC-ε与P-gp分子共定位于细胞膜,并且耐药细胞株高表达PKC-ε和P-gp,亲本细胞株低表达PKC-ε和P-gp。提示PKC-ε与P-gp之间存在联系,PKC-ε可能参与调节P-gp所介导的髓系白血病细胞耐药过程。
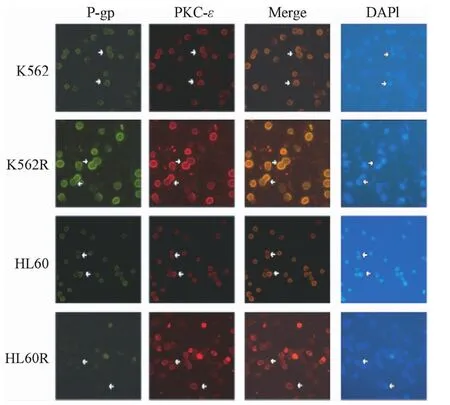
图7 免疫荧光法检测PKC-ε与P-gp的表达定位情况(×200)Fig.7 Immunofluorescence test results of PKC-εand P-gp co-localization(×200)
2.5.2 P-gp在小鼠转移灶部位的表达:免疫组化结果显示:2耐药株组转移灶中P-gp表达水平较亲本株组更高(P<0.05,见图8),提示P-gp与PKC-ε的表达变化一致,PKC-ε可能通过P-gp介导髓系白血病细胞的转移。
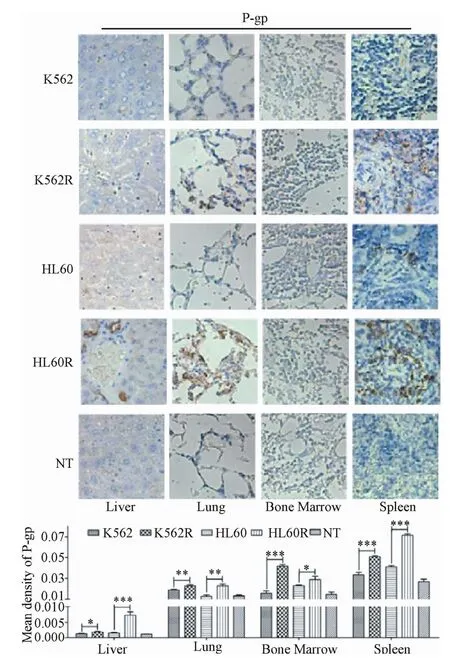
图8 P-gp在转移灶部位表达结果(×400)Fig.8 P-gp expression in organ metastases(×400)
2.5.3 PKC-ε与cIAP共定位对白血病细胞转移能力的影响:双标免疫荧光检测结果显示:PKC-ε与cIAP分子共定位于细胞膜,且PKC-ε的表达与cIAP的表达变化一致,提示PKC-ε可能通过调节cIAP介导髓系白血病细胞转移(见图9)。
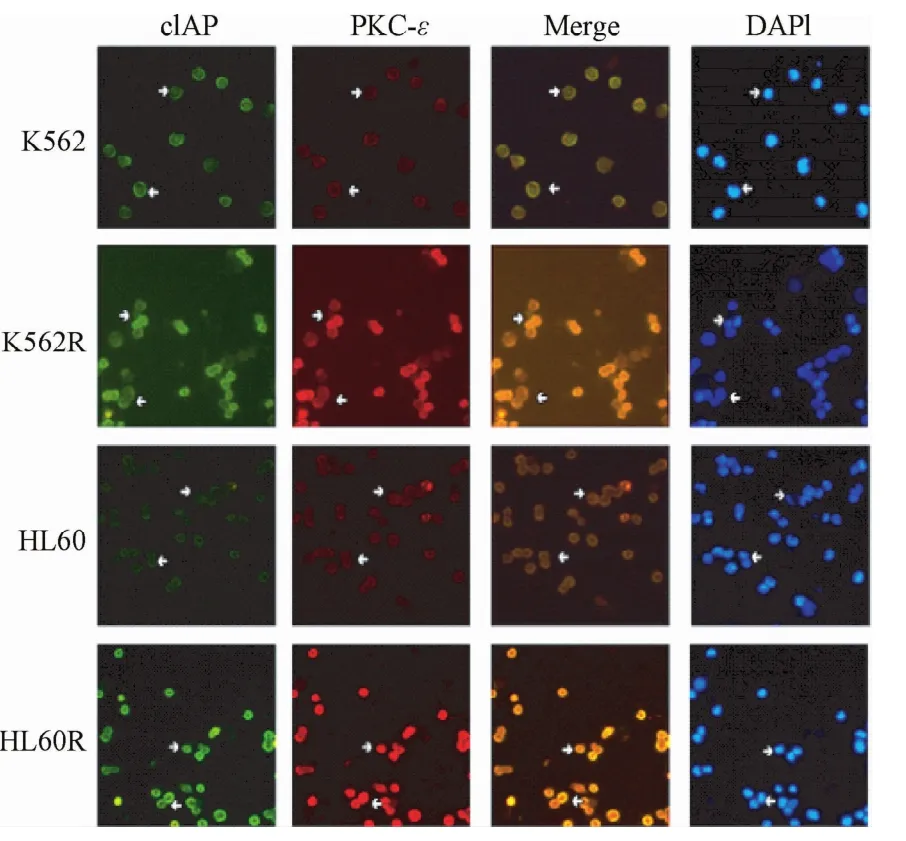
图9 PKC-ε与cIAP分子共定位结果(×200)Fig.9 Co-localization of PKC-εand cIAPmolecular( ×200)
2.5.4 PKC-ε与CD44共定位对白血病细胞增殖能力的影响:免疫荧光结果显示:PKC-ε与CD44分子共定位于与细胞膜,且PKC-ε的表达与CD44的表达变化相反,提示PKC-ε可能通过调节CD44介导髓系白血病细胞增殖(见图10)。
3 讨论
本研究发现:白血病耐药细胞株高表达PKC-ε,并且化疗药物多柔比星短期处理(24 h)可以诱导亲本细胞株中PKC-ε表达水平上调;同时,P-gp蛋白表达水平与PKC-ε表达水平一致,且PKC-ε与P-gp共定位于细胞膜上,提示白血病细胞可能通过PKC-ε调节P-gp的表达从而介导肿瘤细胞的耐药性。此结果与Bourbuignon等[10]报道PKC-ε通过上调乳腺癌肿瘤细胞cIAP及P-gp的表达介导肿瘤细胞耐药的结果一致。此外,cIAP在耐药细胞株中表达水平上调,提示其参与肿瘤细胞耐药性的形成。以上结果提示,PKC-ε参与介导白血病细胞株体内外侵袭转移能力的调节,且白血病细胞侵袭转移能力与PKC-ε蛋白表达变化相反。免疫荧光及流式细胞术结果表明:髓系白血病细胞株CD44的表达受PKC-ε的调节,添加激动剂可下调亲本株CD44表达水平,而抑制剂上调耐药株CD44的表达。软琼脂克隆形成实验证明:添加激动剂能下调亲本株增殖能力,而抑制剂上调耐药株增殖能力。以上结果表明:PKC-ε参与调节髓系白血病细胞的增殖,且增殖能力与PKC-ε表达水平呈负相关系。免疫荧光及免疫组化结果说明:PKC-ε与P-gp共定位于细胞膜,且P-gp高表达于耐药株转移灶;PKC-ε与cIAP及CD44共定位于细胞膜。
综上所述,在髓系白血病中,PKC-ε参与调节P-gp、cIAP及CD44所介导的白血病细胞耐药、转移及增殖。
[1] Su JL,Yen CJ,Chen PS,et al.The role of the VEGF-C/VEGFR-3 axis in cancer progression[J].Br JCancer,2007,96:541-545.
[2] Saad F.Src as a therapeutic target inmen with prostate cancer and bone metastases[J].BJU Int,2009,103:434-440.
[3] Beesley AH,Cummings AJ, Freitas JR, et al.The gene expression signature of relapse in paediatric acute lymphoblastic leukaemia:implications for mechanisms of therapy failure[ J].Br J Haematol,2005,131:447-456.
[4] Banerjee S,Ganapathi R,Ghosh L,et al.Down-regulation of ras and myc expression associated with mdr-1 overexpression in adriamycinresistant tumor cells[J].Cell Mol Biol,1992,38:561-570.
[5] Xiao X,Li BX,Mitton B,et al.Targeting CREB for Cancer Therapy:Friend or Foe[J].Curr Cancer Drug Targets,2010.
[6] Cook G,Dumbar M,Franklin IM.The role of adhesion molecules in multiplemyeloma[J].Acta Haematol,1997,97:81-89.
[7] Iczkowski KA.Cell adhesion molecule CD44:its functional roles in prostate cancer[J].Am JTransl Res,2010(3):1-7.
[8] Hehlgans S,Haase M,Cordes N.Signalling via integrins:implications for cell survival and anticancer strategies[J].Biochim Biophys Acta,2007,1775:163-180.
[9] Robbins EW,Travanty EA,Yang K,et al.MAP kinase pathways and calcitonin influence CD44 alternate isoform expression in prostate cancer cells[J].BMC Cancer,2008(8):260.
[10] Kuo YC,Su CH,Liu CY,et al.Transforming growth factor-beta induces CD44 cleavage that promotesmigration of MDA-MB-435s cells through the up-regulation ofmembrane type1-matrixmetalloproteinase[J].Int J Cancer 2009,124:2568-2576.
[11] Jin L,Hope KJ,ZhaiQ,etal.Targeting of CD44 eradicateshuman acute myeloid leukemic stem cells[J].Nat Med,2006(12):1167-1174.
[12] Wang SJ,Wong G,de Heer AM,et al.CD44 variant isoforms in head and neck squamous cell carcinoma progression[J].Laryngoscope,2009,119:1518-1530.
[13] Wei X, Dombkowski D, Meirelles K, et al.Mullerian inhibiting substance preferentially inhibits stem/progenitors in human ovarian cancer cell lines compared with chemotherapeutics[J].Proc Natl Acad Sci,2010,107:18874-18879.
[14] Herrlich P,Morrison H,Sleeman J,et al.CD44 acts both as a growthand invasiveness-promoting molecule and as a tumor-suppressing cofactor[J].AnnNY Acad Sci,2000,910:106-118, 120.
[15] Lisignoli G,Monaco MC,Facchini A,et al.In vitro cultured stromal cells from human tonsils display a distinct phenotype and induce B cell adhesion and proliferation[J].Eur JImmunol,1996,26:17-27.
(编校:吴茜)
Study on themetastasis and proliferation ofmyelocytic leukem ic cells mediated by PKC-εregulating cIAP and CD44
BIZuo-mu1,CUIChun-ping2Δ,SUN Gui-zhen3,XU Dong1,ZHOU Qi-feng1
(1.Department of Hematology,The First Hospital Affiliated ofWeifang Medical University,Zibo 255200,China;2.Hematology Research Laboratory(National Key Laboratory),Institute of radiation medicine,Military Medical Science Academy of the PLA,Beijing 100039,China;3.Yiyuan County People's Hospital in Zibo City,Zibo 255200,China)
Objective To explore themechanism of PKC-ε though cIAP,CD44 and P-gp onmyeloid leukemia cell transfer,proliferation and drug resistance.Methods The resistant characteristics of leukemia cell parents lines and drug-resistant strains K562,K562R,HL60 and HL60R were determined by MTTmethod;PKC-εexpression levels in each strainswere detected byWestern blotand immunohistochemistry;CD44 expression in each strains were detected by immunofluorescence and flow cytomery;the proliferation ability of cell lineswere detected by soft agarose assay;co-location of PKC-ε and P-gp,cIAP and CD44 were studied by immunofluorescence.Results The experimental results shoued that the expression of PKC-ε in the myeloid leukemia drug-resistant strains were higher than the parent cell lines,and chemotherapy drug treatment could increase the PKC-εexpression of parent strains.PKC agonist and inhibition test confirmed that the correlation between myeloid leukemia cell transfer and drug resistance and PKC-ε expression was positive,and the correlation betweenmyeloid leukemia cell proliferation and PKC-εexpression was negative.Cells and metastases,cIAP and P-gp expression and the expression of PKC-εwas positively correlated,and the expression of CD44 was negatively correlated to the expression of PKC-ε.Immunofluorescence results showed that PKC-ε and P-gp,cIAP and CD44 were co-located in myeloid leukemia cell membranes.Conclusion PKC-εmediate leukemic cell transfer though regulating P-gp and cIAP,while regulate the proliferation of leukemic cellmediated by CD44.
metastasis;proliferation;PKC-ε;cIAP
R329.24
A
1005-1678(2014)06-0001-06
国家自然科学基金青年科学基金(30800558)
毕作木,男,本科,主任医师、教授,研究方向:血液肿瘤,细胞治疗,E-mail:qch1821460018@163.com;崔春萍,通信作者,女,博士,研究员,研究方向:血液学研究,E-mail:qch1821460018@163.com。
