非放射性EMSA法检测AP-1蛋白DNA结合活性实验优化
2014-09-18房军帆杜俊英方剑乔
房军帆,杜俊英,梁 宜,方剑乔
(浙江中医药大学,杭州310053)
非放射性EMSA法检测AP-1蛋白DNA结合活性实验优化
房军帆,杜俊英,梁 宜,方剑乔*
(浙江中医药大学,杭州310053)
目的 探索一种方案简便,仪器要求较低,且有效的非放射性凝胶电泳迁移率(EMSA)的检测方法。方法 以AP-1蛋白为实验对象,自制退火缓冲液合成生物素标记AP-1探针,抽提炎症大鼠脊髓背角处核蛋白(无需纯化),取10 μg核蛋白与探针室温反应30 min。小型聚丙烯酰胺非变性凝胶电泳后将探针湿转至正电子加强尼龙膜上,紫外交联,ECL显影。通过正常探针与变性探针的竞争实验,证明方法的可靠性。结果 自制退火缓冲液成功合成生物素标记AP-1探针;炎症大鼠脊髓背角处AP-1蛋白与正常探针的结合后产生明显滞后条带,且结合力远高于变异探针。结论 优化后的非放射性EMSA方案,有效降低了实验花费和仪器要求,且结果可信。
凝胶电泳迁移率(EMSA);AP-1;凝胶电泳;实验优化
凝胶电泳迁移实验(electrophoretic mobility shift assay,EMSA),又称凝聚阻滞实验或凝胶电泳迁移率检测,是一种用于研究转录因子和其相关的DNA结合序列相互作用的技术,能对各类转录因子的DNA结合活性进行定性和半定量分析,是一项研究细胞信号转导通路的关键实验技术。该实验技术操作较为复杂,不少学者[1-2]从不同的角度对该技术的优化改进进行了探讨。但这些讨论大多针对放射性EMSA技术。对非放射性EMSA技术的讨论现尚少见。AP-1是最常见的转录因子之一,参与多种基因转录的调控[3]。本实验室立足自身条件,建立了一种简单、实用的非放射性EMSA实验方法,现以AP-1蛋白的DNA结合活性检测为例,介绍如下。
1 材料
1.1 实验试剂 EDTA、Hepes(美国SIGMA公司),Poly(dI·dC)(美国Thermo公司),细胞核和细胞浆蛋白抽提试剂盒(碧云天),BCA法蛋白定量试剂盒(碧云天),其余试剂均为市售分析纯级。
1.2 主要仪器 垂直电泳槽和电泳仪(美国BIO RAD公司),紫外分光光度计(美国BIO RAD公司),Image LAS4000凝胶成像分析系统(美国GE公司)。
1.3 寡核甘酸单链 上海生物工程公司订购生物素标记的AP-1探针寡核甘酸单链(AP-1)和突变AP-1探针寡核苷酸单链(AP-1m),未标记的AP-1探针寡核甘酸单链和突变AP-1探针寡核苷酸单。
1.4 缓冲液配置 STE退火缓冲液[10 mmol/L Tris(pH 8.0),50 mmol/L NaCl,1 mmol/L EDTA]、5 ×TBE 缓冲液(pH 8.3)[450 mmol/L Tris,450 mmol/L硼酸,10 mmol/L EDTA]。结合缓冲液[20 mmol/L Hepes,pH 7.6,75 mmol/L KCl,0.2 mmol/L EDTA,5 mmol/L MgCl2,50 ng/μL Poly(dI·dC),2.5% 甘油,0.05%NP-40]。
1.5 样本和取材 雄性健康SD大鼠,弗氏完全佐剂致炎后3 d,取腰段(L4~6)患侧脊髓背角,-80℃保存。
2 实验方法
2.1 探针合成 严格按说明书操作溶解各单链,如表1配置各管。

表1 探针合成 μL
混匀,95℃水浴5 min,自然冷却,4℃保存。使用前50×稀释生物素标记探针,得20 fmol/μL生物素标记探针和4 pmol/μL未标记探针。
2.2 合成探针检测 上样5 μL,行1%琼脂糖、90 V电压凝胶电泳,凝胶成像分析系统拍摄并分析。
2.3 核蛋白提取 本实验选用细胞核和细胞浆抽提试剂盒,严格按照说明书操作,-80℃保存。
2.4 核蛋白定量 本实验采用BCA法进行蛋白定量,严格按照试剂盒要求操作。
2.5 EMSA反应体系配置 特异性结合测试,如表2设置反应体系,室温孵育1 h。

表2 EMSA反应体系配置 μL
2.6 电泳 6%聚丙烯酰胺非变性凝胶。每管反应体系加入 Loading Buffer 5 μL,抽打均匀后,上样20 μL。100 V 恒压电泳35 min。
2.7 转印 电泳完毕,取出凝胶,切除多余部分,将其与正电子加强Nylon膜、滤纸置于0.5×TBE缓冲液中浸泡15 min,按滤纸、正电子加强尼龙膜、凝胶、滤纸的顺序排列,逐层排尽空气,装入转印槽中,以380 mA恒流湿转30 min。
2.8 紫外交联 将转印好的Nylon膜略沥干后置于紫外交联仪中,254 nm波长、120 mJ/cm2能量紫外交联1 min。
2.9 HRP标记和显影 Nylon膜在封闭液中封闭15 min,再入含HRP的封闭液孵育15 min,清洗5 min×4次。ECL试剂1∶1混匀后,滴加到Nylon膜上室温反应3 min。沥干后,置于凝胶成像系统中拍摄。
3 实验结果
3.1 双链DNA探针合成比对 各泳道合成探针均位于25 bp附近,与理论计算值接近。其中第2泳道和第4泳道探针亮度明显高于第1泳道和第3泳道,表明未标记的双链DNA寡合苷酸浓度高于生物素标记的双链DNA寡合苷酸(图1)。

图1 AP-1探针浓度检测
3.2 AP-1蛋白DNA结合活性检测 本实验通过调整不同核蛋白提取物的加样量,保证每管反应体系中的核蛋白均为10 μg。结果如图2所示,图像下方的浓黑色条带为未与蛋白结合的自由探针条带,图像上方深浅不一的条带是标记探针与蛋白反应的滞后条带。通过竞争实验证明,AP-1探针与蛋白结合具有很强的特异性,改变2个位点后即无法与相应的蛋白产生结合反应(图2)。
3.3 超净台紫外灯交联效果 除普通紫外交联仪外,紫外灯也具有一定的紫外交联效果。如图3所示,该结果为造模后不同时间,大鼠脊髓背角处AP-1蛋白结合活性的改变,该图为采用超净台紫外灯进行紫外交联。与图2相比无明显差距。
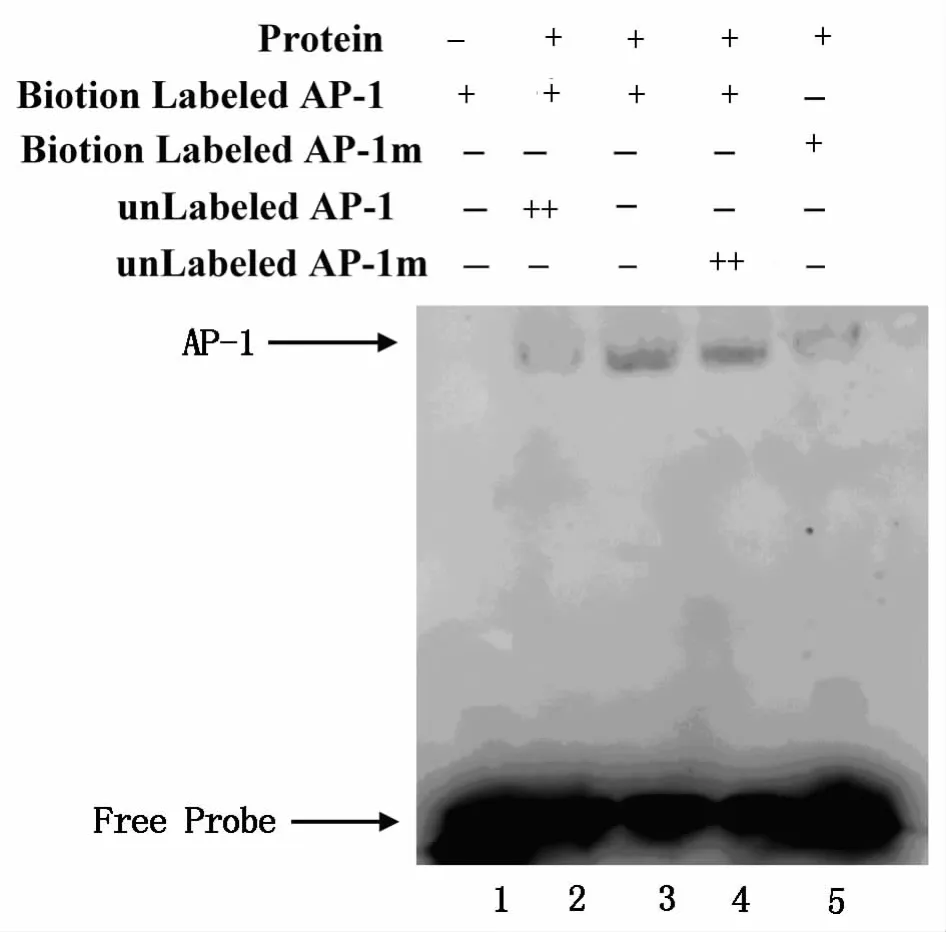
图2 AP-1探针特异性检测

图3 超净台紫外灯紫外交联结果
4 讨论
常用实验技术中免疫组化、免疫印迹(Western Blotting)和EMSA均可用于转录因子检测,但三者的侧重点各有不同。免疫组化或免疫荧光技术可以较准确的反应转录因子的表达部位和表达细胞,Western Blotting可以精确定量转录因子。但并非所有转录因子均可以与DNA结合以刺激基因转录,唯有EMSA技术可以反映转录因子是否具有DNA结合活性,故EMSA是证明细胞信号转导通路最终效应的必要实验技术。目前,随着在基础研究[4-5]和中医药理论及研究[6-8]中针对信号转导通路的研究变的越来越多,EMSA技术随之开始在逐渐普及。该技术原理是将标记过的特异性寡核苷酸探针与核蛋白一起孵育,具有DNA结合活性的转录因子会与探针结合。由于蛋白质的分子量远远大于探针,故凝胶电泳时蛋白结合探针的电泳速率慢于自由探针,形成滞后条带,具有结合活性的转录因子被分离,并可通过各种成像技术检测。同时进行的竞争实验则可以证明探针的特异性。竞争实验中加入过量未标记的探针,通过与标记探针竞争性结合转录因子,使滞后条带消失。冷竞争实验中加入过量未标记的突变探针,对滞后条带则几乎无影响。
笔者认为,EMSA方法灵敏度高,但其操作较为复杂。完整的EMSA操作过程包括探针的合成与标记,探针与DNA的结合,电泳,转印,显影等多个步骤,任一步骤发生错误均可能导致整个实验的失败,故对其反应条件和实验方法进行优化势在必行。笔者结合实验室自身条件,反复尝试,对其中的几个关键步骤进行了优化,并成功完成了相关实验检测[9]。
探针的标记,传统的EMSA技术多使用放射性同位素标记探针。该标记法的优点是灵敏度高,但同位素的放射性严重威胁实验人员的健康,且半衰期较短,不宜保存,对实验技术有很高的要求。采用生物素标记探针,化学发光法进行检测的EMSA技术,在保证灵敏性前提下,避免了对人体健康的威胁,是一种值得推广的探针标记方法。但直接在双链寡核苷酸探针上标记生物素[10],其标记效率底下,且效率不稳定。每次标记完成都需要测量标记效率,大大增加了工作强度。理论上,单链探针不会与转录因子结合,因而不会对实验结果产生影响。因此,笔者发现可直接顶购标记好的单链寡核苷酸,自行退火合成双链探针。退火合成的双链探针其标记效率接近100%,不仅避免了反复测量标记效率的繁琐实验步骤,且在一定程度上提高了实验的灵敏性。
核蛋白抽提,理论上使用纯化的核蛋白是最佳选择,但是大多数实验室并不具备相关技术和仪器。常规提取的核蛋白只要适度延长孵育时间一样可以得出良好的结果。如上述实验中,AP-1探针与核蛋白的孵育时间为1 h。
电泳参数,探针的分子量多在20~30 bp之间,而蛋白质的分子量却大多在30 KD以上,故两者间电泳速率差极大。同时,由于DNA探针和转录因子的结合是一个可逆过程,故应采用高电压电泳以防止探针和蛋白的解离。但高电压电泳会增大发热量,除冰浴外还需进行预电泳以降低电流强度。但预电泳会进一步加大探针和转录因子之间的电泳速率差。为了保证图像的完整性,多需要采用15 cm长度以上的大型胶进行实验。笔者通过反复优化得出,当被测转录因子的分子量小于50 KD时,在8 cm长度的小型胶上,采用如下电泳参数可获得较满意的实验结果:无预电泳,100 V恒压电泳35 min。
简易紫外交联,高品质的尼龙膜和良好的紫外交联不仅可以得到较好的实验结果,更可以延长实验结果的保存期限。常规的紫外交联仪即胜任。但如实验室缺乏相应的设备,可以使用超净台的紫外灯代替。超净台内照射15 min可以获得一定的交联效果。交联后采用自封袋保存尼龙膜,正常室温下可以储存1周。
经过如上改进,不仅减少了EMSA实验的耗费,降低了对实验设备的要求,且易于获得背景干净,条带清晰的实验结果。优化后的EMSA实验,结果稳定,可重复性高,并适用与其他核转录因子DNA结合活性的检测。
:
[1]蒲泽锦,吴灵飞.核因子-κB电泳迁移率变动分析方法的改进[J].汕头大学医学院学报,2005,18(3):169-171,174.
[2]王勇,黄文华.一种改进的核转录因子的电泳迁移率改变分析法[J].第三军医大学学报,2001,23(1):119-120.
[3]Sharma-Walia N,Krishnan H H,Naranatt P P,et al.ERK1/2 and MEK1/2 induced by Kaposi's sarcoma-associated herpesvirus(human herpesvirus 8)early during infection of target cells are essential for expression of viral genes and for establishment of infection[J].J Virol,2005,79(16):10308-10329.
[4]李波,田芳,陈华民,等.c-di-GMP抑制转录调控因子Clpxoo与葡聚糖酶基因启动子的结合[J].微生物学报,2013,53(11):1166-1171.
[5]Datta G,Fuller B J,Davidson B R.Molecular mechanisms of liver ischemia reperfusion injury:insights from transgenic knockout models[J].World J Gastroenterol,2013,19(11):1683-1698.
[6]杨蔷,舒鹏.中药逆转胃癌细胞多药耐药机制研究[J].长春中医药大学学报,2013,29(2):266-268.
[7]王高超,张琪.中医药逆转心力衰竭心肌重塑研究进展[J].长春中医药大学学报,2012,28(6):1110-1112.
[8]闫颖,杨宇,袁建,等.三甲散加减方对实验性肝纤维化大鼠TGF-β1/Smads信号通路的影响[J].吉林中医药,2009,29(11):997-1000.
[9]杜俊英,房军帆,梁宜,等.电针对 CFA大鼠脊髓背角CREB的DNA结合活性影响研究[J].中华中医药学刊,2014(1):50-53,226.
[10]Ray P,Rialon-Guevara K L,Veras E,et al.Comparing human pancreatic cell secretomes by in vitro aptamer selection identifies cyclophilin B as a candidate pancreatic cancer biomarker[J].J Clin Invest,2012,122(5):1734-1741.
Optimized non-radioactive EMSA for detecting AP-1 protein DNA binding activity
FANG Junfan,DU Junying,LIANG Yi,FANG Jianqiao*
(Zhejiang University of Chinese Medicine,Hangzhou 310053,China)
Abstract:ObjectiveTo explore a lower instrument required,easier program and effective non-radioactive electrophoretic mobility shift assay(EMSA)detection methods.MethodsWith AP-1 proteins as experimental subject,nuclear protein was extracted from spinal cord dorsal horn of inflammatory rats.10 μg nuclear protein responded with AP-1 probe 30 min at room temperature,which was synthesized by homemade annealing buffer synthetic.After non-denaturing polyacrylamide gel electrophoresis,probe was transferred to the positron reinforced nylon membrane,UV crosslinking and exposured by ECL.To check the effective of the protein-DNA interactions,competitive EMSA was performed.ResultsAP-1-probe was synthesized by homemade annealing buffer synthetic.AP-1 probe bound very efficiently to the AP-1 protein extracted from spinal cord dorsal horn of inflammatory rats,and the competitive probe did not contain appreciable level of binding ability.ConclusionThe optimized non-radioactive EMSA effectively reducing the experimental cost and equipment requirements,and the results are credible and worthy of promotion.
Key words:EMSA;AP-1;gel electrophoresis;experiment optimized
R285.5
A
2095-6258(2014)04-0600-04
10.13463/j.cnki.cczyy.2014.04.014
国家自然科学基金资助项目(30873305),浙江省“重中之重”学科(针灸推拿学)建设经费资助(浙教高科[2008]255号),浙江省自然基金资助项目(Y2091151)。
房军帆(1985-),男,博士研究生。研究方向:针灸镇痛与免疫调节。
*
方剑乔,男,教授,电子信箱:fangjianqiao7532@163.com。
张海洋
2014-01-25)
