插穗粗度和扦插深度对杞柳萌条和生根的影响1)
2014-09-18孙洪刚邵文豪刁松锋姜景民
孙洪刚 邵文豪 刁松锋 姜景民
(中国林业科学研究院亚热带林业研究所,富阳,311400)
短周期矮化经营(Short Rotation Coppice,SRC)作为生物质直燃热电原料的重要培育模式之一,已被世界上多个国家和地区成功推广应用[1-5],而柳树(salix spp.)由于具有适应性广、易萌芽更新、生长快、耐樵采、高热值等优点[6-8],则成为 SRC 的重要模式树种之一。世界上SRC技术成熟的国家(如瑞典、芬兰、澳大利亚、美国),已在柳树品种适应性[9]、无性繁殖[10-13]、杂交育种[14-15]以及栽培模式[16]等方面各自都形成了完整的培育体系。
柳树生物质矮化能源林主要采用硬枝插穗进行扦插造林,这主要是因为硬枝插穗可以保持优良品系遗传性状的稳定性和一致性[14];继续繁殖体的发育阶段,缩短林分生长周期[17];林分生长节律一致,减少内部竞争消耗,提高最终收获量[13]。目前,有关硬枝扦插造林的研究,主要集中在插穗的营养成分以及插穗粗度对扦插成活率、萌蘖和生根能力等方面作用关系。Burgess等[10]研究白柳(Salix alba L.)插穗粗度与扦插成活的关系发现:较细插穗,由于其内部N、P和K等无机元素以及碳水化合物的含量均较少,无法满足根系生成过程中的养分需求,从而降低了扦插成活率。Carpenter等[12]以黑柳(Salix nigra)为研究对象进一步指出:非结构性碳水化合物含量是影响插穗存活的主要因素。而有关插穗粗度与插穗成活生长之间关系,多数研究结果比较一致,即随插穗粗度增大,休眠芽萌动时间越早,萌条数量越多,萌条长度越长,相应的地上生物量也越高[13-14,18]。实际上,除插穗粗度外,插穗的存活和生长表现与扦插深度也有重要关系。柳树由休眠芽萌动长出萌条,皮孔产生不定根,因此,不同插穗粗度和扦插深度,将导致地上休眠芽和地下皮孔数量差异,进而影响萌条和根系的数量及生长状况;其次,萌条和根系的形成和生长过程中均需消耗同一穗条内部的养分,这可能导致二者间发生养分竞争;最后,柳树插穗萌条嫩枝合成的内源激素具有重要的生根诱导效应,这意味着萌条和根系在生长过程中可能具有某种相关性。本研究为检验上述假设,以杞柳作为试验材料,探讨插穗粗度与扦插深度对扦插造林的作用规律,也为柳树扦插育苗的早期生长管理提供理论依据和技术支持。
1 材料与方法
本研究所使用的杞柳插穗,均取自中国林业科学研究院亚热带林业研究所的3年生杞柳种质资源收集圃。制穗标准:(1)插穗中部直径不得小于0.5 cm;(2)插穗长度均为30 cm。依据插穗中部直径的大小,将插穗粗度划分为TC1(0.5 ~1.4cm)、TC2(1.5 ~2.4 cm)和 TC3(2.5 ~3.4 cm);根据插穗插入土中的深度分为TD1(9 cm)、TD2(15 cm)和TD3(21 cm)。采用完全随机区组设计布置试验,共计9个处理,每个处理重复3次,每个重复50个插穗。
于2013年3月第1周在浙江省富阳市东山村水稻弃耕地内进行扦插试验,土壤类型为砂质红壤。该区域属于亚热带季风气候带,年平均气温16.2℃,年均降水量1452 mm。弃耕地经过翻土、耙平后,统一做成高40 cm、宽200 cm、床间距50 cm的苗床,扦插株行距为20 cm×30 cm。
1.1 测定指标
在扦插45 d后,确认插穗成活并统计各项指标。将插穗挖出,做好标记,带回实验室洗净根部泥土。测定萌条数量(NS)、萌条长度(LS)、萌条基径(DS);分离枝条和叶片;剪除根系。利用Win Rhizo根系扫描仪(regent instruments,Québec,Canada)测定根系总长度(TRL)和根系平均直径(ARD);而后将根系、枝条和叶片烘干后测定根系生物量(BR)、枝条生物量(BS)和叶片生物量(BL);地上生物量(BA)为烘干后的枝条和叶片干质量之和;地下生物量(BU)为根系干质量。
1.2 数据处理
利用方差分析(ANOVA)和广义线性回归模型(GLRM)估计插穗粗度和扦插深度对上述各指标的影响差异,对同一指标不同处理之间的差异性多重比较采用t检验的最小显著差(LSD)进行分析;利用逐步回归方法构建根系总长度预测模型,上述所用试验数据分析均采用SPSS(V18.0)进行。
2 结果与分析
2.1 插穗粗度和扦插深度对萌条生长的影响
插穗粗度和扦插深度对插穗萌条数量、萌条基径和萌条长度都有极显著影响(p<0.01)。萌条基径和萌条长度均随插穗粗度和扦插深度的增加而增大;但萌条数量随插穗粗度的增加而增大,随扦插深度的增加而减小(表1)。LSD结果表明:萌条数量、萌条基径和萌条长度在3种插穗粗度间均差异显著。插穗粗度为1.0、2.0和3.0 cm 时,萌条数量分别为8.19、10.88 和 15.86 个,同 1.0 cm 粗度的萌条数量相比,2.0 cm和3.0 cm 分别增加24.72%和48.36%;插穗粗度为 1.0、2.0 和 3.0 cm 时,萌条基径分别为 2.05、2.74 和3.32 mm,较 1.0 cm 插穗粗度的萌条基径而言,2.0 cm和3.0 cm插穗粗度的萌条基径分别增加2.19%和38.25%;插穗粗度为1.0、2.0 和 3.0 cm 时,萌条长度分别为 16.93、24.29和32.28 cm,同1.0 cm插穗粗度的萌条长度相比,2.0 cm 和 3.0 cm 分别增加 30.32%和 47.61%。扦插深度为9、15和21 cm时,萌条数量分别为11.00、10.39和7.62个,但3种扦插深度间的萌条数量差异不显著;萌条基径随扦插深度增大而增大,分别为2.35、2.48 和3.18 mm,虽然9 和15 cm 扦插深度都与21 cm扦插深度时的萌条基径间差异显著,但9和15 cm扦插深度间的萌条基径差异不显著;萌条长度随扦插深度增大而增大,分别为19.41、21.90和24.16 cm,但三者间差异也不显著(表2)。
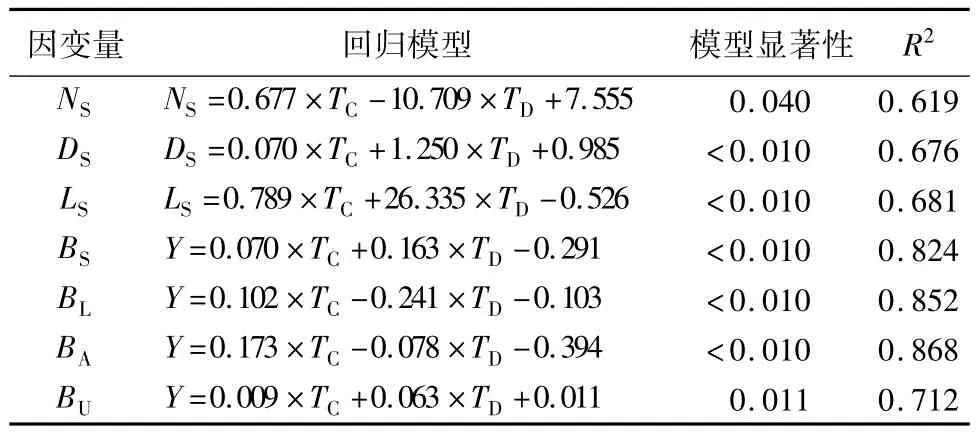
表1 插穗粗度和扦插深度对插穗生长影响的广义线性回归模型
2.2 插穗粗度和扦插深度对根系生长的影响
插穗粗度和扦插深度的交互作用对根系总长度和根系平均直径影响均并不显著(p>0.05),但插穗粗度对根系总长度和根系平均直径的影响均显著(p<0.05)。插穗粗度和根系总长度的线性回归方程为:TRL=1.442 ×TC+141.27(R2=0.42),这表明随插穗粗度增加,根系总长度也越长,插穗粗度每增大1个单位,根系总长度将增大2.442个单位,而插穗粗度与根系平均直径的线性回归方程为:ARD=-0.048 × TC+7.877(R2=0.58),这表明:根系平均直径随着插穗粗度的增大而减小,插穗粗度每增大1个单位,根系平均直径减小1.048个单位(图1)。
2.3 生物量分配
插穗粗度和扦插深度对各器官生物量的影响程度和作用方向差别较大。插穗粗度对枝条生物量、叶片生物量、地上生物量和地下生物量均具有不同程度的正向促进作用;而扦插深度仅对枝条生物量和地下生物量的生长有正向促进作用,叶片生物量和地上生物量则随则扦插深度增大而降低。方差分析结果表明:插穗粗度以及插穗粗度和扦插深度的交互作用对枝条生物量、叶片生物量、地上生物量和地下生物量均有显著影响,但扦插深度的变化对各器官生物量均没有显著影响。进一步利用LSD分析发现:枝条生物量、叶片生物量、地上生物量和地下生物量均随插穗粗度的增加而增大,且不同插穗粗度间差异显著;而3个扦插深度间各生物量指标差异均不显著(表3)。另外,由图2可知:在扦插早期,插穗地上和地下生物量基本呈正向同速生长关系,叶片和枝条生物量间也呈正向线性同速生长关系,但由二者间的回归系数可知,枝条生物量增加要远大于叶片生物量(图2)。
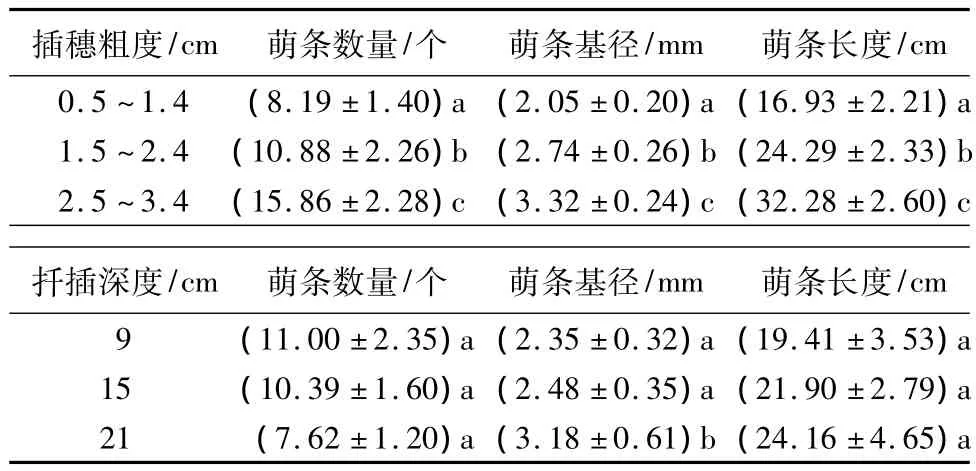
表2 插穗粗度和扦插深度对萌条数量、萌条基径和萌条长度的影响
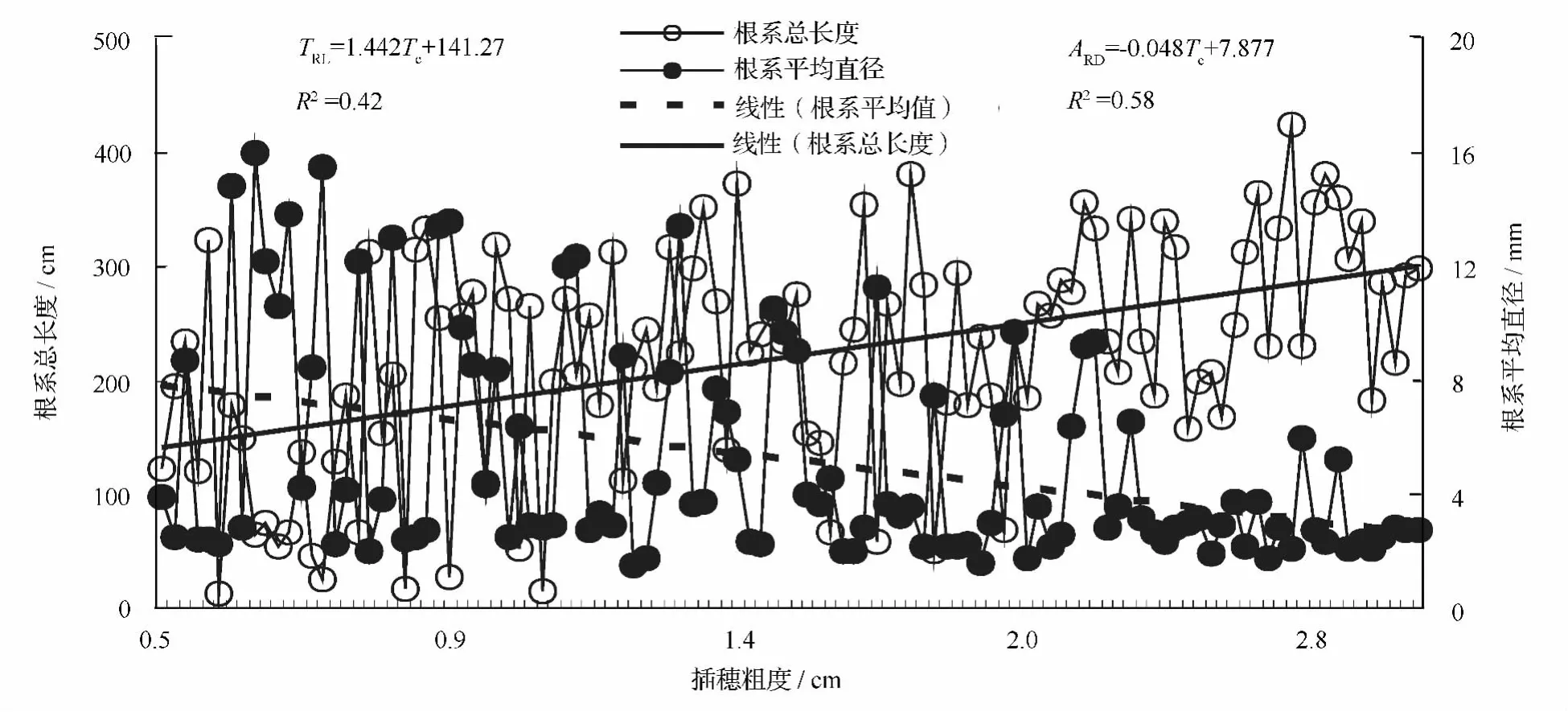
图1 插穗粗度对根系总长度和根系平均直径的影响
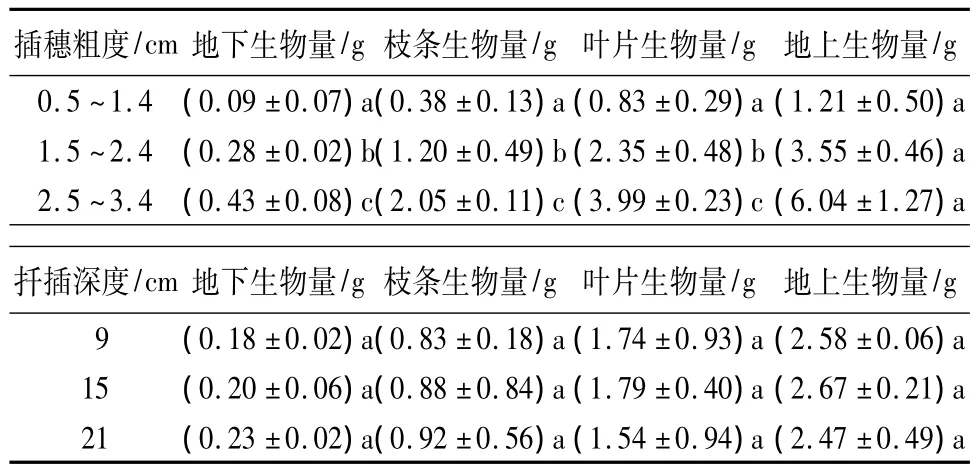
表3 插穗粗度和扦插深度对生物量生长的影响
2.4 根系和萌条指标间的相关性
Pearson相关分析表明(表4):萌条和根系各指标间均显著相关,最大相关性存在于萌条长度和根系总长度间(0.690),而萌条基径和根系总长度间相关性最小(0.413)。萌条指标间萌条长度与萌条基径间具有极显著相关(0.620);根系指标间根系总长度与根系(地下)生物量间显著相关(0.535)。
以萌条长度指标为自变量,根系长度为因变量,利用逐步回归分析方法构建根系生长预测模型:
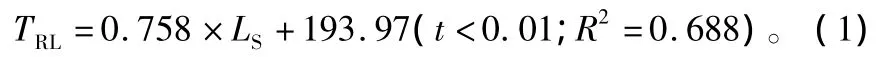
模型(1)表明:萌条长度与根系总长度呈线性正相关,萌条长度每增加1个单位,根系总长度增加1.758个单位,因此可利用萌条长度来预测根系总长度的生长状况。

表4 杞柳插穗萌条和根系参数间Pearson相关系数
3 结论与讨论
杞柳插穗粗度越大,其表皮休眠芽和生根型皮孔的数量也越多,但如果插穗插入地下比例越大,插穗地上部分休眠芽数量将越少,这也就解释了萌条数量随插穗粗度的增加而增多,随扦插深度增加而减少的原因。同时,插穗粗度越大,其内部含有的N、P和K等营养元素以及碳水化合物的浓度都较高[10],又由于杞柳插穗先生出地上萌条,而萌条在光照下合成的植物生长激素只有达到一定浓度并向下运输到插穗地下部分,才可能诱导根尖分生组织分裂形成根系[19]。因此,在根系生成之前,插穗内所有营养成分都将优先供应萌条生长,从而导致插穗越粗,萌条基径越粗,萌条长度也越长。碳水化合物不仅是插穗生根过程中重要的能量来源,也是基本分生组织细胞的重要结构物质[20]。插穗生出的萌条,可同时合成植物生长素和细胞分裂素等植物激素。其中,植物生长素可刺激根尖分生组织生根和促进根系伸长[21],而细胞分裂素则抑制不定根和侧根的形成,因此,只有当生长素对细胞分裂素的浓度比值超过一定阈值时,才有可能促进插穗生根及根系生长[22]。研究表明:柳树插穗越粗其木质化程度越高,在休眠期来临前所积累的碳水化合物的含量也越高,可以保证不定根形成和伸长的物质和能量需求;另一方面,插穗越粗其萌生能力越强,萌条合成植物生长素浓度很容易达到促进插穗生根的阈值[11,13],植物生长素的生理作用起主导作用,从而可以诱导根尖分生组形成更多的不定根以及促进根系伸长生长。对于较细插穗而言,其木质化程度不高,所含碳水化合物也较少;萌条生长势较弱,其合成生长素对细胞分裂素的浓度比值很难超过生根阈值,限制了根尖分生组织的分裂,不定根数量减少;同时,细胞分裂素较明显的生理作用,对已形成的不定根来说,由于其可以促进不定根分生组织细胞的横向分裂和生长,使得不定根粗度增大。上述分析表明:萌条粗度和扦插深度共同决定了萌条数量的多少,而萌条生长状况主要取决于插穗粗度。同时,插穗粗度也是影响根系生成数量和生长的主要因素,随插穗粗度增大,根系数量越多,根系平均直径越小;反之,插穗越细,根系生成数量越少,但根系平均直径越大。
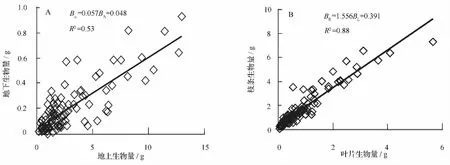
图2 杞柳插穗各组分生物量间的相关性
随插穗粗度增大,穗条内部营养成分含量也越高,从而可以保证萌条生长需要,枝条生物量、叶片生物量和地上生物量也相应较高;而较高地上生物量则可保证生长素对细胞分裂素的浓度比值很容易超过一定阈值,促进插穗生根及根系生长,从而获得较高的地下(根系)生物量。扦插深度的变化将导致休眠芽和皮孔在地上和地下的分配数量有所不同,从而导致萌条和根系在数量上的差异,这也就是插穗粗度和扦插深度的交互作用对各器官生物量产生影响的原因。另外,地上和地下生物量间以及叶片和枝条生物量均呈正向线性相关,这一结果表明:在插穗生出萌条和根系的过程中,叶片和枝条之间以及地上和地下生物量之间均为同速生长过程,各组分间没有由于养分供应不足而发生相互竞争,也就是说,在扦插早期各组分生物量的生长完全受到插穗粗度和扦插深度所影响,这可能与扦插后萌条和生根时间较短有关。
杞柳萌条通过合成内源激素刺激插穗根系的形成和生长,表明二者具有一定因果关系。萌条长度和萌条基径之间以及根系总长度也根系生物量之间均具有显著相关性,则为选择萌条和根系替代指示指标提供了数理依据。本研究中,选择萌条长度为萌条生长指示指标(自变量),根系总长度为根系指示指标(因变量),从而构建了通过萌条指标来预测地下指标生长的回归模型。
[1]Labrecque M,Teodorescu T I.High biomass yield achieved by Salix clones in SRIC following two 3-year coppice rotations on abandoned farmland in southern Quebec,Canada[J].Biomass and Bioenergy,2003,25(2):135 -146.
[2]Elauria J C,Castro M L Y,Racelis D A.Sustainable biomass production for energy in the philippines[J].Biomass and Bioenergy,2003,25:531 -540.
[3]Maria F J,Pareyn F G C,Elcida L,et al.Effects of cutting regimes in the dry and wet season on survival and sprouting of woody species from the semi-arid caatinga of northeast Brazil[J].Forest Ecology and Management,2006,229:294 -303.
[4]Wright L.Worldwide commercial development of bioenergy with a focus on energy crop-based projects[J].Biomass and Bioenergy,2006,30:706-714.
[5]Pérez S,Renedo C J,Ortiz A,et al.Energy potential of waste from 10 forest species in the North of Spain(Cantabria)[J].Bioresource Technology,2008,99(9):6339-6345.
[6]郑海水,何克军,黄世能,等.短轮伐期薪炭林用材林培育技术[M].北京:中国林业出版社,1990.
[7]张志达.中国薪炭林发展战略[M].北京:中国林业出版社,1996.
[8]Faaij A P C.Bio-energy in Europe:changing technology choices[J].Energy Policy,2006,34(3):322-342.
[9]Bonosi L,Ghelardini L,Weih M.Towards making willows potential bio-resources in the South:Northern Salix hybrids can cope with warm and dry climate when irrigated[J].Biomass and Bioenergy,2013,51(3):136-144.
[10]Burgess D,Hendrickson O Q,Roy L.The importance of initial cutting size for improving the growth performance of Salix alba L[J].Scandinavian Journal of Forest Research,1990,5:215-224.
[11]Rossi P.Length of cuttings in establishment and production of short-rotation plantations of Salix‘Aquatica’[J].New Forests,1999,18:161-177.
[12]Carpenter L T,Pezeshki S R,Shields F D.Responses of nonstructural carbohydrates to shoot removal and soil moisture treatments in Salix nigra[J].Trees,2008,22:737-748.
[13]Verwijst T,Lundkvist A,Edelfeldt S,et al.Effects of clone and cutting traits on shoot emergence and early growth of willow[J].Biomass and Bioenergy,2012,37:257-264.
[14]Weih M.Genetic and environmental variation in spring and autumn phenology of biomass willows(Salix spp.):effects on shootgrowth and nitrogen economy[J].Tree Physiology,2009,29(12):1479-1490.
[15]Sevel L,Nord-Larsen T,Raulund-Rasmussen K.Biomass production of four willow clones grown as short rotation coppice on two soil types in Denmark[J].Biomass and Bioenergy,2012,46:664-672.
[16]Mola-Yudego B.Trends and productivity improvements from commercial willow plantations in Sweden during the period 1986-2000[J].Biomass and Bioenergy,2011,35:446-453.
[17]Severino L S,Lima R L S,Lucena A M A,et al.Propagation by stem cuttings and root system structure of Jatropha curcas[J].Biomass and Bioenergy,2011,35:3160-3166.
[18]Saska M M,Kuzovkina Y A.Phenological stages of willow[J].Annals of Applied Biology,2010,156(3):431-437.
[19]Kochhar S,Sing S P,Kochar V P.Effect of auxins and associated biochemical changes during clonal propagation of the biofuel plant-Jatropha curcas[J].Biomass and Bioenergy,2008,32:1136-1143.
[20]Aslmoshtaghi E,Shahsavar A R.Endogenous soluble sugars,starch contents and phenolic compounds in easy-and difficult-toroot olive cuttings[J].Journal of Biological Environment Science,2010,49(11):83-86.
[21]Denaxa N,Vemmos S N,Roussos P A.The role of endogenous carbohydrates and seasonal variation in rooting ability of cuttings of an easy and a hard to root olive cultivars(Olea europaea L.)[J].Scientia Horticulturae,2012,143:19-28.
[22]Husen A,Pal M.Metabolic changes during adventitious root primordium development in Tectona grandis Linn.F.(teak)cuttings as affected by age of donor plants and auxin(IBA and NAA)treatment[J].New Forest,2007,33:309-323.
