乳酸菌在豆奶中的驯化及生长特性*
2014-09-18胡耀辉魏升宁朴春红于寒松刘俊梅代伟长
胡耀辉,魏升宁,朴春红,于寒松,刘俊梅,代伟长
(1.吉林农业大学食品科学与工程学院,长春 130118;2.国家大豆产业技术研发中心加工研究室,长春 130118)
乳酸菌在豆奶中的驯化及生长特性*
胡耀辉1,2,魏升宁1,朴春红1,2,于寒松1,2,刘俊梅1,2,代伟长1,2
(1.吉林农业大学食品科学与工程学院,长春 130118;2.国家大豆产业技术研发中心加工研究室,长春 130118)
将鼠李糖乳杆菌、嗜热链球菌、两歧双歧杆菌和保加利亚乳杆菌4种乳酸菌,接在豆浆和牛奶不同比例组成的培养基中进行驯化。驯化后,分别测定了他们各自在豆浆中的生长特性。结果表明:鼠李糖乳杆菌、嗜热链球菌和保加利亚乳杆菌,在100%豆浆中不能稳定的传代,从第二代就开始生长缓慢,并且接种生长到菌体开始自溶的时间短;在豆浆含量为80%时,可以稳定的传代,生长良好;而两歧双歧杆菌可以适应100%豆浆,在其中可以稳定传代,生长良好。
驯化;pH值变化;稳定传代
豆浆是中国传统的食品,为中国的广大消费者所喜爱。但是随着生活水平的提高,传统的豆浆已经不能完全满足消费者的要求,消费者对健康饮食提出了更高的需求,如益生菌产品的需求,而益生菌中,乳酸菌在其中占了重要位置。但是乳酸菌在牛乳中生长良好,在豆浆中则不能很好的生长。为了解决这个问题,该研究将鼠李糖乳杆菌、嗜热链球菌、两歧双岐杆菌和保加利亚乳杆菌4种乳酸菌,接种在豆浆中驯化,逐渐提高驯化培养基中的豆浆比例,使这4种乳酸菌适应豆浆的生长环境。最后,再对驯化后这4种乳酸菌在纯豆浆中的生长状况做了测定。
1 材料与方法
1.1 材料
黄豆:吉林省;脱脂奶粉:完达山牌;NaHCO3(食品级):市售;鼠李糖乳酸杆菌、嗜热链球菌、两歧双岐杆菌和保加利亚乳杆菌均为实验保藏菌种。
1.2 仪器与设备
SG280D1豆浆机:苏泊尔牌;LML850A胶体磨:温州市七星乳品设备厂;YXQSG41280手提式压力蒸汽灭菌器:上海华线医用核子仪器有限公司;DHP120恒温培养箱:上海试验仪器厂。
1.3 方法
1.3.1 培养基配方
1.3.1.1 复壮培养基的配制
(1)鼠李糖乳杆菌MRS培养基。蛋白胨10 g,葡萄糖20 g,酵母浸膏5 g,乙酸钠5 g,柠檬酸氢二铵2 g,牛肉膏10 g,Tweeen-80 1mL,K2HPO42 g,MnSO4· 4H2O 0.25 g, MgSO40.58 g,琼脂20.0 g,蒸馏水1 000mL,pH值7.2。
(2)嗜热链球菌用马铃薯汁牛乳培养基。200 g马铃薯去皮煮汁,脱脂鲜乳100mL,酵母膏5 g,琼脂粉15 g,加水至1 000mL,pH值7.0。制平板培养基时,牛乳与其他成分分开灭菌,倒平板之前混合。
(3)两歧双岐杆菌用TPY培养基。酪蛋白胨10 g,大豆蛋白胨5 g,酵母粉2.5 g,葡萄糖5 g,吐温801 mL,K2HPO42 g,MgCl2· 6H2O 0.5 g,CaCl20.15 g,ZnSO4· 7H2O 0.25 g, FeCl30.1 g,半胱氨酸盐0.5 g,调pH值6.5,121℃灭菌15min。
(4)保加利亚乳杆菌用番茄汁琼脂培养基TJA。番茄汁50mL,酵母粉5 g、牛肉膏10 g、乳糖20 g、葡萄糖2 g、K2HPO42 g、吐温801mL、乙酸钠5 g、琼脂15 g、水1 000mL,pH值6.8±0.2。
1.3.1.2 驯化培养基的配制
干豆与水比1:12的豆浆,豆浆机打浆,过胶体磨(120目),沸水煮浆10min过150目滤布除去豆渣,获得豆浆。逐渐减少脱脂乳粉的添加量分别配制不同豆浆浓度的驯化培养基,在温度112℃,15min,灭菌备用。
1.3.2 驯化实验流程
不同菌种在豆浆中的驯化流程如下:冻干菌粉活化→20%豆浆培养基→40%豆浆培养基→60%豆浆培养基→70%豆浆培养基→80%豆浆培养基→90%豆浆培养基→100%豆浆培养基
具体操作方法:
(1)从冻干菌粉中,挑取一小菌块接种于10mL脱脂乳培养基中(脱脂奶粉:水=1:9);温度37℃下培养至凝乳后,以5%接种量继续传代进行活化,使菌种活力提高。活化至2~3代后,便可以用于菌种驯化了。
(2)驯化过程中,为保证菌种的稳定传代,在每个驯化梯度的豆浆和牛奶组成的培养基中要多传几代,直至菌种在这个梯度凝乳时间达到最短,并且凝乳时间基本一致为止。在驯化过程中,菌种会退化,这个时候需要用1.3.2.1复壮培养基进行复壮。
1.3.3 驯化程度评定方法
菌体计数用细菌计数板计数;pH值测定用pH计检测。
2 结果与讨论
2.1 鼠李糖乳杆菌在80%豆浆中的驯化结果
由图1和图2可知:鼠李糖乳杆菌在80%豆浆中(其余20%为还原脱脂乳,以下相同),在3 h左右时结束对数生长期,此时菌体数达到3.8×108cfu/mL,并开始大量的产生乳酸,在5 h左右80%的豆浆开始凝乳(开始凝乳时,pH值从5.2到5.3;在pH值4.8时凝乳状态达到最佳,以下的凝乳pH值相同),9 h菌体开始衰退,13 h pH值和菌体数量稳定下来,并能保持较长的时间(24 h基本不变)。鼠李糖乳杆菌在80%豆浆中能够稳定传代生长,而在100%豆浆中则生长的不好,虽然第一代仍然能够凝乳,但是在100%豆浆中传至二代到三代时,不能继续使豆浆凝乳。
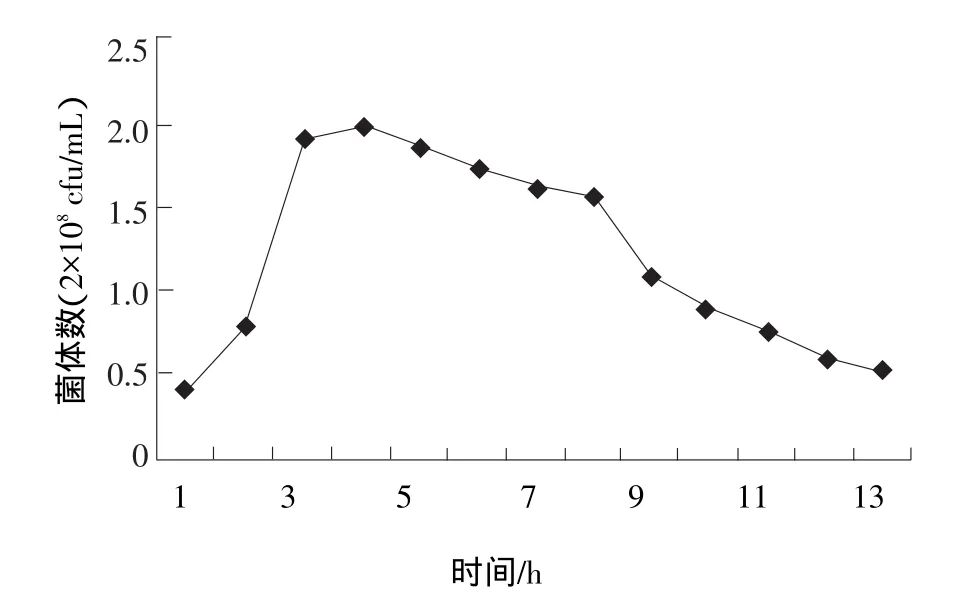
图1 鼠李糖乳杆菌在80%豆浆中随时间的变化情况
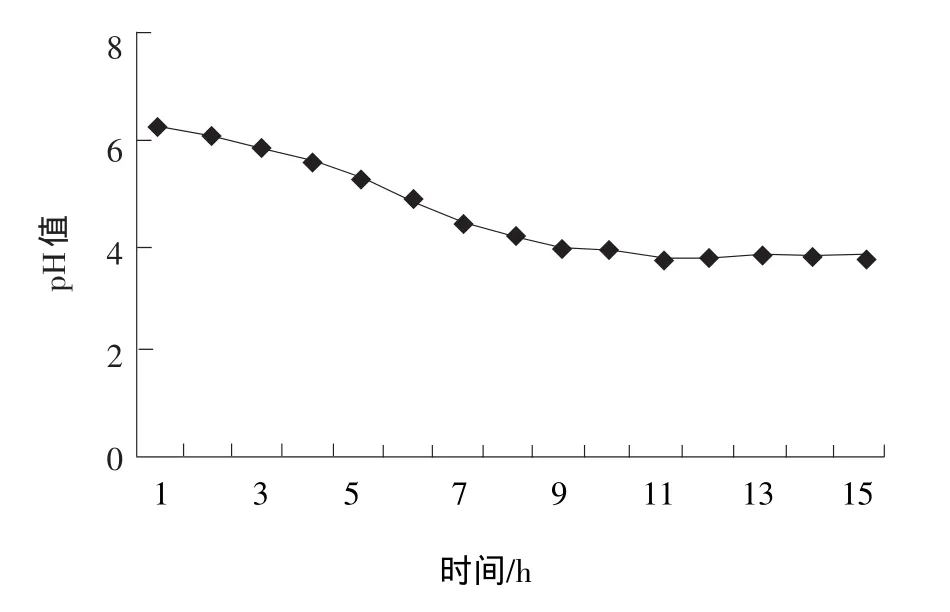
图2 80%豆浆在鼠李糖乳杆菌接种后的pH值变化
2.2 嗜热链球菌驯化结果
由图3和图4可知:嗜热链球菌在80%豆浆中,3 h左右结束对数生长期,达到3.75×107个/mL;但在2.5 h左右就开始大量产乳酸,pH值降到5.30,并开始凝乳;在之后的4 h里仍缓慢增长;到5 h,pH值下降缓慢了;从8 h,菌体则开始衰退。10 h开始,pH值稳定下来并保持在3.92,且24 h内基本不变了,同时菌体数量也很稳定。嗜热链球菌在80%豆浆中,能够稳定传代生长;而在100%豆浆中生长繁殖则差,虽然能够凝乳,但是在100%豆浆中传至3~4代时,就不能继续使豆浆凝乳了。
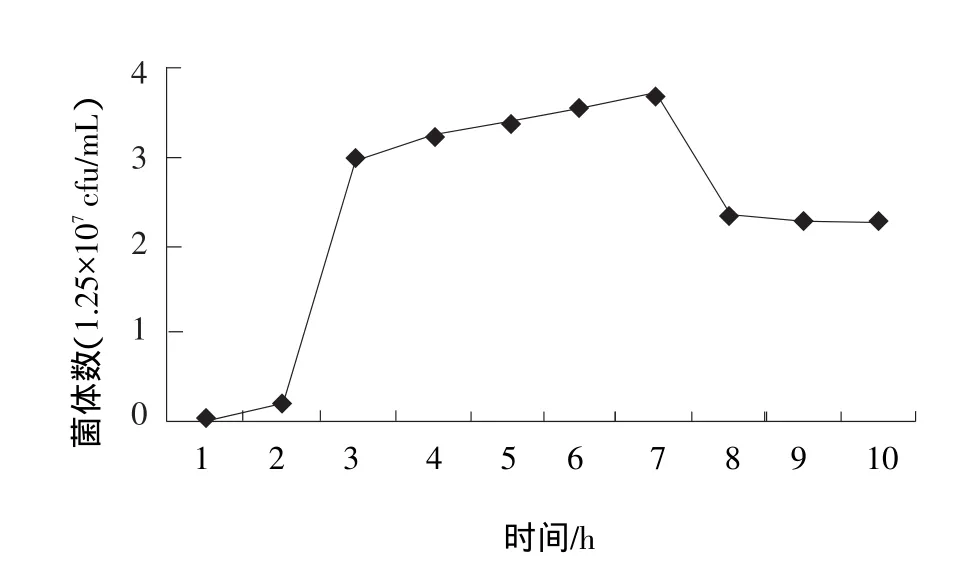
图3 嗜热链球菌在80%豆浆中生长状况
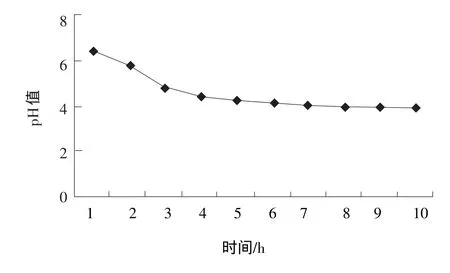
图4 80%豆浆在接种嗜热链球菌后的pH值变化
2.3 两歧双岐杆菌驯化结果
由图5和图6可知:两歧双歧杆菌在6 h结束对数生长期,菌体数量达到最高值2.38×1010个/mL,并在接下来的24 h内菌体数量维持恒定的数值。pH值在4 h左右达到5.20~5.30,豆浆的凝乳性状很好;13 h时开始pH值24 h内几乎不在变化,维持在4.40左右。两歧双岐杆菌能够很好的适应100%豆浆的生长环境,传代性状稳定,生长繁殖很好,在100%豆浆传至六七代时,仍然能继续使豆浆凝乳。
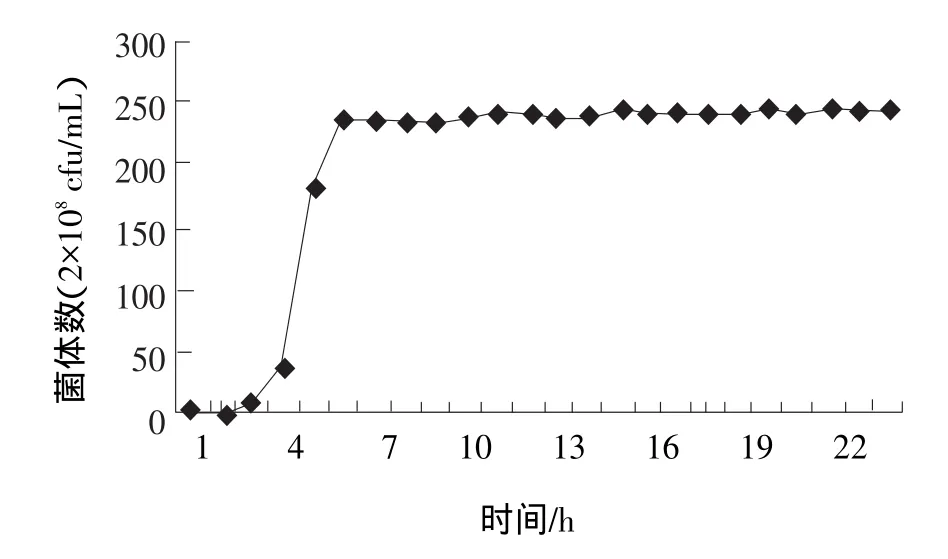
图5 两歧双岐杆菌在100%豆浆中的生长状况
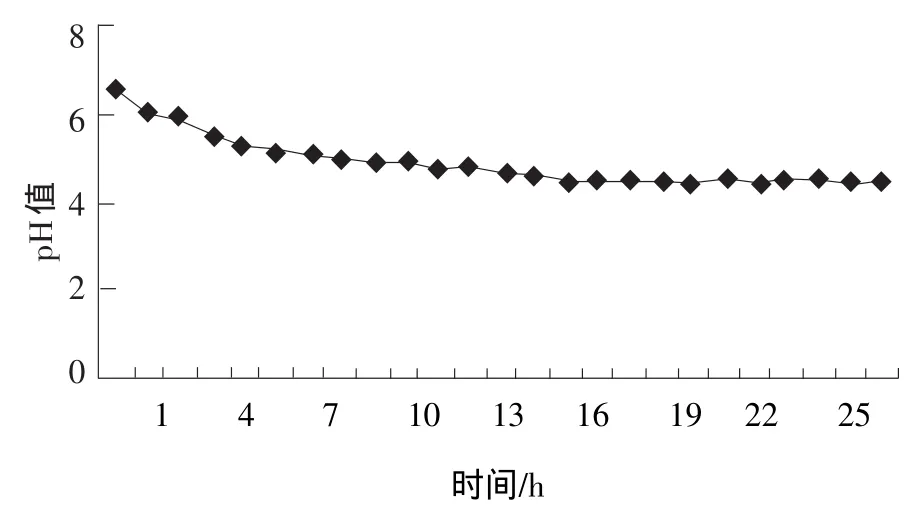
图6 100%豆浆在接种两歧双岐杆菌后的pH值变化
2.4 保加利亚乳杆菌驯化结果
由图7和图8可知:保加利亚乳杆菌在80%豆浆中能够稳定传代生长繁殖;而在100%豆浆中则生长差,虽然一代能使豆浆凝乳,但是在100%豆浆中传至2~3代时,就不能继续使豆浆凝乳了。
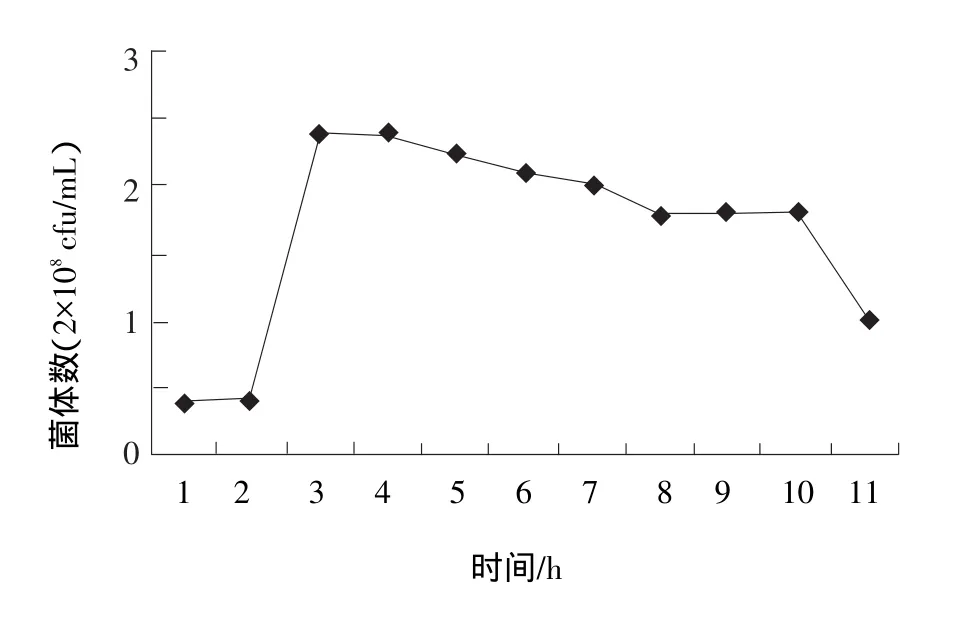
图7 保加利亚乳杆菌在80%豆浆中生长状况
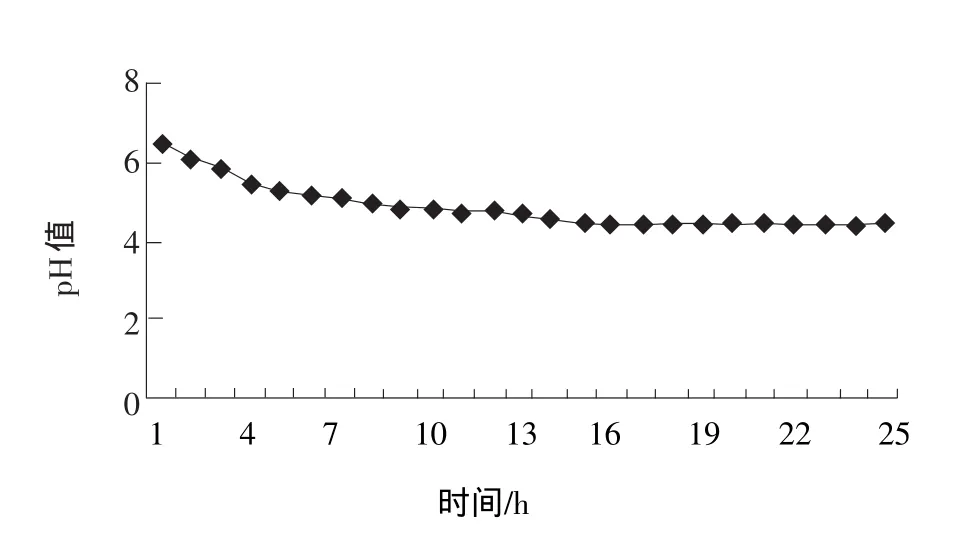
图8 80%豆浆在接种保加利亚乳杆菌后的pH值变化
3 结论
通过以上实验的数据与结果,做出以下结论:
(1)两歧双歧杆菌在豆浆中驯化后可以适应100%豆浆的生长环境,正常生长。
(2)鼠李糖乳杆菌,嗜热链球菌,保加利亚乳杆菌,在80%豆浆里能很好的保持凝乳特性,保持高活力;从80%豆浆接种到100%豆浆,能够稳定的凝乳,但是凝乳时间较长;从90%豆浆接种到100%豆浆可以凝乳但是凝乳时间更长且凝乳性状不稳定;100%豆浆到100%豆浆基本不能凝乳。
(3)豆浆凝乳从pH值5.3开始变稠,pH值降到5.0~5.1时凝乳基本就可完成,再降到4.7~4.8时开始有乳清析出(纯豆浆,不加任何稳定剂和乳化剂)。
:
[1]赵为,宋金春,王晓红.乳酸菌发酵酸黑豆浆的研究[J].乳业科学与技术,2010(2):81-84.
[2]Shigehiro Kataoka.Functional Effects of Japanese Style Fermented Soy Sauce(Shoyu)and Its Components,The Society for Biotechnology[J].2005,100(3):227-234.
[3]Bernard F.Gibbs,Alexandre Zougman,Robert Masse,Catherine Mulligan.Production and characterization of bioactive peptides from soy hydrolysate and soy-fer⁃mented food[J].Food Research International,2004(37):123-131.
[4]Marla S.J.Manzoni,M.Sc,Elizeu A.Rossi,Ph.D,Iracil⁃da Z.etal.Fermented soy productsupplemented with iso⁃flavones affected fat depots in juvenile rats,Nutrition[J].2005(21):1018-1024.
[5]李大鹏,高玉荣,张慧玲.凝固型酸豆奶的研制[J].农产品加工·学刊,2008(5):31-33.
[6]赵宇星,周惠明,钱海峰.酸豆乳生产菌种的驯化研究[J].食品科技,2004(6):28-30.
[7]毛吉明.发酵酸豆乳脱腥工艺的研究[J].中国食品添加剂,2006(6):85-88.
[8]王军辉,查学强,姜绍通.发酵豆奶制作工艺优化的探讨[J].合肥工业大学学报,2008,31(7):1029-1033.
[9]RenWang,Xing Zhou,Zhengxing Chen.High pressure in⁃activation of lipoxygenase in soymilk and crude soybean extract[J].Food Chemistry,2008(106):603-611.
[10]Y.-S.Song,J.Frias,C.Martinez-Villaluenga,C.Vidal Valde-verde,E.Gonzalez de Mejia.Immunoreactivity re⁃duction of soybeanmeal by fermentation,effect on amino acid composition and antigenicity of commercial soy prod⁃ucts[J].Food Chemistry,2008(108):571-581.
[11]李雅乾,田洪涛,苏旭东.双歧杆菌发酵胡萝卜汁酸乳贮藏稳定性研究[J].食品与机械,2006,22(4):94-96.
[12]苏秀荣,王汉忠,李全阳,等.酸奶发酵剂中嗜热链球菌与保加利亚乳杆菌生长关系的微量量热法研究[J].食品与发酵工业,2007,28(19):38-41.
[13]杨洁彬.乳酸菌-生物学基础及应用[M].北京:中国轻工业出版社,1996:180-182.
[14]万红兵,田洪涛,马乐辉,等.保加利亚乳杆菌番茄复合汁增菌培养基的优选研究[J].中国乳品工业,2006,34(8):14-17.
[15]张丽芳,田洪涛,苑社强,等.干酪乳杆菌发酵大豆乳产品的质量分析及稳定性的研究[J].现代食品科技,2009,25(5):519-522.
TS275.5
B
1674-3547(2014)01-0043-04
*本文原刊自《农业机械》2011年第9期,由中国食品工业协会豆制品专业委员会供稿。
现代农业产业技术体系建设专项资金资助
胡耀辉,男,教授,研究方向为生物反应器与功能性食品
