低温几丁质酶生产菌的筛选鉴定与产酶条件研究
2014-09-18王晓辉张庆芳迟乃玉
王晓辉,张庆芳,迟乃玉
(大连大学 生命科学与技术学院,辽宁 大连 116622)
几丁质(Chitin)又称甲壳素、甲壳质,是由 β-1,4-N-乙酰-D-氨基葡萄糖组成的直链多聚物,其含量在自然界中仅次于纤维素居第二位,据报道,海洋环境中每年就有超过 1011吨几丁质形成[1-2]。几丁质是多数真菌细胞壁的主要成分,同时也存在于昆虫的外壳和肠道中。几丁质的降解产物几丁寡糖、壳聚糖等低聚寡糖及 N-乙酰氨基葡萄糖等具有抗菌、抗肿瘤等活性,几丁质及其衍生物在化工、食品、化妆品、印染、造纸、农业、环保等方面都有广泛用途[3-4]。自然界中几丁质的降解主要通过产几丁质酶的微生物代谢完成。
几丁质酶(Chitinase,EC3.2.1.14)是专一降解几丁质为几丁寡糖或几丁单糖的一组酶的总称[5]。主要由内切几丁质酶(chitinase,EC 3.2.1.14)、外切几丁质酶(chitinase,EC 3.2.1.14)和 β-N-乙酰己糖胺酶(β-N-acetylhexosaminidase,EC 3.2.1.52)组成。内切几丁质酶在高聚几丁质链内随机切割生成几丁质寡糖(chitooligosaccharides, (GlcNAc)n, n>2);外切几丁质酶有两种,分别从高聚几丁质链的还原端和非还原端依次切割下(GlcNAc)2;β-N-乙酰己糖胺酶将从非还原端将几丁质寡糖切割成为GlcNAc。某些物种中还发现了几丁质结合蛋白,起到分散几丁质糖链束的作用[5-6]。根据几丁质酶氨基酸序列同源性不同,将其分为18和19两个家族。其中,18家族几丁质酶广泛存在于病毒、微生物、植物和动物中,而 19家族几丁质酶主要存在于植物中。此外,在链霉菌属和部分拟诺卡氏菌属的放线菌中也发现了19家族几丁质酶,18家族和19家族几丁质酶之间没有序列相似性,说明它们由不同祖先进化而来[6]。
在海洋环境中,几丁质是最重要的营养源和能源[7]。海洋约占地球表面积的70%,具有高盐(3.5%)、高压(>100 Mpa)、低温、低光照、寡营养等特点,以及无光照、局部高温(400 ℃)等极端生态环境,其中平均温度为5℃的海水占总海水的90%,为适应低温环境,在其中生活的微生物,必然具备低温环境下高催化活性的酶系[8-10]。本研究从海洋底泥样品中筛到高产低温几丁质酶菌株,并通过形态学对其进行鉴定,详细优化其生长特性与产酶条件,旨在获得新酶源微生物资源,为酶的克隆表达及工业生产奠定基础。
1 材料与方法
1.1 材料与仪器
样品采自中国辽宁大连渤海海域近海底泥 5~100 m(123。396,E, 39。7014,N),样品采集后迅速装入无菌保鲜袋冻存于-20 ℃冰柜,运回实验室后转至-80 ℃。
1.2 试剂与仪器
几丁质粉chitin (C8H13NO5)n,N-乙酰氨基葡萄糖购自美国 Sigma-aldrich公司,胰蛋白胨 (Tryptone)购自生工生物工程(上海)股份有限公司,其它均为国产分析纯试剂。
LRH系列生活培养箱、HWS24型电热恒温水浴锅,上海一恒科学仪器有限公司;全温振荡培养箱,太仓市华美生化仪器厂;IX73型显微镜,日本Olympus公司。
1.3 胶体几丁质的制备[11]
取10.0 g几丁质置于研钵,于通风橱内缓慢加入100 mL,85%的浓磷酸,同时不断的用玻璃棒充分搅拌。将研钵用保鲜膜封口,4℃下过夜。然后,用大量的蒸馏水冲洗,直到pH为5.0左右后离心,用缓冲液(如0.1 M磷酸缓冲液,pH7.0)定容为1 L。配制成1%胶体几丁质溶液,避光保存于冰箱备用。
1.4 培养基
筛选培养基:胶体几丁质10.0 g/L,胰蛋白胨5.0 g/L,琼脂粉15.0 g/L,原地海水配制,pH自然;
2216E种子培养基[11]:牛肉膏1.0 g/L,胰蛋白胨5.0 g/L,原地海水配制,pH自然;
发酵培养基:胶体几丁质5.0 g/L,胰蛋白胨5.0 g/L,原地海水配制,pH自然;
2216E保藏培养基[11]:牛肉膏1.0 g/L,胰蛋白胨5.0 g/L,琼脂粉15.0 g/L,原地海水配制,pH自然。
1.5 酶活检测
取粗酶液0.1 mL与0.9 mL,1%胶体几丁质混合,20℃下保温30 min后,将反应混合物加热在沸水浴中10 min终止酶反应,10,000×g离心5 min,取上清0.5 mL,加入 1 mL Schales’试剂[12],沸水浴 10 min,测定OD420nm,设3个重复,取平均值,根据N-D--乙酰氨基葡萄糖标准曲线计算酶活力。酶活单位定义(U):在上述条件下,每分钟催化产生l μmol N-乙酰-D-氨基葡萄糖所需的酶量。
1.6 产低温几丁质酶菌株的筛选方法
1.6.1 菌株的初筛
称取10.0 g海洋底泥,放入盛有90 mL无菌水及玻璃珠的三角瓶中,150 r/min振荡15 min使样品充分分散混匀,按梯度(10-5,10-6等)稀释后涂布于含有胶体几丁质的筛选培养基平板。20℃倒置培养2~3 d,挑取产生透明圈比较明显的菌株进行多次划线纯化,并结合显微镜观察得到纯菌株。
1.6.2 产低温几丁质酶菌株的复筛
将单菌落挑取一环,接种于5 mL种子培养基,
参考《常见细菌系统鉴定手册》[13]。
1.8 生长曲线与产酶曲线的测定
1.8.1 生长曲线的测定
挑取单菌落接入5 mL,2216E液体种子培养基,20℃、150 r/min振荡培养24 h后,种子液以1%的接种量转接于装有100 mL,2216E的液体种子培养基中,做3瓶,每隔2或4 h取样测OD600nm,取平均值,绘制生长曲线。
1.8.2 产酶曲线的测定
挑取单菌落接入5 mL,2216E种子培养基,20℃、150 r/min振荡培养24 h后,种子液以1%的接种量转接于装有100 mL发酵培养基中,做3瓶,每隔2 h取样测酶活。20℃、150 r/min摇床培养24 h。种子液以1%的接种量转接于50 mL产酶发酵培养基,20 ℃、150 r/min培养3d后取样,将发酵液12000 r/min离心10 min,取上清液作为粗酶液测酶活。
1.7 菌株鉴定
1.9 产酶条件试验
挑取单菌落接入5 mL2216E种子培养基中,在20℃下、150 r/min摇床振荡培养24 h,接入发酵培养基,于不同碳源、氮源、温度、pH、接种量、装液量、转速条件下摇床振荡培养30 h,测定酶活性,考察不同产酶条件对低温几丁质产生菌的影响。
2 结果与讨论
2.1 产低温几丁质酶菌株筛选与鉴定
采用胶体几丁质为唯一碳源的分离平板从海洋底泥样品中初筛出菌株,然后将菌株接入发酵培养基制备粗酶液检测酶活,进一步确认该菌株产低温几丁质酶。采用双重指标进行筛选,能有效避免筛选出假阳性菌株,获取真正产低温几丁质酶稳定且活性高的菌株。
本实验分离到产透明圈较大的菌株13株,选取产生透明圈最大、最稳定产酶的一株菌命名为DL-06。菌株DL-06(图1)单个菌落呈淡黄色,半透明,圆形,隆起,表面光滑,边缘整齐,菌苔粘稠,菌体呈杆状,可见单个散生或形成两个聚集,革兰氏染色阴性。
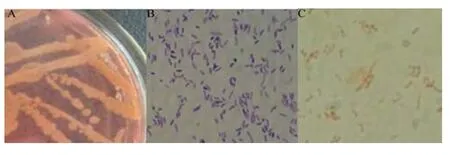
图1 菌株DL-06的菌落形态和显微形态(×1000)
2.2 产低温几丁质酶菌株生长曲线与产酶曲线测定
菌株 DL-06生长曲线与产酶随培养时间的变化如图2所示。由生长曲线可以看出,20℃培养时,菌株0~6 h为延滞期,6~30 h为对数期,30~50 h为稳定期,50后缓慢进入衰亡期。同时该菌株培养20~30 h内其酶活呈现陡增态势,30 h时酶活达最大值为1.884 U/mL,相应菌密度为最大值,30 h后发酵液中酶活逐步下降。确定该菌株最适培养时间为30 h。
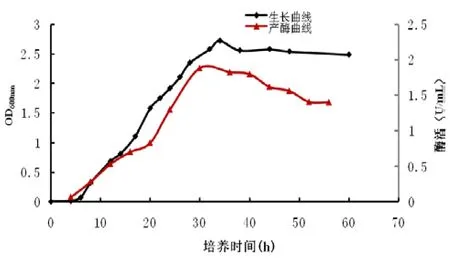
图2 培养时间对低温几丁质酶产生菌DL-06生长曲线及产酶影响
2.3 海洋细菌DL-06产酶条件优化
本实验对菌株 DL-06产低温几丁质酶的单因素条件进行了优化,包括最佳碳源、最佳氮源、起始pH、温度和接种量等优化研究,每个因素设 3个平行。
接种低温几丁质酶产生菌DL-6单菌落于2216E种子培养基,150 r/min,20℃下培养14 h后,再次重新接种新鲜配制的种子培养基继续培养8 h,用作优化产酶单因素条件的种子。
2.3.1 碳源对产酶的影响
接种菌株 DL-06种子于分别以胶体几丁质、粉末几丁质、羧甲基纤维素、羧甲基纤维素钠、壳聚糖、微晶纤维素为碳源(浓度5.0 g/L)的发酵培养基,20℃,150 r/min培养30 h,检测酶活。由图3可以看出胶体几丁质和粉状几丁质是菌株 DL-06较好的产酶碳源,该菌株具有较好的降解晶体状粉末几丁质能力,具有潜在工业应用价值。壳聚糖虽然是脱乙酰的几丁质,但并不易于诱导产生几丁质酶,推测该菌株利用脱乙酰碳源底物的能力相对较差;羧甲基纤维素、羧甲基纤维素钠和微晶纤维素有一定的诱导产酶能力,说明来源于菌株 DL-06的几丁质酶具有广泛的底物特异性,且具备较弱的纤维素酶活性,这与纤维素和几丁质两大不溶晶体多糖相似结构特点相关。

图3 碳源对菌株DL-06产几丁质酶的影响
2.3.2 氮源对产酶的影响
菌株分别以有机氮源酵母粉、胰蛋白胨和牛肉膏,无机氮源硫酸铵、硝酸铵、硝酸钠和尿素(浓度5.0 g/L)为氮源的发酵培养基,20℃,150 r/min培养30 h,检测酶活。结果表明菌株 DL-06利用胰蛋白胨作为氮源产酶活力较高,推测是因为胰蛋白胨这种有机氮源含有一定的生长因子等,更容易被菌体吸收利用;另外,无机氮源中尿素产酶能力较高(图4)。

图4 氮源对菌株DL-06产几丁质酶的影响
2.3.3 培养温度对产酶的影响
接种发酵培养基,分别在 15℃、20℃、25℃、30℃、35℃、40℃、45℃和 50℃,150 r/min 培养 30h,检测酶活。由图 5可以看出,菌株产酶最佳温度为20℃,随着培养温度升高,产酶能力迅速降低,表明菌株适合低温产酶,分泌低温几丁质酶。
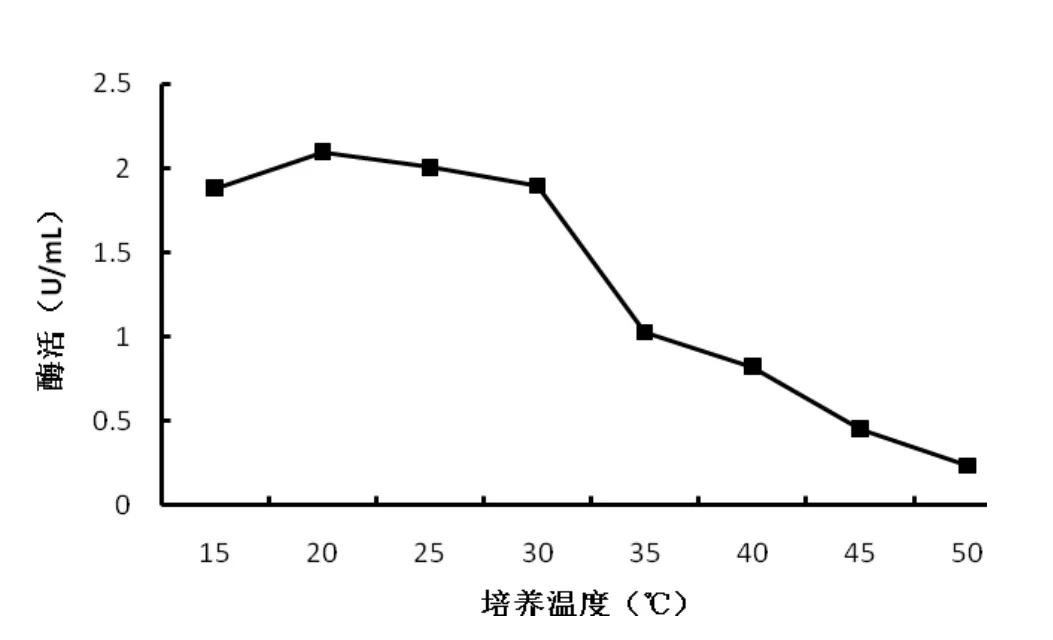
图5 培养温度对菌株DL-06产几丁质酶的影响
2.3.4 起始pH对产酶的影响
接种pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0的发酵培养基,20℃,150 r/min培养30 h,检测酶活。结果表明菌株DL-06在pH7.0时产酶活力最高,为4.129 U/mL,pH 12.0时菌株仍保持48%的酶活力,说明菌株比较适合碱性的产酶环境,这可能与其分离环境渤海湾水域底泥偏碱性有关(图 6)。

图6 起始pH值对菌株DL-06产几丁质酶的影响
2.3.5 接种量对产酶的影响
由图7可以看出,海洋菌株在不同接种量下,几丁质酶活力区别明显。从图中走势可以看出,当接种量为2%时,几丁质酶产量最高。此后,接种量越大酶活越低,由于250 mL三角瓶发酵体积较小,如果接种量过大,菌种大量繁殖,快速消耗营养物质,不利于菌种产酶,但接种量较小,发酵液中营养相对丰富,有利于缩短延滞期,快速进入对数生长期,利于菌种产酶。故2%为海洋菌株的最佳产酶发酵接种量。
2.3.6 装瓶量对产酶的影响
由图8可以看出,海洋菌株在装瓶量为60%较高,低于或高于此酶活力均较低。由于装瓶量主要影响的是溶氧含量,可知该菌种对溶氧量要求并不严苛。由此,装瓶量60%为海洋菌株的最佳产酶发酵温度。
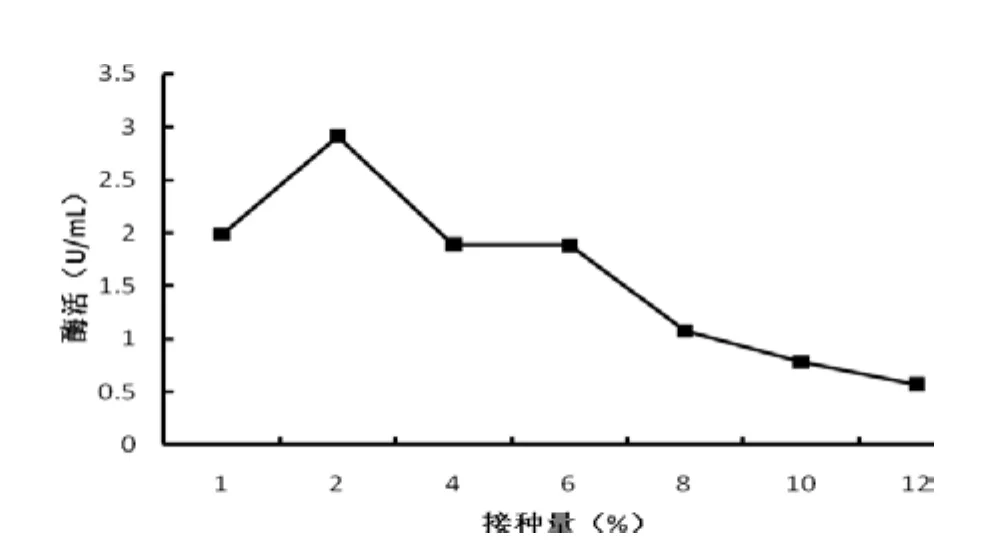
图7 接种量对产几丁质酶的影响
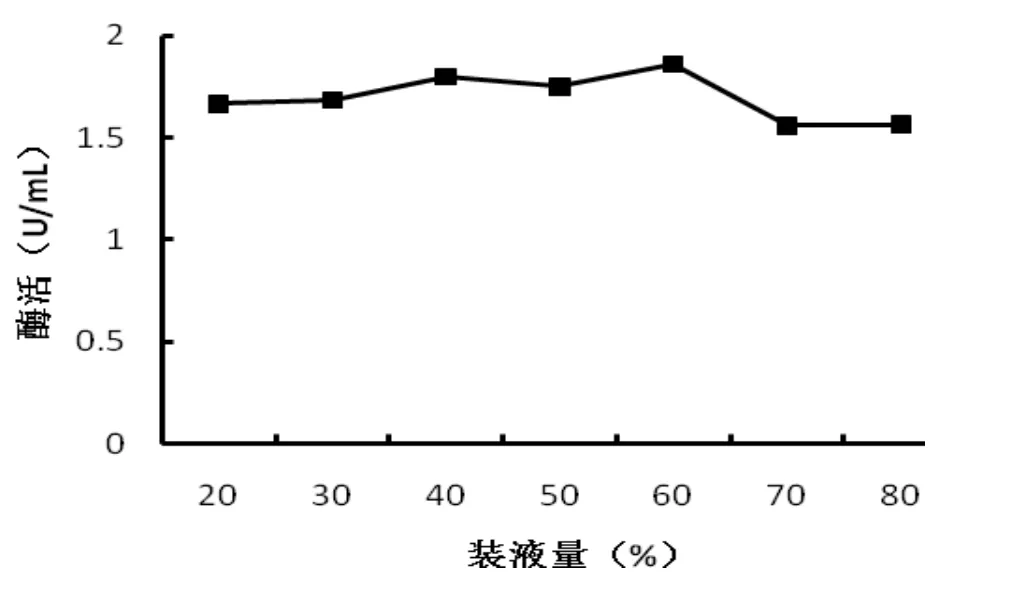
图8 装瓶量量对菌株DL-06产几丁质酶的影响
2.3.7 转速对产酶的影响
选取摇床转速为70 r/min、90 r/min、110 r/min、130 r/min、150 r/min、170 r/min,20℃培养30 h测定酶活力,结果见图9。菌株产酶受转速影响较小,当转速为 130 r/min时酶活力达到最大值,为 2.737 U/mL。转速为70 r/min时酶活最低为0.897 U/mL,仍保持32.7%酶活。表明该菌种为兼性厌氧菌,虽然该菌在有氧条件下比无氧条件下生长好,但厌氧环境更易产酶。因此培养转速确定为130 r/min。
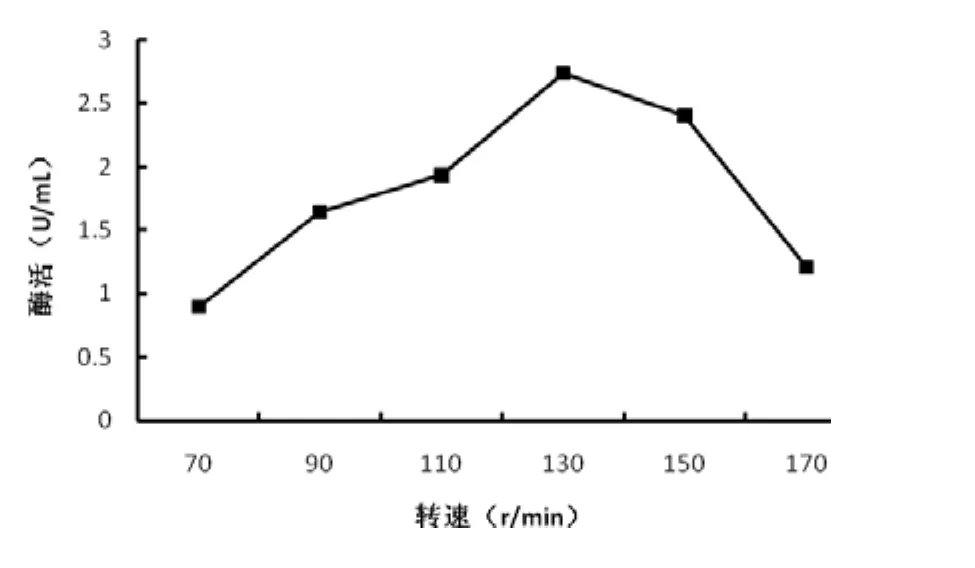
图9 转速对产酶的影响
2.4 最佳产酶条件下产几丁质酶活力的测定
通过细菌 DL-06产低温几丁质酶条件的优化,其产酶量有所增加,以最佳的产酶条件发酵菌株DL-06产低温几丁质酶。即胶体几丁质5.0 g/L,胰蛋白胨5.0 g/L,20℃,pH 7.0,2%接种量,装液量60%,130 r/min,陈海水1.0 L,发酵30 h,检测酶活力达6.87 U/mL。
3 结论与讨论
本研究采用胶体几丁质为唯一碳源的培养基,对采自大连渤海底泥样品进行菌株初筛,然后酶活力检测复筛得到1株产几丁质酶活力较高的菌株,经形态学鉴定为革兰氏阴性杆菌。目前文献所报道菌株产几丁质酶活力高低不同,且酶活测定方法、酶活单位的定义及表示方式等差别,给菌株之间酶活力大小的比较带来不便[14-15]。
一般微生物几丁质酶反应的最适温度为40~50℃[16-17],且在高温下容易失活。我们筛选菌株DL-06分泌的几丁质酶最适作用温度为20℃,属于低温几丁质酶,该酶作用温度接近于室温环境,省去工业生产中冷却与加热环节,不仅节约能源且降解生产成本,具有工业开发应用价值。据报道[18]几丁质酶最适催化pH范围较大,多在pH 3.0~11.0,但绝大多数微生物产几丁质酶最适催化 pH 4.0~6.0的偏酸环境,pH 3.0~11.0时通常都比较稳定。本实验菌株DL-06分泌的几丁质酶最适催化pH 7.0,属于中性几丁质酶,但在pH 12.0仍有较高酶活性,有一定嗜碱性。几丁质酶多为诱导酶,培养基中需要几丁质或几丁质衍生物等底物的诱导,本研究菌株 DL-06也是一样,且本研究菌株具有较高降解粉状几丁质能力,同时还表现较弱的纤维素酶活性,具有潜在应用前景。
本实验筛选到产几丁质酶活力较高的海洋细菌DL-06,通过单因素方法优化其最佳的产酶条件,优化后该菌产酶活性较高达6.87 U/mL。该菌产低温几丁质酶具有潜在工业生产与应用价值,为下一步系统的研究其几丁质酶系及其编码基因做好了基础工作。
[1]Claudiana P, Souza & Bianca C, Almeida, et al. The importance of chitin in the marine environment [J]. Mar Biotechnol, 2011, 13(5): 823-830.
[2]Tsujibo H, Orikoshi H, ShiotaniK, et al.Characterization of chitinase C from a marine bacterium, Alteromonas sp. strain O-7, and its corresponding gene and domain structure [J].Appl Environ Microbiol, 1998, 64(2): 472-478.
[3]Horn SJ, Sikorski P, Cederkvist JB, et al.Costs and benefits of processivity in enzymatic degradation of recalcitrant polysaccharides [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(48):18089-18094.
[4]Aam BB, Heggset EB, Norberg AL, et al. Production of chitooligosaccharides and their potential applications in medicine [J]. Mar Drugs, 2010, 8:1482-1517.
[5]Eleni Stefanidi, Constantinos E. Vorgias Molecular analysis of the gene encoding a new chitinase from the marine psychrophilic bacterium Moritella marina and biochemical characterization of the recombinant enzyme [J].Extremophiles, 2008, 12: 541-552.
[6]Ha Ju Park, et al. Characteristics of cold-adaptive endochitinase from Antarctic bacteriumSanguibacter antarcticusKOPRI 21702 [J]. Enzyme and Microbial Technology, 2009(45): 391-396.
[7]Yue Han, Bingjie Yang, Fengli Zhang, et al. Characterization of antifungal chitinase from marine streptomyces sp. DA11 Associated with South China Sea Sponge Craniella Australiensis[J]. Mar Biotechnol, 2009, 11: 132-140.
[8]Jang MS,Lee YM,Cho YS, et al. Overexpression and characterization of a novel chitinase gene from a marine bacterium Pseudomonas sp. BK1 [J].Indian J Biochem Biophys,2005, 2(6): 339-344.
[9]Wipa Suginta, et al. An endochitinase A from Vibrio carchariae: cloning, expression, mass and sequence analyses,and chitin hydrolysis [J]. Archives of Biochemistry and Biophysics, 2004(424): 171-180.
[10]Vincent G H Eijsink, Gustav Vaaje-Kolstad, Kjell M.Vårum, et al.Towards new enzymes for biofuels: lessons from chitinase research [J].Trends Biotechnol, 2008, 26(5):228-235.
[11]S C Hsu, J L Lockwood. Powdered chitin agar as a selective medium for enumeration of actinomycetes in water and soil[J]. Appl Microbiol, 1975, 29(3): 422-466.
[12]Imoto T, Yagishita K.A simple activity measurement of lysozyme [J]. Agric Biol Chem, 1971, 35(7): 1154-1156.
[13]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版, 2001.
[14]王海东, 陈飚, 伦镜盛, 等. 产几丁质酶菌株SWCH-6的筛选、鉴定及其产酶条件的优化研究[J]. 微生物学通报,2008, 35(S): 705-711.
[15]丁秀琼, 张莉, 刘世贵, 等. 几丁质酶产生菌 C4发酵培养基优及其对 Bt的增效作用研究[J]. 四川大学学报,2007, 44(2): 425-429.
[16]Marina Duarte Pinto Lobo, Fredy Davi Albuquerque Silva,Patrícia Gadelha de Castro Landim, et al. Expression and efficient secretion of a functional chitinase from Chromobacterium violaceum in Escherichia coli [J]. BMC Biotechnology, 2013, 13:46.
[17]连明珠. 南极Pseudoalteromonas sp.AC444低温几丁质酶性质分析与基因克隆及普里兹湾深海沉积物中几丁质酶基因多样性研究[J]. 厦门大学学报: 自然科学版, 2006,6(19): 19-24.
[18]Aizi Nor Mazila Ramli, Nor Muhammad Mahadi, Amir Rabu, et al. Molecular cloning, expression and biochemical characterisation of a cold-adapted novel recombinant chitinase from Glaciozyma antarctica PI12 [J]. Microbial Cell Factories, 2011, 10(1): 94.
