喜泊分联合放疗对小鼠H22肝癌移植瘤的抑瘤增敏作用研究
2014-09-18刘伟徐鑫刘媛媛刘斌王喜梅
刘伟,徐鑫,刘媛媛,刘斌,王喜梅
(1.河北省人民医院 肿瘤科,河北 石家庄 050000;2.河北中医学院 护理学院,河北 石家庄 050000;3.河北省人民医院 急诊科,河北 石家庄 050000;4.河北医科大学研究生学院,河北 石家庄 050000)
喜泊分联合放疗对小鼠H22肝癌移植瘤的抑瘤增敏作用研究
刘伟1,2,徐鑫3,刘媛媛4,刘斌1Δ,王喜梅2
(1.河北省人民医院 肿瘤科,河北 石家庄 050000;2.河北中医学院 护理学院,河北 石家庄 050000;3.河北省人民医院 急诊科,河北 石家庄 050000;4.河北医科大学研究生学院,河北 石家庄 050000)
目的观察光敏剂喜泊分对小鼠H22肝癌移植瘤的抑瘤增敏效果。方法建立H22肝癌细胞小鼠移植瘤模型,将荷瘤小鼠随机分为对照组、单纯放疗组、小剂量喜泊分加放疗组(联合Ⅰ组)、中剂量喜泊分加放疗组(联合Ⅱ组)、大剂量喜泊分加放疗组(联合Ⅲ组)共5组,观察第比较5组小鼠14天瘤体积、抑瘤率、增敏q值、小鼠生存时间、病理、细胞凋亡等指标。结果喜泊分联合放疗能够抑制小鼠移植瘤生长;各联合治疗组q值均>1,均有放疗增敏效果,以联合治疗Ⅲ组均值最大;联合组较其他组细胞凋亡率升高,但组间比较差异无统计学意义;联合治疗组较对照组小鼠生存时间延长,以联合Ⅱ组最长,放疗组最短。结论喜泊分联合放疗对小鼠H22肝癌具有抑瘤增敏效果,且在一定范围内(5mg/kg~20mg/kg)其作用与药物浓度呈正相关性;喜泊分联合放疗治疗小鼠H22肝癌可延长小鼠生存期;其增敏机制可能与诱导细胞凋亡有关。
肝癌;喜泊分;抑瘤率;放射增敏;凋亡
1 材料与方法
1.1 实验材料 鼠源性H22腹水型肝癌细胞株(河北医科大学免疫实验室提供);6周龄健康雄性昆明小鼠(体重20~25 g,合格证号:1210050);喜泊分(天津医药销售有限公司,国药准字号H20064306);DMEM培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);细胞凋亡试剂盒(南京凯基生物科技公司);Elekta Synergy S直线加速器(英国Elekta Limited Company)。
1.2 实验方法
1.2.1 细胞株复苏及传代培养 将小鼠H22肝癌细胞从液氮中取出,置入37℃水浴中复苏,将细胞悬液移入DMEM培养液离心管中离心,PBS洗涤细胞2次,在含10%胎牛血清、1%青链霉素的DMEM培养瓶中培养,每2~3 d换液一次。观察细胞形态及其生长状态,当细胞生长达85%~90%融合时进行传代。取生长良好的H22细胞,生理盐水调整细胞浓度至5×107/mL。取3只昆明小鼠,腹部皮肤严格消毒,小鼠腹腔内接种肿瘤细胞悬液0.5m L/只。腹腔接种后3 d即可见小鼠腹部增大,第7天明显肿大,于小鼠右下腹部抽取腹水,生理盐水稀释至5×107/mL后再次进行腹腔传代培养。以上所有操作均在超净工作台进行。
1.2.2 小鼠模型建立 参照文献[3-4],抽取第3代传代7 d的H22肝癌细胞,用生理盐水将腹水稀释至约2×106个瘤细胞/mL,取健康昆明小鼠60只(10只备用),75%酒精消毒小鼠右前肢皮肤后皮下注射肿瘤细胞悬液0.2mL,接种时保证每只小鼠接种部位以及接种肿瘤细胞悬液量一致,观察无瘤液溢出,送回饲养笼。接种后第7天结节平均体积可达到0.8 cm3左右,视为模型制作成功,模型制作成功率100%。选取肿瘤长径为5.5~6.5mm左右结节形状较规则、与肌肉皮肤无粘连小鼠用于实验。
1.2.3 荷瘤小鼠随机分组及处理 将荷瘤小鼠按随机数字法分为5组,即对照组、单纯放疗组(避光10 h后腹腔麻醉状态下给予5 Gy X线放疗)、联合Ⅰ组:小剂量Hp加放疗组(Hp 5mg/kg尾静脉注射,避光10 h后腹腔麻醉状态下给予5 Gy X线放疗;联合Ⅱ组:中剂量Hp加放疗组(Hp 15mg/kg尾静脉注射,避光10 h后腹腔麻醉状态下给予5 Gy X线放疗)、联合Ⅲ组:大剂量Hp加放疗组(Hp 20mg/kg尾静脉注射,避光10 h后腹腔麻醉状态下给予5 Gy X线放疗)。每组10只小鼠,各小鼠背部用皮肤墨水做好标记。
1.2.4 观察肿瘤体积变化、计算肿瘤生长抑制率并绘制肿瘤生长曲线 治疗开始后动态观察各组肿瘤外观、质地、活动度等生长情况。用游标卡尺每隔1 d测量各处理组肿瘤的最长径(LD)及最短径(SD)并详细记录,直至治疗开始后第14天。按照Steel经验公式计算肿瘤体积如下[5]:肿瘤体积V(mm3)=LD×SD2/2。根据各组平均体积绘制肿瘤生长曲线。
1.2.5 肿瘤增敏q值 利用金正均法计算各联合治疗组q值[6],计算公式如下:q=E(A+B)/(EA),其中 E(A+B)表示各联合治疗组对肿瘤的生长抑制率,EA表示单纯放疗组对肿瘤的生长抑制率。
1.2.6 肿瘤抑制率 处理后第14天从每组随机抽取4只荷瘤小鼠,称取体重后,颈部脱臼法处死,立即用手术刀及眼科剪刀完整剥离肿瘤组织,对每块肿瘤组织进行照片采集,电子分析天平称重(g)并记录,同时剥离各小鼠脾脏称重(mg)并记录。依据以下公式计算各实验组荷瘤小鼠肿瘤抑制率(tumor inhibition,TIR):TIR=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%。
1.2.7 荷瘤小鼠生存期观察并绘制生存曲线 治疗第14 d各组剩余荷瘤小鼠不处死,等待其无干预病死,观察各组小鼠生存期,计算其生命延长率,并绘制小鼠生存曲线。生命延长率计算公式如下[7]:生命延长率=(治疗组平均生存天数—对照组平均生存天数)/对照组平均生存天数×100%。
1.2.8 荷瘤小鼠肿瘤组织病理学检查 参照文献[8]将小鼠肿瘤组织保存、固定、浸蜡、包埋,制作腊块,切片,HE常规染色,电子显微镜下分析各组小鼠肿瘤细胞形态学变化。
1.2.9 流式细胞仪检测肿瘤细胞凋亡情况 参照文献[9-10]将每组剥离肿瘤部分组织剪成肿瘤组织小块,置于75%酒精4℃充分固定,经研磨、过滤、离心、弃上清液、上机分析处理后上流式细胞仪检测肿瘤组织凋亡情况。
1.3 统计学方法 采用SPSS17.0进行数据处理。单因素方差分析法进行方差齐性检验和统计分析,应用S-N-K检验对实验数据进行多组间的两两比较分析。各组荷瘤鼠生存分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组肿瘤不同时间瘤体积及生长抑制率 各组小鼠移植瘤体积随时间变化结果见图1。各组小鼠植瘤生长抑制率随时间变化结果见图2。
2.2 肿瘤增敏q值 3个联合治疗组q值均大于1,说明3组均能延缓肿瘤生长,具有放疗增敏作用,其中联合治疗 Ⅲ组q均值最大(见表1)。
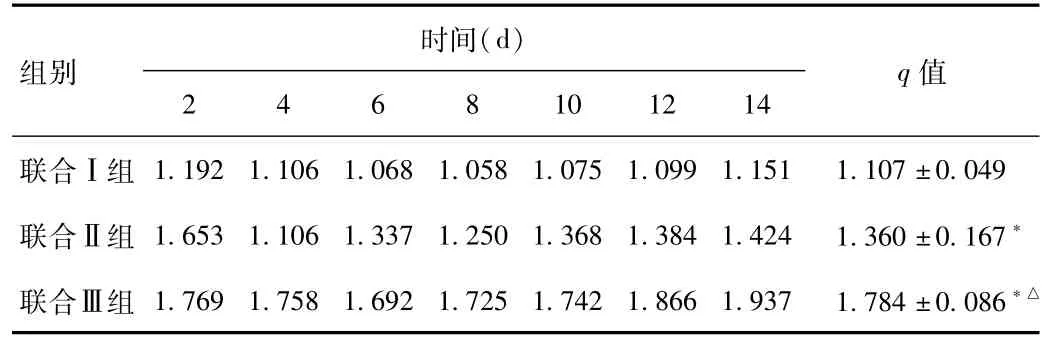
表1 各联合治疗组q值比较Tab.1 Comparision of q values at different time points in different groups
2.3 肿瘤抑制率 第14天各治疗组小鼠瘤重差别有统计学意义(P<0.05,见表2)。

表2 各组第14天肿瘤抑制率Tab.2 The inhibitory rate of tumor grouth after 14 days in different groups
2.4 荷瘤小鼠生存期及生命延长率 治疗后,联合Ⅱ组小鼠生存时间与单纯放疗组比较差异有统计学意义(P<0.05)。其余各组两两比较差异均无统计学意义(见表3、图3)。

表3 荷瘤小鼠生存期及生命延长率Tab.3 tumor-bearingmice survival rate and life extention
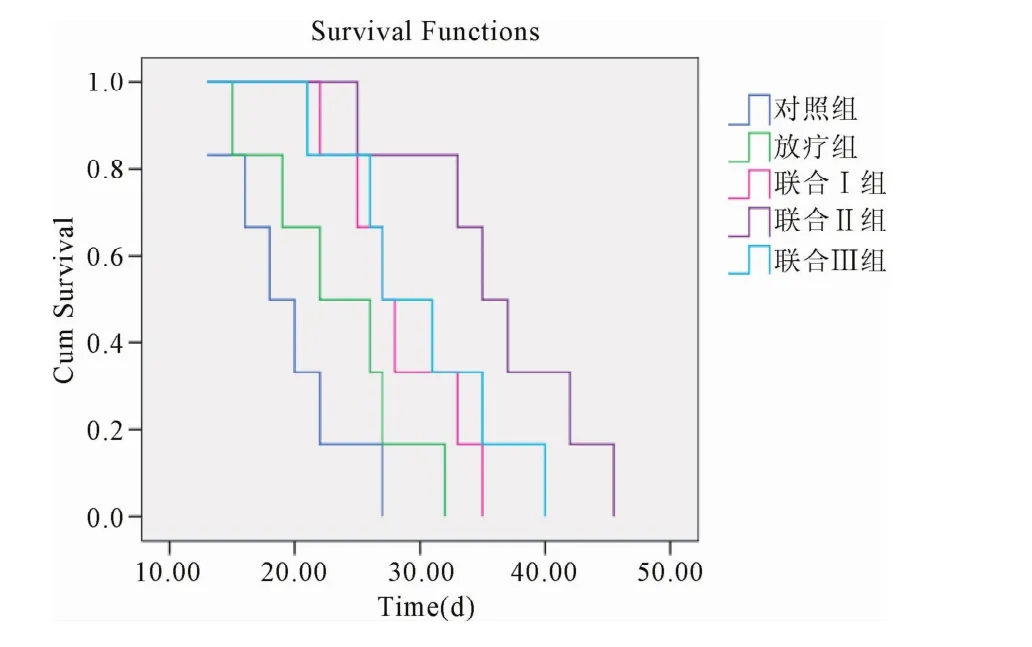
图3 各组小鼠生存曲线Fig.3 Survival curves ofmice in each group
2.5 荷瘤小鼠肿瘤组织病理学检查 对照组:肿瘤细胞体积较大,排列密集,细胞异形性明显,核大深染,部分癌细胞呈癌巢状排列。单纯放疗组:肿瘤细胞数目较对照组减少,排列较稀疏,形态不规则,可见少量坏死组织成分,呈现无组织红染区。联合治疗组:各联合治疗组病理学表现大体相似。肿瘤细胞数目较其余两组明显减少,细胞体积变小,细胞核体积减小,以联合治疗Ⅲ组最明显,组织中可见大量坏死成分,呈现大片无组织红染区(见图4)。
2.6 流式细胞仪检测肿瘤细胞凋亡情况 流式细胞仪检测各组细胞凋亡情况(见图5),各组凋亡率见表4。
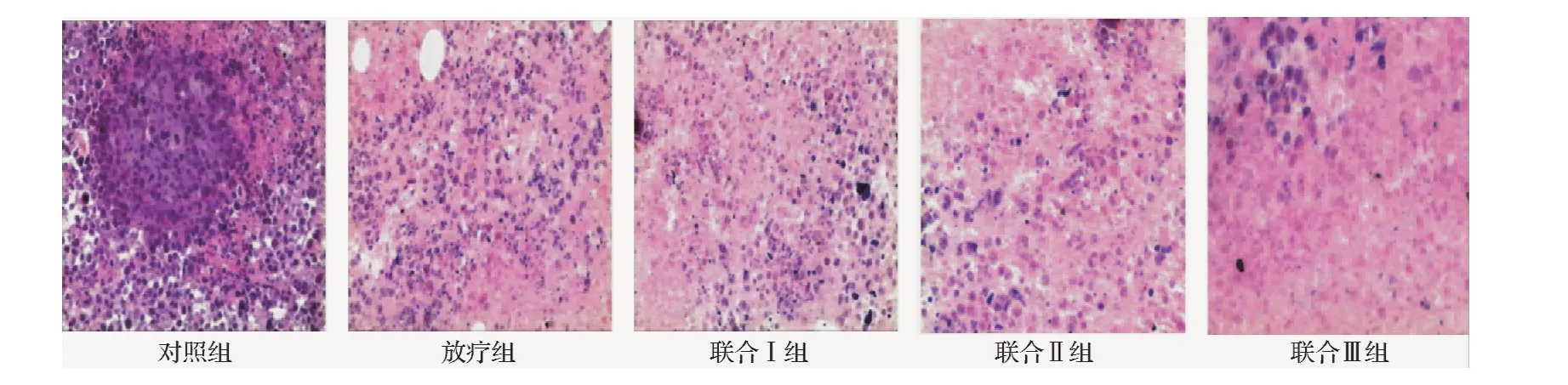
图4 各组移植瘤HE染色(×200)Fig.4 HE staining of xenografts in each group(×200)
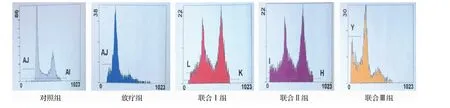
图5 流式细胞仪检测各组移植瘤凋亡情况Fig.5 Flow cytometry apoptosis of tumor in each group

表4 各组肿瘤细胞凋亡情况Tab.4 Apoptosis rate indifferent groups
3 讨论
HCC是最常见的恶性肿瘤之一,发病率较高的地区是亚洲和非洲东南部的一些国家。在我国肝癌发病率排名为第2位,仅次于肺癌。当前统计我国原发性肝癌患者人数占全世界发病总数的55%,死亡人数占全世界原发性肝癌死亡人数的45%。
肝切除术被认为是唯一根治原发性肝癌的治疗方式,但由于该病发病比较隐匿,并且进展迅速,多数患者在就诊时已达到不能进行手术治疗的晚期。即使根治性切除,5年存活率仅为50%~62.7%,10年存活率为6.3%[11],术后5年复发率在50%以上[12],且仍以每年25%的速度递增,复发高峰多在术后1~2年[13]。目前,原发性肝癌的非手术治疗包括肝动脉栓塞化疗术(transcatheter arterial chemoembolization)、射频消融术射频消融术(radiofrequency ablation)、经皮酒精注射(percutaneous ethanol injection)、放射治疗(radiotherapy)及靶向药物治疗等方法。放射治疗已然成为肝癌一种重要的治疗手段,但受到放射性肝损伤及肝脏对放射线耐受性差的限制,对比放射剂量与肿瘤控制和正常组织损伤的曲线,若要提高放疗效果,不能无限的增加放射剂量。放射增敏剂可提高肿瘤细胞对放疗的敏感性及放射线对肿瘤细胞的杀伤率,增强放疗疗效,为肿瘤放射治疗的一个重要研究课题。然而目前还没有令人满意的放疗增敏药物应用于临床[14-16]。
本实验研究的光敏剂Hp易溶于水,便于给药;可被电磁波激发发挥杀伤癌细胞的作用;同时具有对肿瘤的选择性浓集作用;且对重要脏器无明显不良反应,预期对肿瘤有更好的放射增敏效果。对其肿瘤放射增敏作用的研究是本次实验的重点。因其应用尚未被广泛认可,在进行该研究时有必要先采用动物实验的方法探索合适的联合方式及安全的用药剂量。
本实验结果显示,Hp联合放疗对小鼠H22肝癌有一定的抑瘤增敏效果,与国内学者夏云飞[17]、崔瑞耀[18],国外学者Cohen[19]等研究结果一致。本研究显示,Hp联合放疗治疗小鼠H22肝癌可延长小鼠生存期;Hp放射增敏的可能机制是诱导细胞凋亡。本研究结果提示Hp有潜力成为一种新型的放疗增敏药物应用于临床,为恶性肿瘤的治疗提供了新的途径。但Hp作为放疗增敏剂联合X线放疗的剂量、放疗分割方式、应用于临床后的最佳药物剂量及与放疗的联合方式等许多实际性问题仍有待进一步研究解决。
[1]赵维勇,孙新臣.放射治疗增敏的研究现状[J].临床肿瘤学杂志,2012,17(7):655-659.
[2]He Hong.Study on themechanism of Lily polysaccharide induced tumor cell apoptosis.2013,16(8):26-29.
[3]El-Serag H B.Hepatocellular carcinoma[J].N EnglJMed,2011,365(12):1118-1127.
[4]马斌.桑树枝条韧皮部桑根皮素的制备及其对小鼠H22细胞株移植性肿瘤的抑制作用[D].苏州:苏州大学,2013.
[5]唐秋,郭勇,胡巧英.紫龙金对鼻咽癌裸鼠移植瘤放射增敏作用的研究[J].中国肿瘤,2013,22(9):737-741.
[6]祝国风.Ad-ING4-OSM双基因共表达对 SPC-A1肺腺癌移植瘤的抑瘤增效和放疗增敏的实验研究[D].苏州:苏州大学,2013.
[7]李峰.紫杉醇同步放疗治疗小鼠 H22肝癌及放射增敏的实验研究[D].山东:泰山医学院,2011.
[8]艾华.大黄蛰虫丸对 S180荷瘤小鼠肿瘤细胞凋亡的影响[D].东北:辽宁中医药大学,2011.
[9]崔琨,范公忍,姬胜杰.黄芩素对肝癌H22荷瘤小鼠的抑瘤作用研究[J].中国药房,2012,23(31):2897-2899.
[10]陈海彬,沈波,李黎.消癌解毒方抑制肝癌H22移植瘤的生长及其机制[J].中国肿瘤生物治疗杂志,2011,18(1):26-32.
[11]樊嘉,史颖弘,高强.小肝癌的规范化治疗路径[J].中国实用外科杂志,2011,31(1):36-38.
[12]Weng D S,Zhou J,Zhou Q M,et al.Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the shortterm recurrence rates of hepatocellular carcinomas[J].J Immunother,2008,31(1):63-71.
[13]McGlynn KA,London WT.The global epidemiology ofhepatocel-lular carcinoma:present and future[J].Clin Liver Dis,2011,15(2):223-243.
[14]MauceriHJ,Sutton HG,Darga TE,etal.Everolimus exhibits efficacy as aradiosensitizer in a model of non-small cell lung cancer[J].Oncol Rep,2012,27(5):1625-1629.
[15]Xiong H,Lee RJ,Haura EB,et al.Intranuclear delivery of a novel antibody-derived radiosensitizer targeting the DNA-dependent protein kinase catalytic subunit[J].Int JRadiat Oncol Biol Phys,2012,83(3):1023-1030.
[16]Werner ME,Copp JA,Karve S,et al.Folate-targeted polymeric nanoparticle formulation of docetaxel is an effectivemolecularly targeted radiosensitizerwith efficacy dependenton the timing of radiotherapy[J].ACSNano,2011,5(11):8990-8998.
[17]夏云飞,张恩罴.血卟啉衍生物对人鼻咽癌放射增敏的裸鼠实验[J].中山医科大学学报,1995,16(3):39-42.
[18]崔瑞耀,邹伟,沈方臻,等.血卟啉衍生物对大鼠移植瘤放疗的增敏作用[J].青岛医学院学报,1997,33(2):127-128.
[19]Leon Cohen,Samuet Schwarts.Modification of radiosensitivity by porphyrins transphanted rhabdomyosarcoma in mice cancer Research[J].Cancer Reseaech,1976,26:17-19.
(编校:吴茜)
Inhibitation and radiosensitization effects of hematoporphyrin and radiotherapy on H22 liver cancer m ice
LIUWei1,2,XU Xin3,LIU Yuan-yuan4,LIU Bin1Δ,WANG Xi-mei2
(1.Tumor Division,Hebei Provincial People’s Hospital,Shijiazhuang 050000,China;2.College of Nursing,HebeiMedical College School,
Shijiazhuang 050000,China;3.Department of emergency,Hebei Provincial People’s Hospital,Shijiazhuang 050000,China;4.Graduate School,HebeiMedical University,Shijiazhuang 050000,China)
ObjectiveTo observe the inhibitation and radiosensitization effect of hematoporphyrin and radiotherapy on H22 liver cancer mice.MethodsMicemodels of liver cancer were established by subcutaneous injection of H22 cells,tumor-bearingmice were randomly divided into:control group,simple radiotherapy group,small dose hematoporphyrin with radiotherapy group(combined treatment groupⅠ),middle dose hematoporphyrin with radiotherapy group(combined treatment groupⅡ),and high dose hematoporphyrin with radiotherapy group(combined treatment groupⅢ).Tumor volumes,inhibition rate,sensitizing factor,the survival time ofmice,pathology,apoptosis and other indicators in five groups were observed after14 days.ResultsHematoporphyrin and radiotherapy can inhibit tumor growth in mice,The q values in three combined treatment groups were all above 1.0 at different time points,and combined treatmentgroupⅢ was the highest.The three combined treatment groups had higher apoptosis rate than control group and simple radiotherapy group,but the difference within groups were not statistically significant.The survival time in three combined treatment groupswere higher than control group,the combined treatment groupⅡ was the longest and simple radiotherapy group was the shortest.ConclusionHematoporphyrin has tumor inhibitition and radiation sensitizing effect on H22liver cancer mice,and the effect was positive correlation with drug dose.Hematoporphyrin combined with radiotherapy can extend the lifespan ofmice in H22liver cancer,its sensitizing mechanism may be association with induction of H22 cell apoptosis.
hepatocellular carcinoma;hematoporphyrin;inhibition rate;radiosensitization;apoptosis
R735.7
A
1005-1678(2014)03-0057-04
原发性肝癌(Hepatocellular carcinoma,HCC)是全球第六大常见恶性肿瘤(每年全世界新发病例>60万),并且居全世界癌症相关死亡原因的第三位,每年约60万人死于肝癌,在我国因原发性肝癌死亡人数占全世界肝癌死亡人数的45%[1]。原发性肝癌起病隐匿、进展迅速,患者生存期短,预后极差,目前其5年生存率仅维持在3%~5%。肝癌的治疗已成为全世界医疗界的挑战,虽然肝癌根治性切除术后5年生存率可高达50%,但其术后3年复发率可达到45%左右,5年复发转移率可高达60~70%[2]。化疗及介入治疗肝癌效果不太理想,新的靶向治疗需配合局部治疗才可能取得较好疗效。目前肝癌治疗方法不断改进,总体来说,仍然很局限,在预防方面和治疗手段的选择上都不太成熟。本实验通过对小鼠H22肝癌细胞移植瘤模型的研究,测试国产光敏剂血卟啉衍生物(Hematoporphyrin derivative,Hpd)喜泊分(hematoporphyrin,Hp)对X线照射的的抑瘤增敏作用,旨在探讨喜泊分的作用机理,为光敏剂放疗增敏和肝癌治疗新途径提供理论依据。
刘伟,女,硕士,讲师,研究方向:临床肿瘤学,E-mail:XYDH1980@163.com;刘斌,通信作者,男,本科,教授,研究方向:肿瘤综合治疗,E-mail:273860690@qq.com。
